Содержание
- 2. 9 класс
- 3. Амфотерными называются вещества, которые в зависимости от условий проявляют кислотно-основную двойственность. Рассмотрим взаимодействие хлорида цинка с
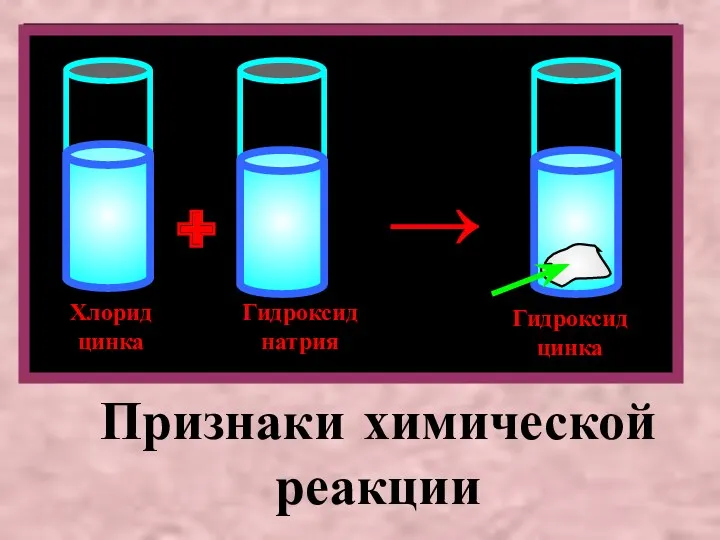
- 4. Хлорид цинка Гидроксид натрия Гидроксид цинка + → Признаки химической реакции
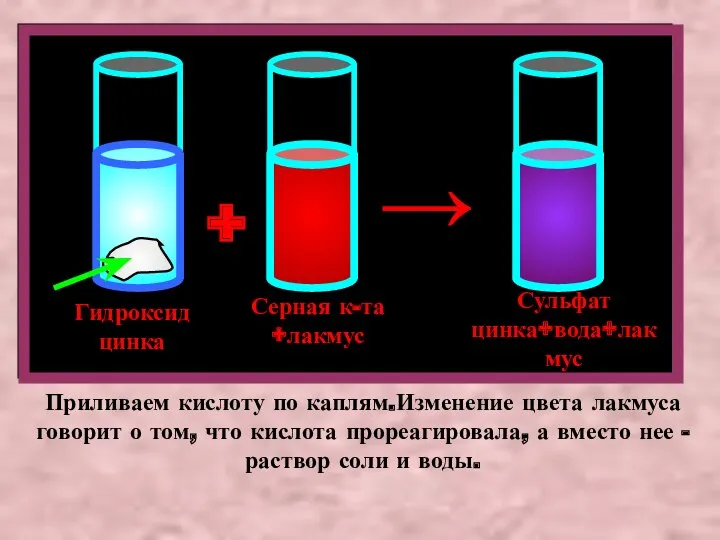
- 5. Прильем к взвеси гидроксида цинка (основанию) раствор серной кислоты.Произойдет реакция нейтрализации.Чтобы лучше наблюдать признак этой реакции,
- 6. Гидроксид цинка Серная к-та +лакмус + Сульфат цинка+вода+лакмус → Приливаем кислоту по каплям.Изменение цвета лакмуса говорит
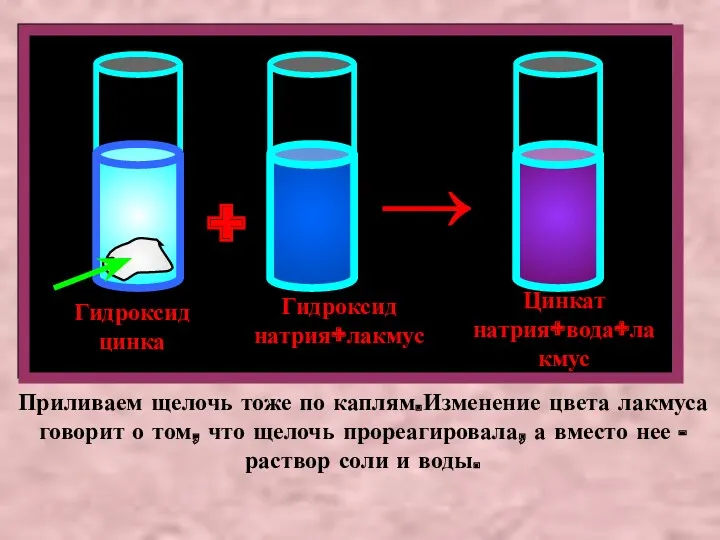
- 7. А теперь прильем к взвеси гидроксида цинка избыток раствора щелочи, также подкрашенный лакмусом. Осадок растворится, а
- 8. Гидроксид цинка Гидроксид натрия+лакмус + Цинкат натрия+вода+лакмус → Приливаем щелочь тоже по каплям.Изменение цвета лакмуса говорит
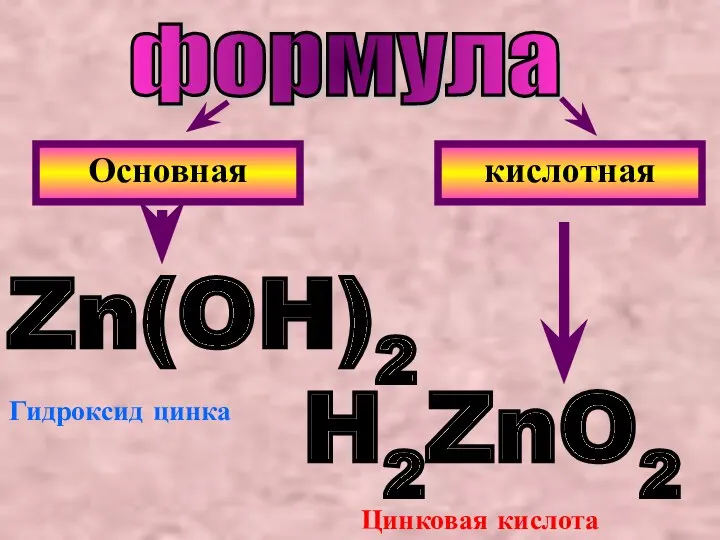
- 9. вывод: Гидроксид цинка ведет себя двояко: с кислотой- как основание, а со щелочью- как кислота. В
- 10. формула Основная кислотная Zn(OH)2 H2ZnO2 Гидроксид цинка Цинковая кислота
- 11. Амфотерные соединения образуют металлы. Те Ме, которым соответствуют амфотерные гидроксиды, называются переходными.Это металлы главных подгрупп с
- 12. Алюминий (главная подгруппа 3 группы) гидроксид Al(ОН)3 Н3AlО3(соль - алюминат) Хром (побочная подгруппа 6 группы) гидроксид
- 13. Химические свойства амфотерных оксидов С кислотами с образованием соли и воды Cr2O3 +2H3PO4 = 2CrPO4 +3H2O
- 14. Со щелочами с образованием соли и воды Cr2O3 +6NaOH = 2Na3CrO3 +3H2O Оксид хрома (III) Хромит
- 15. С кислотами с образованием соли и воды Ве(ОН)2 + 2НСl = ВеСl2 + 2Н2О Гидроксид бериллия
- 16. Со щелочами с образованием соли и воды Ве(ОН)2 + 2NaOH = Na2ВеO2 + 2Н2О Гидроксид бериллия
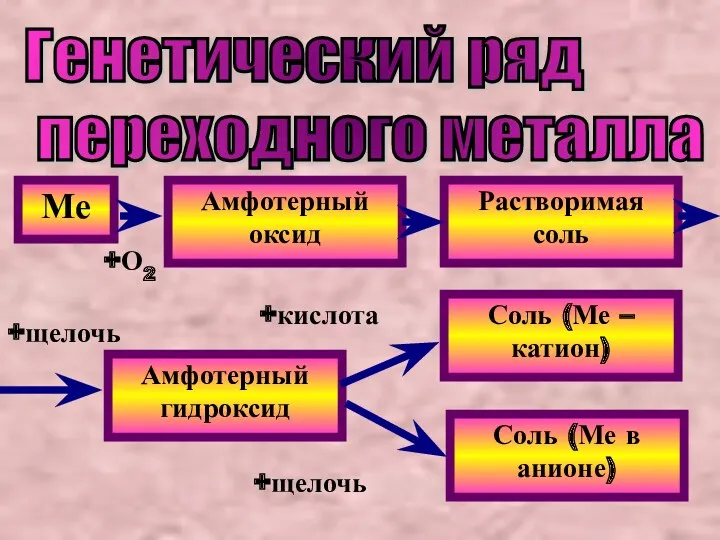
- 17. Генетический ряд переходного металла Ме Амфотерный оксид Растворимая соль Амфотерный гидроксид Соль (Ме – катион) Соль
- 18. 11 класс
- 19. Диссоциация амфотерных соединений Согласно теории С.Аррениуса , амфотерное соединение при диссоциации образует как протоны Н+, так
- 20. Н2О Н++ОН- Протолитическая теория Бренстед Согласно протолитической теории Бренстеда - Лоури, кислота – донор протона, а
- 21. Н2SO4→2H++SO42- Это доноры протонов⇒ это кислоты(серная и уксусная) СН3СOОН→H++СН3СОО- NН3+H+→[NH4]+ CH3NН2+H+→[ CH3NН3]+ Аммиак и метиламин акцепторы
- 22. Рассмотрим поведение в растворе аминоуксусной кислоты(глицина) H2N-CH2-COOH В этом веществе имеется и донор протона(карбоксильная группа), и
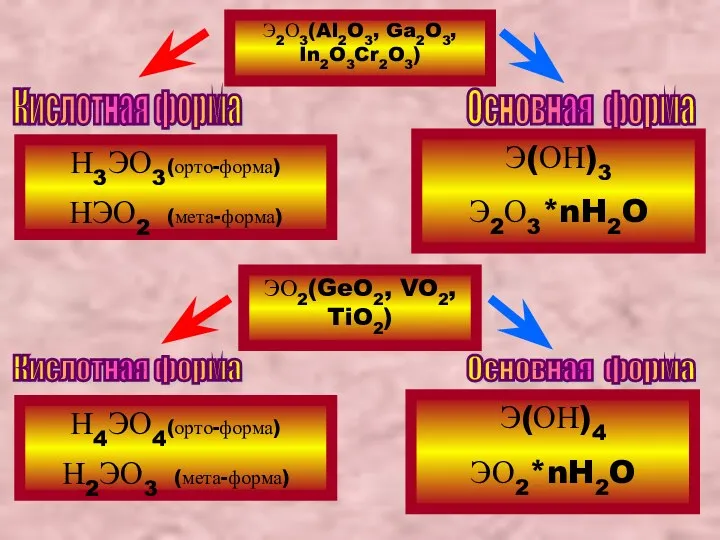
- 23. Вывод формул амфотерных гидроксидов по соответствующим оксидам Напоминаем, что многие амфотерные соединения ∈металлам побочных подгрупп с
- 24. ЭО2(GeO2, VO2, TiO2) Кислотная форма Основная форма Э2О3(Al2O3, Ga2O3, In2O3Cr2O3) Кислотная форма Основная форма Н3ЭО3(орто-форма) НЭО2
- 26. Скачать презентацию














![Н2SO4→2H++SO42- Это доноры протонов⇒ это кислоты(серная и уксусная) СН3СOОН→H++СН3СОО- NН3+H+→[NH4]+ CH3NН2+H+→[ CH3NН3]+ Аммиак](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/557888/slide-20.jpg)


 Методы и инструменты изменения и прогнозирования финансового результата
Методы и инструменты изменения и прогнозирования финансового результата Класс двудольные. Семейство бобовые
Класс двудольные. Семейство бобовые Публичная презентация профессиональному сообществу
Публичная презентация профессиональному сообществу Александр Литвиненко и его отравление полонием-210
Александр Литвиненко и его отравление полонием-210 ЕГЭ физика 2005 год
ЕГЭ физика 2005 год Сравнение, сложение и вычитание дробей с разными знаменателями. Урок-путешествие
Сравнение, сложение и вычитание дробей с разными знаменателями. Урок-путешествие Презентация к докладу
Презентация к докладу Hauberk - прайс-лист
Hauberk - прайс-лист Процесс передачи информации. 7 класс
Процесс передачи информации. 7 класс викторина сталинградская битва
викторина сталинградская битва ООО Городецкий судоремонтный завод
ООО Городецкий судоремонтный завод праздник Осени во 2 классе
праздник Осени во 2 классе Взрослость. Три стадии взрослости
Взрослость. Три стадии взрослости Предвыборная программа Студенческого совета ИУЭС ИТА ЮФУ
Предвыборная программа Студенческого совета ИУЭС ИТА ЮФУ Электроизмерительные приборы. Элементы измерительных установок
Электроизмерительные приборы. Элементы измерительных установок Зачем нужна артикуляционная гимнастика
Зачем нужна артикуляционная гимнастика Презентация Кошкин дом
Презентация Кошкин дом Семейство Мотыльковые (Бобовые)
Семейство Мотыльковые (Бобовые) Строки в языке С++
Строки в языке С++ Вежливость. Правила вежливости (для дошкольников)
Вежливость. Правила вежливости (для дошкольников) What is Engineering?
What is Engineering? Калининградская область
Калининградская область Команда Пингвины. Семья Суминых
Команда Пингвины. Семья Суминых Марина Цветаева в Башкортостане
Марина Цветаева в Башкортостане Фосфор алмасу бұзылысының морфогенезі мен патологиялық анатомиясы: рахит, нефрогенді остеопатия, ренальді нанизм
Фосфор алмасу бұзылысының морфогенезі мен патологиялық анатомиясы: рахит, нефрогенді остеопатия, ренальді нанизм Технология убоя крупного рогатого скота
Технология убоя крупного рогатого скота Презентация к уроку внеклассного чтения по теме: В.Г.Распутин Живи и помни
Презентация к уроку внеклассного чтения по теме: В.Г.Распутин Живи и помни Королевская семья в Британии
Королевская семья в Британии