Содержание
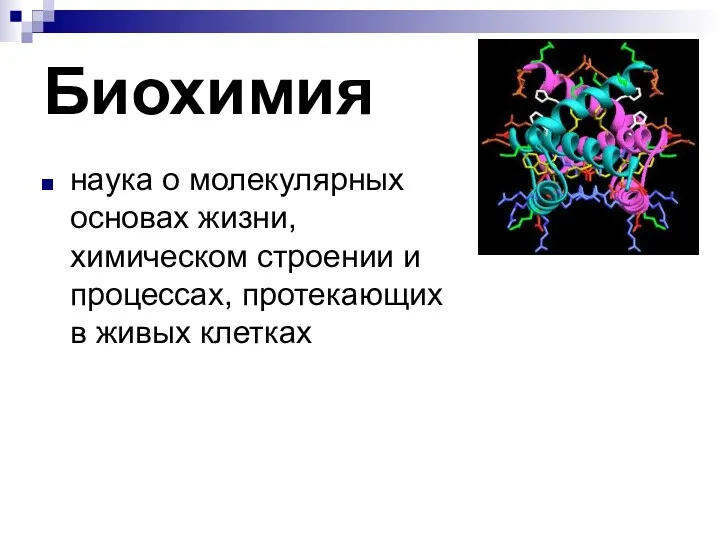
- 2. Биохимия наука о молекулярных основах жизни, химическом строении и процессах, протекающих в живых клетках
- 3. Выделяют направления: Статическая (структурная) биохимия – изучает химическую структуру живых организмов Динамическая (метаболическая) биохимия – изучает
- 4. Медицинская биохимия изучает метаболизм в норме и патологии Задачи медицинской биохимии: изучение молекулярных изменений в патогенезе
- 5. Химия белка Белки (протеины) - высокомолекулярные азотсодержащие органические соединения, состоящие из 100 и более аминокислот, соединенных
- 6. Протеомика — наука, изучающая белки и их взаимодействия (синтез, модификацию и замену) в живых организмах Protos
- 7. Функции белков Пластическая (строительная) Каталитическая (белки – ферменты) Транспортная (перенос кислорода, минеральных веществ, витаминов, гормонов, лекарственных
- 8. СТРУКТУРА БЕЛКОВ
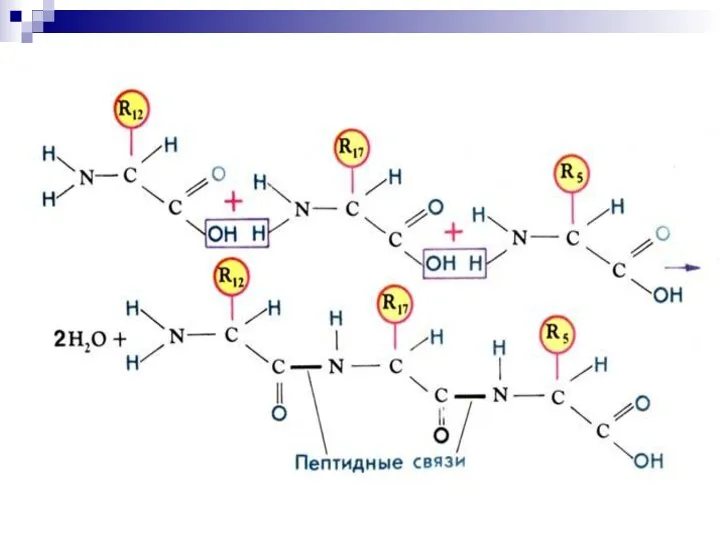
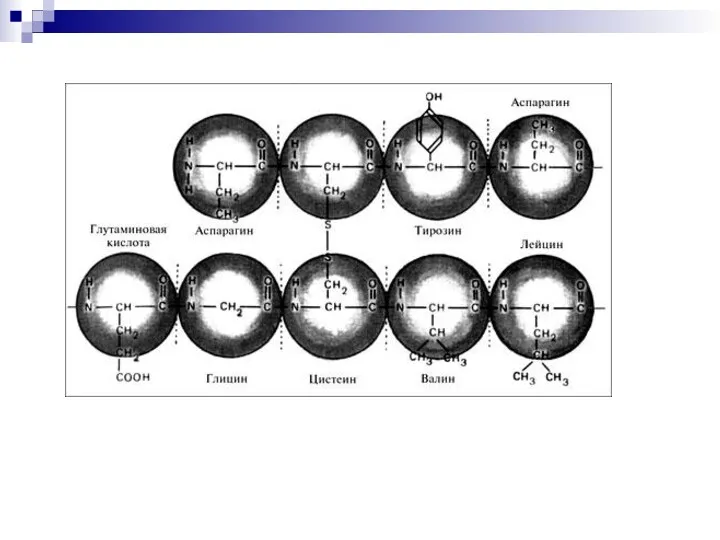
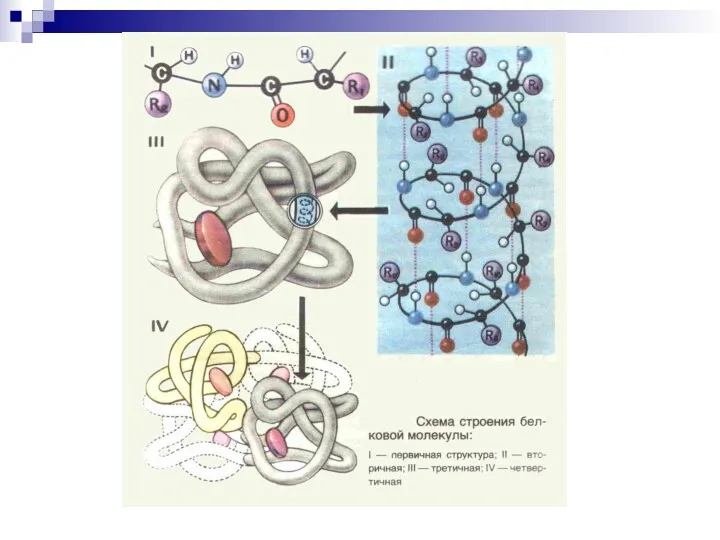
- 9. Первичная структура белка (1°) Последовательность аминокислот в полипептидной цепи белка, связанных между собой ковалентными пептидными связями
- 13. Особенности пептидной связи Связь ковалентная, устойчивая Копланарная (все 4 атома лежат в одной плоскости) Жесткая Расстояние
- 14. Особенности 1° Не во всех белках есть все 20 аминокислот Ни в одном белке аминокислоты не
- 15. Некоторые аминокислоты могут заменить друг друга в полипептидной цепи, не нарушая функцию белка Принцип структурного подобия:
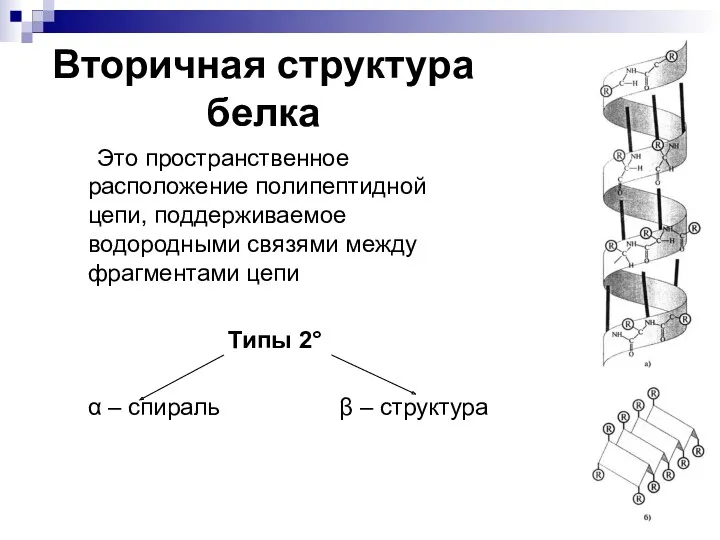
- 16. Вторичная структура белка Это пространственное расположение полипептидной цепи, поддерживаемое водородными связями между фрагментами цепи Типы 2°
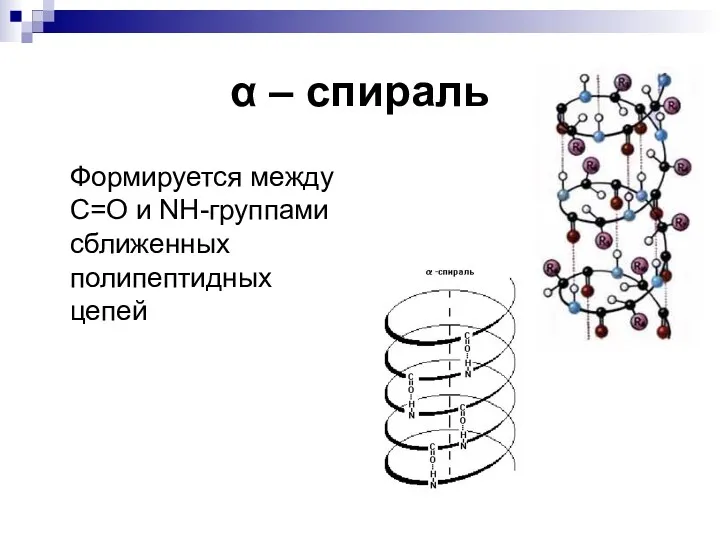
- 17. α – спираль Формируется между С=О и NH-группами сближенных полипептидных цепей
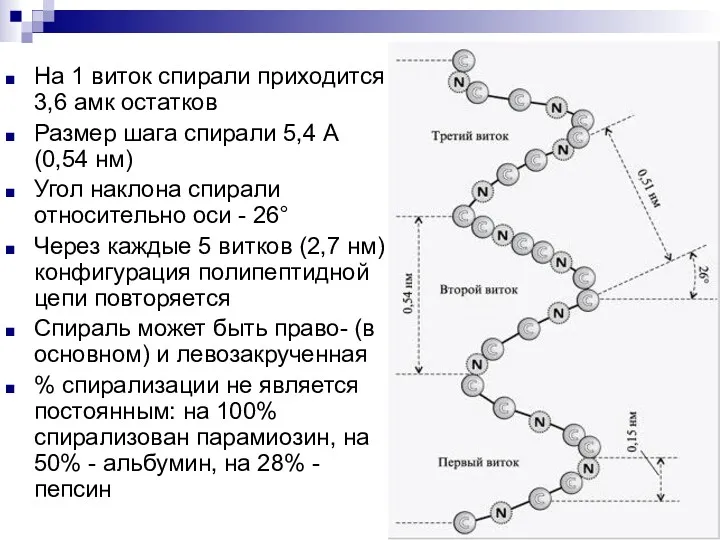
- 18. На 1 виток спирали приходится 3,6 амк остатков Размер шага спирали 5,4 А (0,54 нм) Угол
- 19. Спирализация 2° определяется способностью формировать водородные связи и характером взаимодействия радикалов аминокислот Способствуют спирализации – фен,
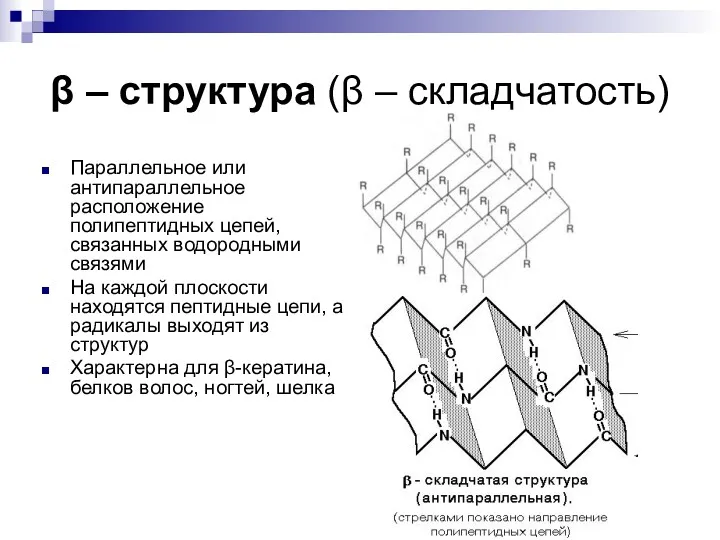
- 20. β – структура (β – складчатость) Параллельное или антипараллельное расположение полипептидных цепей, связанных водородными связями На
- 21. Коллаген Входит в состав кожи, связок, сухожилий Структурной единицей является тропоколлаген, состоящий из 3 полипептидных цепей
- 22. Супервторичная структура (надвторичная структура) Это организация полипептидной цепи, в которой последовательно чередуются α-спираль и β-структура, связанные
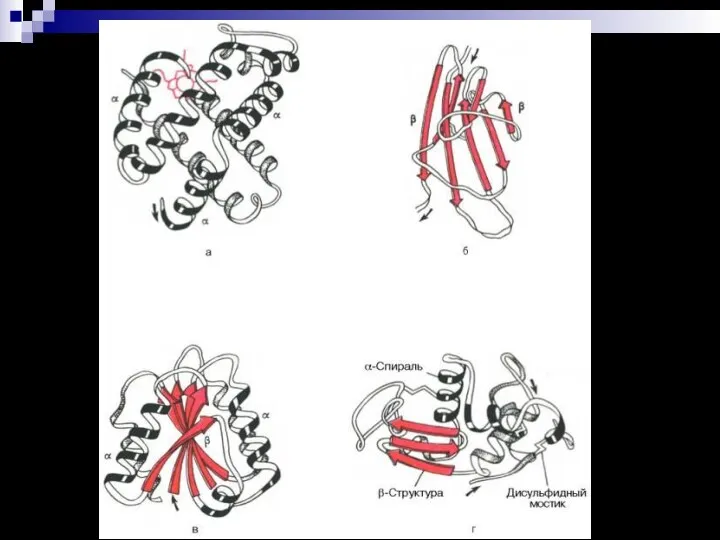
- 24. Третичная структура Пространственная конфигурация α-спирали или линейных участков в трехмерном пространстве – фолдинг Типы 3° глобулярные
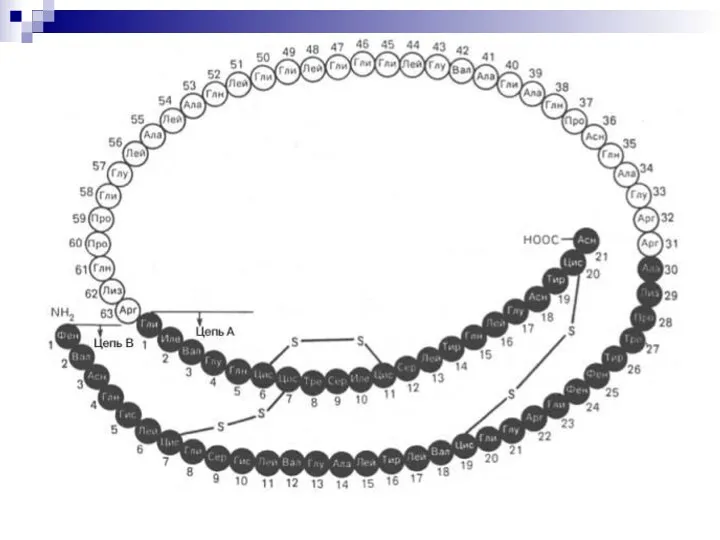
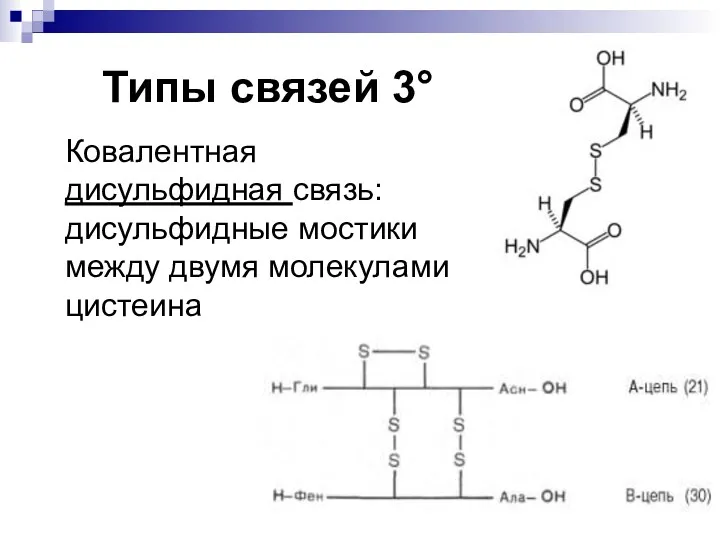
- 26. Типы связей 3° Ковалентная дисульфидная связь: дисульфидные мостики между двумя молекулами цистеина
- 27. Нековалентная ионная связь – между заряженными полярными радикалами Водородная связь – между полярными радикалами ОН-, SH-,
- 28. Значение 3° Определяет биологическую активность белка Определяет форму белковой молекулы
- 29. Фибриллярные В пространстве расположены в виде фибрилл Большинство белков не растворяются в воде 2° структура –
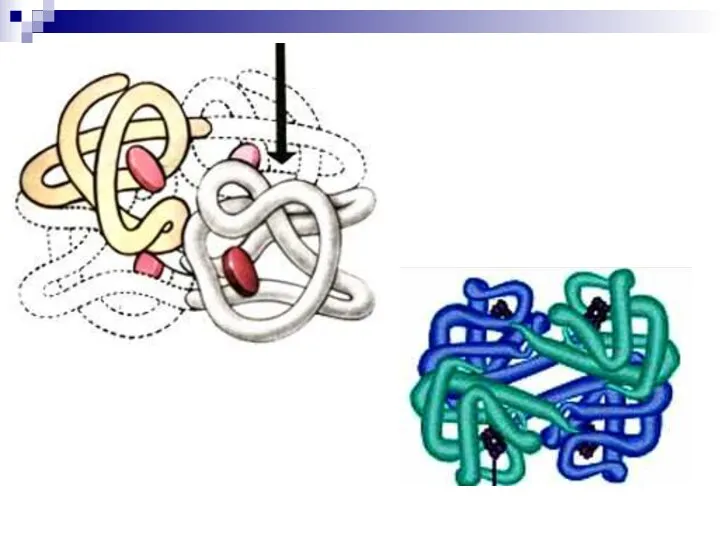
- 30. Четвертичная структура Это способ укладки в пространстве полипептидных цепей, которые обладают 1°, 2°, 3° структурой Типы
- 32. Протомер – отдельно взятая белковая полипептидная цепь в 4°, которая не обладает активностью Мультимерный белок –
- 33. Значение 4° 4° определяет биологическую активность белка Формирует регуляторный аллостерический центр ферментов Формирует изомолекулярные белки Все
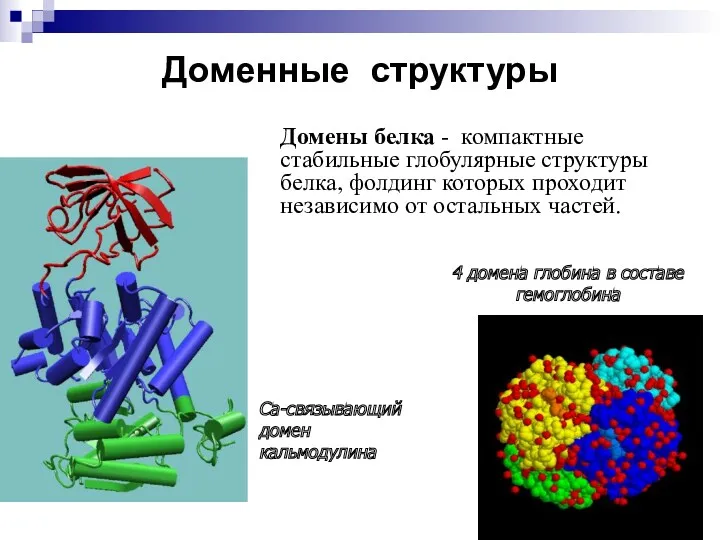
- 35. Доменные структуры Домены белка - компактные стабильные глобулярные структуры белка, фолдинг которых проходит независимо от остальных
- 36. КЛАССИФИКАЦИЯ БЕЛКОВ
- 37. Классификация белков Простые белки. Построены только из остатков аминокислот и при гидролизе распадается на аминокислоты. Альбумины
- 38. Простые белки. Построены из остатков аминокислот и при гидролизе распадаются только на свободные аминокислоты. Группы: Альбумины
- 39. Альбумины Свойства: - Глобулярные белки - Молекулярная масса 70 000 Дальтон - Растворимы в воде -
- 40. Альбумины Функция: Осморегуляторная Поддержание коллоидно-осмотического (онкотического) давления плазмы Депонирующая Источник аминокислот Транспортная переносчики многих транспортируемых кровью
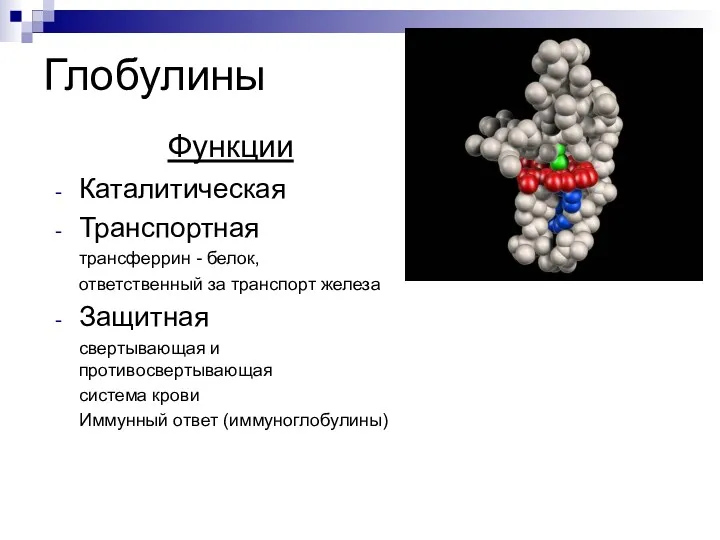
- 41. Глобулины Свойства: Глобулярные белки Молекулярная масса 150 000 Дальтон Растворимы в солевых растворах ИЭТ=7 Высаливаются 50%раствором
- 42. Глобулины Функции Каталитическая Транспортная трансферрин - белок, ответственный за транспорт железа Защитная свертывающая и противосвертывающая система
- 43. Гистоны Свойства Связаны с ДНК («упаковка» ДНК, регуляция генной активности) Молекулярная масса 11 000 - 22
- 44. Протамины Свойства Молекулярная масса 10 000 – 12 000 Дальтон ИЭТ=11 Содержит от 60% до 85%
- 45. Протеиноиды Свойства Фибриллярные белки: коллаген, эластин, кератин. Содержится в коже, костях, роговице и т.д. Молекулярная масса
- 46. Сложные белки Двухкомпонентные соединения, состоят из простого белка и небелкового вещества (простетической группы, prostheto – присоединяю,
- 47. Нуклеопротеины Свойства Состоит из белка и нуклеиновых кислот(количество НК колеблется от 40 до 65%) 2 типа:
- 48. Хромопротеины Состоят из простого белка и связанного с ним окрашенного небелкового компонента Участвуют в дыхании, транспорте
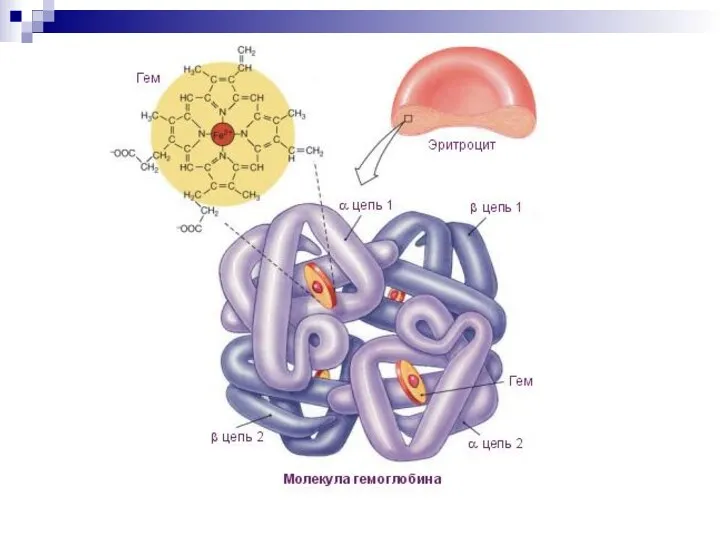
- 49. Хромопротеины Гемоглобин, миоглобин – содержат гем (красный цвет) Ферменты (цитохромная система, каталаза, пероксидаза) - содержат негемовое
- 50. Гемопротеины Гем - соединение порфирина с железом Гемоглобин - глобулярный железосодержащий белок Содержит 574 АК Молекулярная
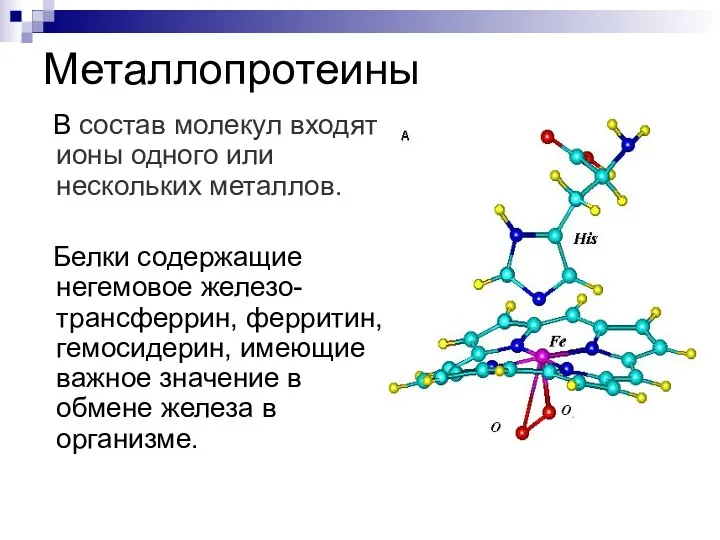
- 52. Металлопротеины В состав молекул входят ионы одного или нескольких металлов. Белки содержащие негемовое железо-трансферрин, ферритин, гемосидерин,
- 53. Гликопротеины Простетические группы представлены углеводами и их производными, прочно связанные с белковой частью молекулы. Гликопротеины (белки,
- 54. Гликопротеины большинство белковых гормонов структурный компонент клеточных мембран рецепторные белки гликопротеины мембран эритроцитов определяют группу крови
- 55. Липопротеины Свойства состоят из белка и липида (триацилглицерин, фосфолипиды, холестерин, эфиры холестерина). Связь ионная, прочная, не
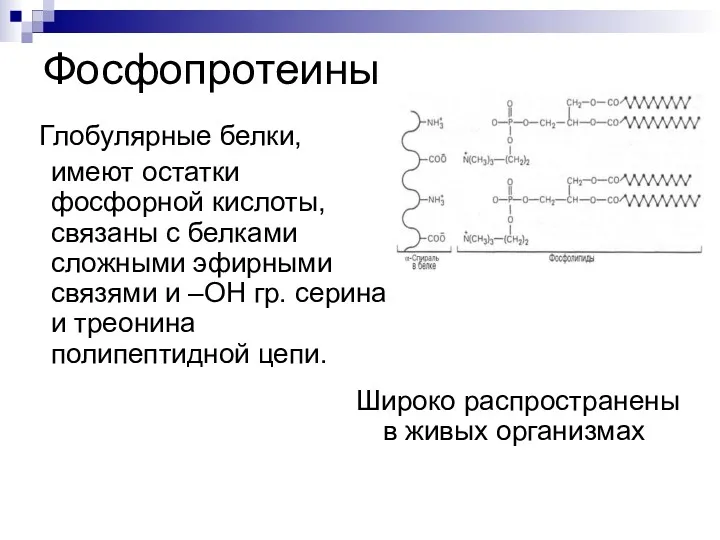
- 56. Фосфопротеины Глобулярные белки, имеют остатки фосфорной кислоты, связаны с белками сложными эфирными связями и –ОН гр.
- 57. Фосфопротеины Функции: Содержатся в нервной ткани участвуют в регуляции активности ядра, окислительных процессах в митохондриях, транспорте
- 58. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ
- 59. Физико-химические свойства белков Набухание Высокая вязкость Желатинирование Оптическая активность Подвижность в электрическом поле Низкое осмотическое давление
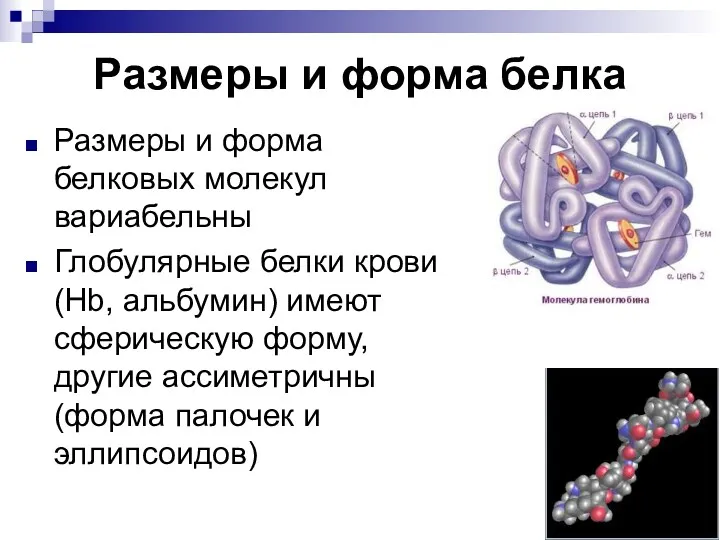
- 60. Размеры и форма белка Размеры и форма белковых молекул вариабельны Глобулярные белки крови (Нb, альбумин) имеют
- 61. Растворимость белков Белки – гидрофильные соединения, растворимы в воде и водно-солевых растворах Из-за больших размеров белки
- 62. Гидрофильность белкам придают Полярные гидрофильные радикалы аминокислот ориентируют вокруг себя диполи воды Полярные связи: – СО
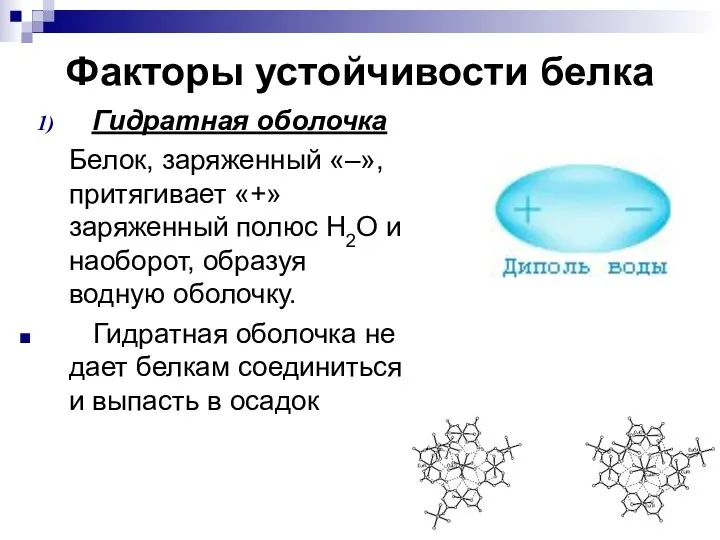
- 63. Факторы устойчивости белка Гидратная оболочка Белок, заряженный «–», притягивает «+» заряженный полюс Н2О и наоборот, образуя
- 65. Величина гидратной оболочки зависит от структуры белка: Альбумины легко связываются с молекулами воды и имеют относительно
- 66. Заряд белковой молекулы Поверхность белков заряжена, т.к. в белке есть свободные заряженные СОО– и NH3 группы
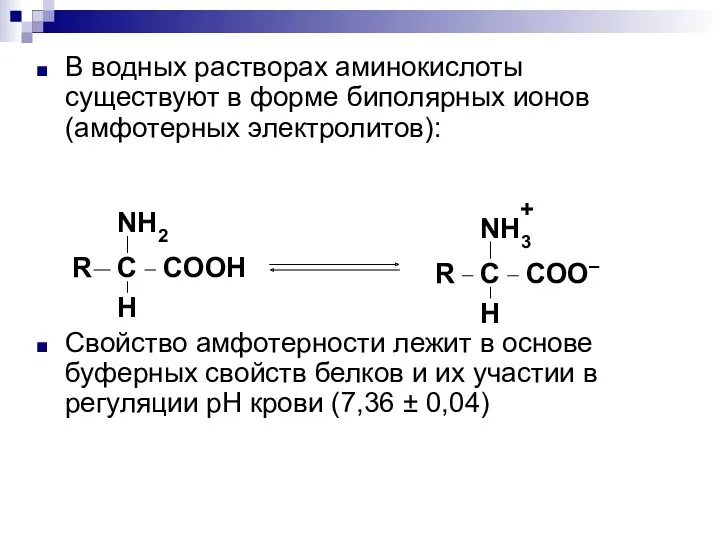
- 67. В водных растворах аминокислоты существуют в форме биполярных ионов (амфотерных электролитов): Свойство амфотерности лежит в основе
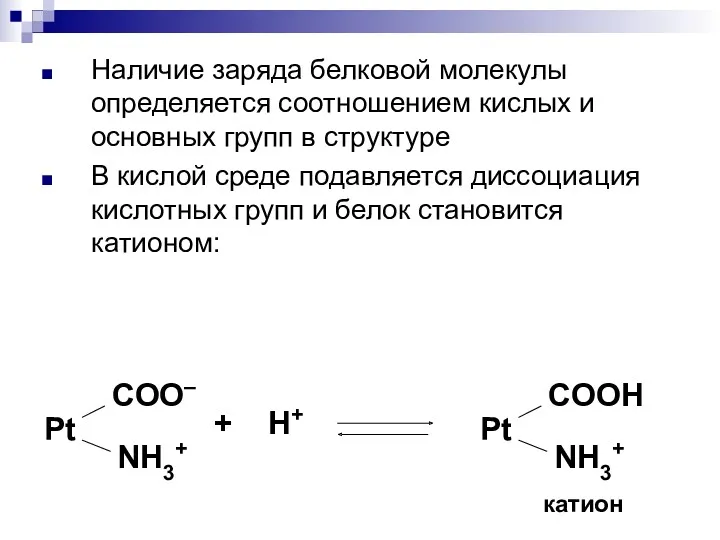
- 68. Наличие заряда белковой молекулы определяется соотношением кислых и основных групп в структуре В кислой среде подавляется
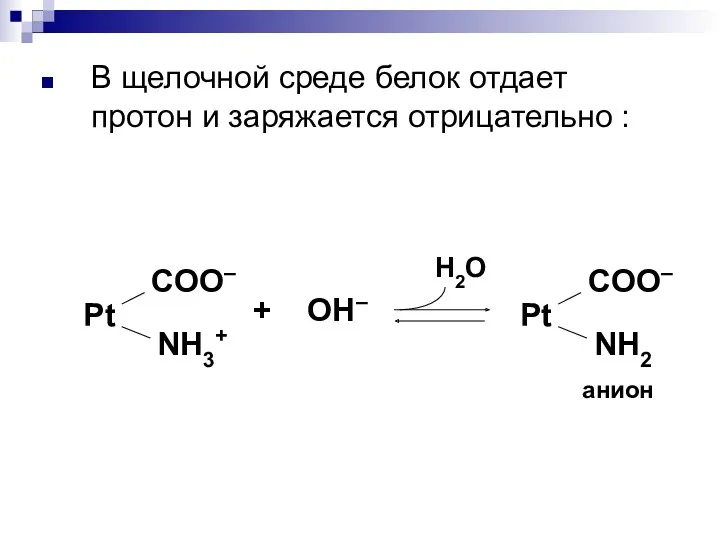
- 69. В щелочной среде белок отдает протон и заряжается отрицательно : Pt COO– NH3+ + ОH– Pt
- 70. Таким образом, фактором, определяющим поведение белка как катиона или аниона, является реакция среды, которая определяется концентрацией
- 71. Изоэлектрическая точка (ИЭТ) Это значение рН раствора, при котором заряд белка равен нулю (белок электронейтрален) ИЭТ
- 72. Свойства белков в изоэлектрической точке Не растворяются в воде Высокая степень коагуляции и седиментации Не набухают
- 73. Конформация белка Это пространственное расположение атомов в молекуле белка Конформация белка формируется при участии слабых типов
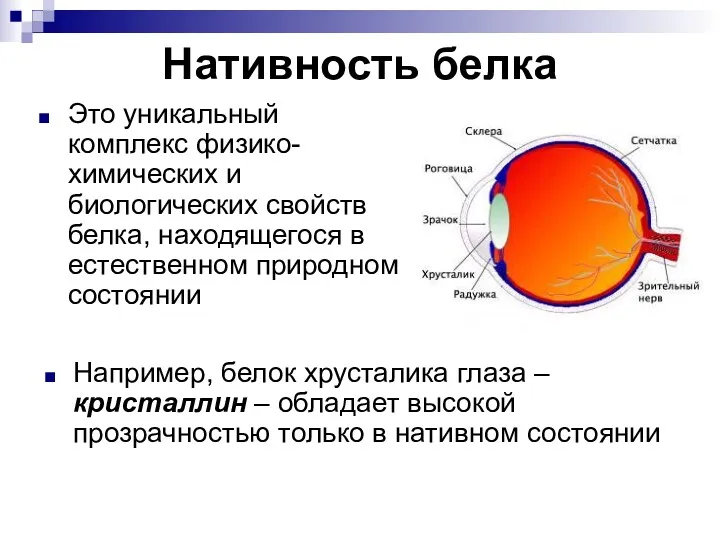
- 74. Нативность белка Это уникальный комплекс физико-химических и биологических свойств белка, находящегося в естественном природном состоянии Например,
- 75. Высаливание Это обратимое осаждение белков солями щелочных и щелочноземельных металлов (сульфат натрия и аммония) Соли удаляют
- 76. Денатурация белка Это лишение белка его природных нативных свойств, сопровождающееся разрушением 4°, 3°, 2° структур, которое
- 77. Факторы, вызывающие денатурацию белка Физические – температура, УФО, рентгеновское и радиоактивное облучение, ультразвук, механическое воздействие Химические
- 78. Ренатурация белка Чаще всего денатурация – процесс необратимый Денатурированный белок в нативных условиях может медленно ренатурировать,
- 79. Такие белки называются «белки теплового шока» или «белки стресса» или ШАПИРОНЫ М.М. от 10 до 90
- 81. Скачать презентацию






















































 Особенности календарного праздника Егорьев день
Особенности календарного праздника Егорьев день Державні замовлення та сучасні контрактні системи
Державні замовлення та сучасні контрактні системи Дидактическая игра как метод и форма обучения
Дидактическая игра как метод и форма обучения Презентация рабочей программы кружка по конструированию Путешествие Роботенка
Презентация рабочей программы кружка по конструированию Путешествие Роботенка Презентация Вода - источник жизни
Презентация Вода - источник жизни Структура трехуровневой распределенной АСУ ТП
Структура трехуровневой распределенной АСУ ТП Конституция Германской империи 1871 года
Конституция Германской империи 1871 года Портфолио преподавателя
Портфолио преподавателя Программа мониторинга уровня сформированности УУД в начальной школе
Программа мониторинга уровня сформированности УУД в начальной школе презентация Игровая деятельность в ДОУ
презентация Игровая деятельность в ДОУ Виды капитального ремонта
Виды капитального ремонта Способы быстрого умножения. 5 класс
Способы быстрого умножения. 5 класс Мини-проект как одна из форм деятельности на уроке информатики. 5 класс
Мини-проект как одна из форм деятельности на уроке информатики. 5 класс cdb57-660f1006
cdb57-660f1006 Презентация по географии 6 класс Волны и их виды
Презентация по географии 6 класс Волны и их виды Радиолокационная система РТВ
Радиолокационная система РТВ Пунктуация в предложениях с однородными членами
Пунктуация в предложениях с однородными членами Кроссворд по правилам дорожного движения (с использованием клавиатуры)
Кроссворд по правилам дорожного движения (с использованием клавиатуры) Гомогенизация молочного сырья. Механическая обработка молочного сырья
Гомогенизация молочного сырья. Механическая обработка молочного сырья Система оповещения населения о чрезвычайных ситуациях
Система оповещения населения о чрезвычайных ситуациях Биологическое действие излучения
Биологическое действие излучения prezentatsiya-poklon-zemle-surovoj-i-prekrasnoj
prezentatsiya-poklon-zemle-surovoj-i-prekrasnoj Искусственный интеллект
Искусственный интеллект Театр будущего и будущее театра
Театр будущего и будущее театра Творчество Т.Г. Шевченко
Творчество Т.Г. Шевченко Зачем мы изучаем логарифмы
Зачем мы изучаем логарифмы Презентация к Уроку - 75 л. образования Краснодарского края
Презентация к Уроку - 75 л. образования Краснодарского края Татарские народные костюмы!!!
Татарские народные костюмы!!!