Содержание
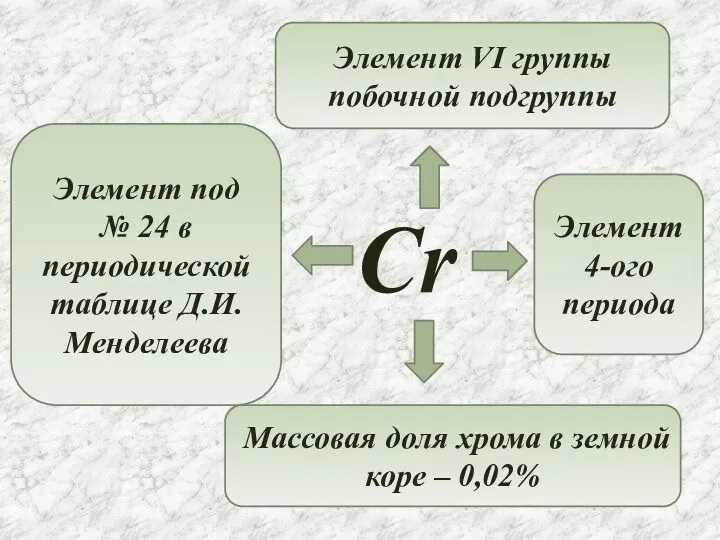
- 2. Cr Элемент под № 24 в периодической таблице Д.И.Менделеева Элемент VI группы побочной подгруппы Элемент 4-ого
- 3. Нахождение в природе Хромистый железняк FeO* Cr2O3 Хромит FeCr2O4 Крокоит PbCrO4
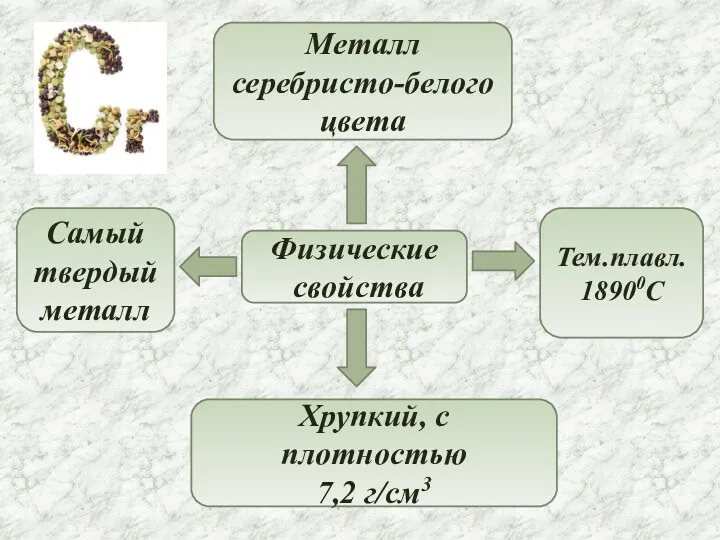
- 4. Физические свойства Металл серебристо-белого цвета Самый твердый металл Хрупкий, с плотностью 7,2 г/см3 Тем.плавл. 18900C
- 5. Химические свойства хрома 1.Реагирует с неметаллами(при нагревании) А)4Cr + 3O2 =2Cr2O3 Б)2Cr + N2 =2CrN В)2Cr
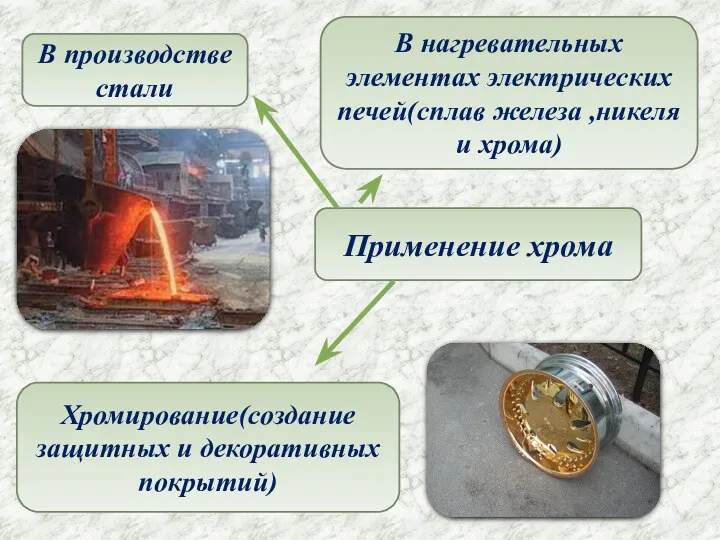
- 6. Применение хрома В производстве стали В нагревательных элементах электрических печей(сплав железа ,никеля и хрома) Хромирование(создание защитных
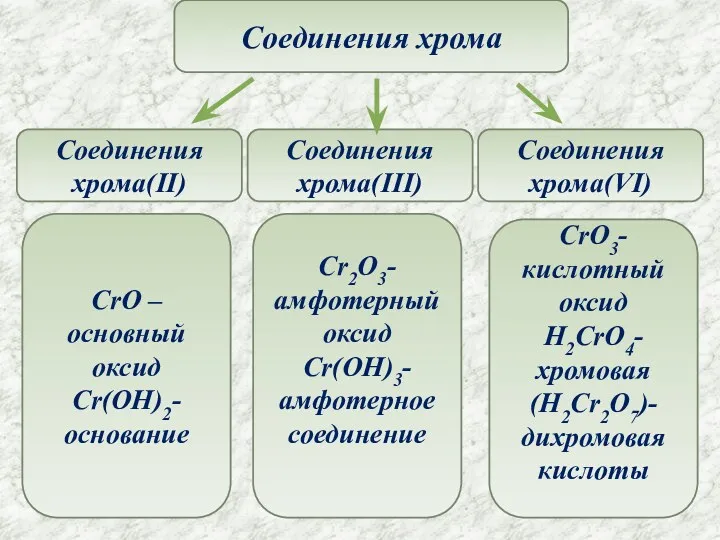
- 7. Соединения хрома Соединения хрома(II) Соединения хрома(III) Соединения хрома(VI) CrO –основный оксид Cr(OH)2- основание CrO3-кислотный оксид H2CrO4-хромовая
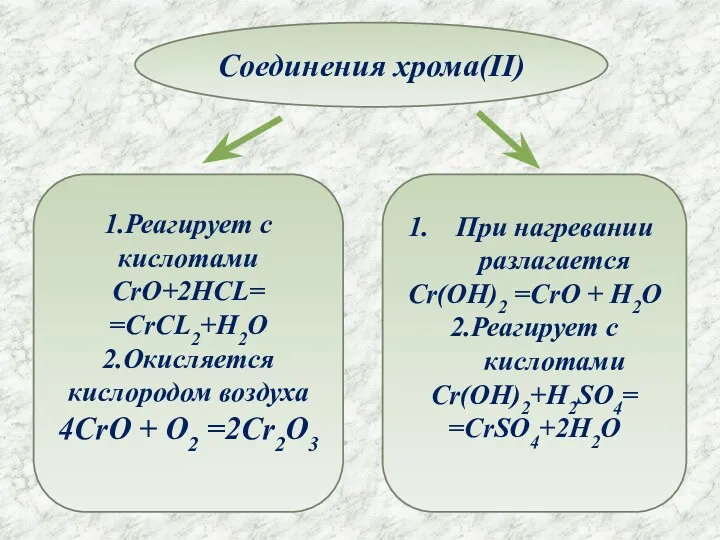
- 8. Соединения хрома(II) 1.Реагирует с кислотами CrO+2HCL= =CrCL2+H2O 2.Окисляется кислородом воздуха 4CrO + O2 =2Cr2O3 При нагревании
- 9. Соединения хрома(III) Cr2O3 –при обычных условиях не реагирует с растворами кислот и щелочей . Cr2O3 –реагирует
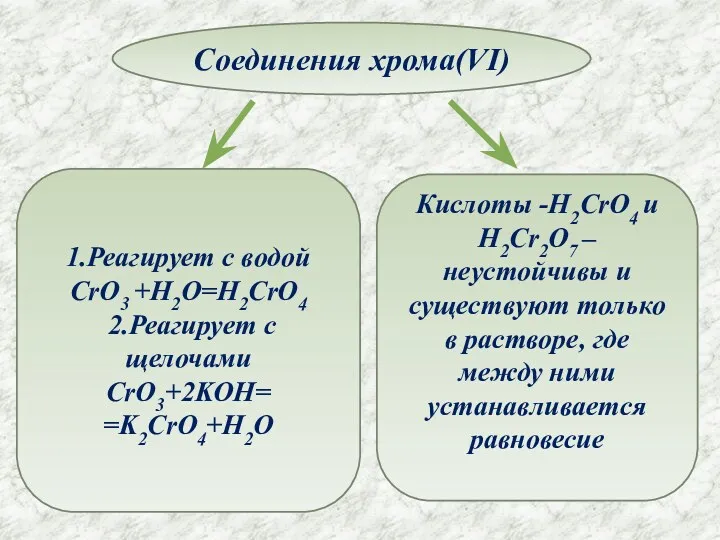
- 10. Соединения хрома(VI) 1.Реагирует с водой CrO3 +H2O=H2CrO4 2.Реагирует с щелочами CrO3+2KOH= =K2CrO4+H2O Кислоты -H2CrO4 и H2Cr2O7
- 12. Скачать презентацию



 Оборудование используемое для искривления ствола скважин
Оборудование используемое для искривления ствола скважин Печатные формы высокой печати
Печатные формы высокой печати Эффективные маркетинговые коммуникации в менеджменте
Эффективные маркетинговые коммуникации в менеджменте Кодирование звука. Временная дискретизация
Кодирование звука. Временная дискретизация Методическая разработка
Методическая разработка Безопасное поведение детей в сети
Безопасное поведение детей в сети Подготовка поверхности под улучшенную окраску. Сплошное шпатлевание поверхности под улучшенную окраску
Подготовка поверхности под улучшенную окраску. Сплошное шпатлевание поверхности под улучшенную окраску Викторина по деятельности К.Д. Ушинского
Викторина по деятельности К.Д. Ушинского Сказочный зверинец в Санкт-Петербурге (Конные памятники)
Сказочный зверинец в Санкт-Петербурге (Конные памятники) Духовно-нравственное воспитание
Духовно-нравственное воспитание Філософія Стародавніх Китаю та Індії. Лекція 2
Філософія Стародавніх Китаю та Індії. Лекція 2 Erntedankfest. День благодарения
Erntedankfest. День благодарения ОГЭ тренажер
ОГЭ тренажер Государственные должности и должности государственной службы
Государственные должности и должности государственной службы Благодарность, смысл жизни. Сочинение на ОГЭ-2017. (Задание 15.3)
Благодарность, смысл жизни. Сочинение на ОГЭ-2017. (Задание 15.3) 60 лет Белгородской области
60 лет Белгородской области Сравнение, сложение и вычитание дробей с разными знаменателями
Сравнение, сложение и вычитание дробей с разными знаменателями Синдром Вильсона - Коновалова
Синдром Вильсона - Коновалова Места обитания животных
Места обитания животных Вариативные программы обучения
Вариативные программы обучения Падение Рима
Падение Рима Ткань. Виды ткани.
Ткань. Виды ткани. Правила технической эксплуатации, инструкция по сигнализации железных дорог РФ
Правила технической эксплуатации, инструкция по сигнализации железных дорог РФ Развивающие образовательные технологии и системно-деятельностный подход в обучении школьников на уроках иностранного языка
Развивающие образовательные технологии и системно-деятельностный подход в обучении школьников на уроках иностранного языка Олимпийские игры Сочи 2014
Олимпийские игры Сочи 2014 Понятие системы права. Отрасли права. Публичное и частное право
Понятие системы права. Отрасли права. Публичное и частное право Зеленая дорога детства
Зеленая дорога детства Семейное хобби
Семейное хобби