Содержание
- 2. ЦЕЛИ УРОКА 1.Повторить основные понятия теории электролитической диссоциации и проверить их усвоение. 2.Изучить условия протекания реакций
- 3. СОДЕРЖАНИЕ: 1.Историческая справка 2. «Проверь себя»(теоретическая и письменная часть) 3. Изучение нового материала 4. Выполнение заданий
- 4. Историческая справка. Сванте Август Аррениус (1859-1927г.) Шведский физик и химик, академик Королевской академии наук. В1887году сформулировал
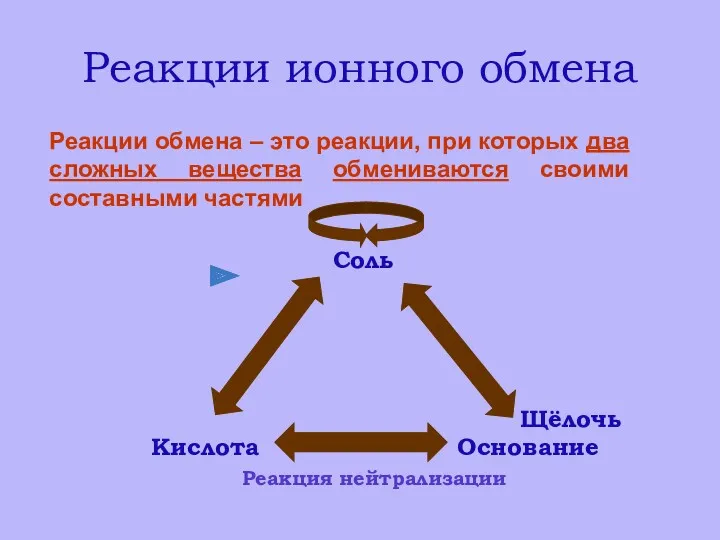
- 6. Реакции ионного обмена Реакции обмена – это реакции, при которых два сложных вещества обмениваются своими составными
- 7. РЕАКЦИИ ИОННОГО ОБМЕНА. Реакции между ионами называют ионными реакциями, а уравнения – ионными уравнениями. Ионные реакции
- 8. Алгоритм составления ионных уравнений. 3. Исключите из обеих частей уравнения одинаковые ионы и запишите оставшиеся в
- 9. Задание: Составьте молекулярные и ионные уравнения двух других реакций пользуясь алгоритмом. CuSO4+2NaOH=Cu(OH)2 +Na2SO4 Cu2++SO42-+2Na++2OH-=Cu(OH)2 +2Na++ SO42-
- 10. Решение задач. Задача№1. Составте молекулярные и ионные уравнения взаимодействия хлорида железа(III) с гидроксидом калия, нитратом серебра.
- 11. Задача№2. Составьте молекулярные и полные ионные уравнения соответствующие сокращенным ионным уравнениям. а). Mg2++2OH-=Mg(OH)2 Mg2++2NO3-+2Na++2OH-=Mg(OH)2 +2Na++2NO3- Mg(NO3)2+2NaOH=Mg(OH)2
- 13. Скачать презентацию









 Занятие по экологии Амурский тигр - хозяин Дальневосточной тайги
Занятие по экологии Амурский тигр - хозяин Дальневосточной тайги Система питания двигателя от газобаллонной установки
Система питания двигателя от газобаллонной установки Необычные животные
Необычные животные Игра Умницы и умники
Игра Умницы и умники Мажор, минор
Мажор, минор Особенности копинг-стратегий подростков, входящих в группу суицидального риска
Особенности копинг-стратегий подростков, входящих в группу суицидального риска Презентация Технология развивающих игр
Презентация Технология развивающих игр Презентация Хозяйство мира
Презентация Хозяйство мира презентация История робототехники
презентация История робототехники Микроконтроллеры. Платформа Arduino UNO
Микроконтроллеры. Платформа Arduino UNO Нейропсихологические основы современных методов коррекции речевых расстройств (Полуэктова Е. Н. - учитель-логопед)
Нейропсихологические основы современных методов коррекции речевых расстройств (Полуэктова Е. Н. - учитель-логопед) Оборудование процессов ректификации
Оборудование процессов ректификации Познавательно – игровая программа: Благодарное слово.
Познавательно – игровая программа: Благодарное слово. Задачи по управленческому учету
Задачи по управленческому учету Портативна координатно-вимірювальна машина
Портативна координатно-вимірювальна машина Куликовская битва
Куликовская битва Проект про маму
Проект про маму Тест Твое здоровье
Тест Твое здоровье Проект:Эх, да Масленица
Проект:Эх, да Масленица Система сбора и подготовки нефти
Система сбора и подготовки нефти Рисуем Космос
Рисуем Космос Материалы для родителей
Материалы для родителей Протокол HTTP
Протокол HTTP XXI Всероссийская олимпиада школьников по информатике
XXI Всероссийская олимпиада школьников по информатике Выставка Зимняя сказка
Выставка Зимняя сказка Мифы о космонавтике
Мифы о космонавтике Вода- источник жизни на земле (презентация)
Вода- источник жизни на земле (презентация) Общественно-транспортные комплексы
Общественно-транспортные комплексы