Как выполнить задание вида Составить уравнения возможных реакций (на примере темы Химические свойства оснований) презентация
Содержание
- 2. Уважаемые восьмиклассники! Предлагаемая презентация поможет вам закрепить умения выполнять задания вида «Составить уравнения возможных реакций» на
- 3. Пример 1 (обучающий) Задание: составьте уравнение возможной реакции Решение: соль (Взаимодействие возможно, так как щелочи реагируют
- 4. Пример 2 (тренировочный) Задание: составьте уравнение возможной реакции Если вы забыли свойства щелочей КOН + СO2
- 5. Пример 3 (обучающий) Задание: составьте уравнения возможных реакций Решение: Следующий пример = → + Н2О →
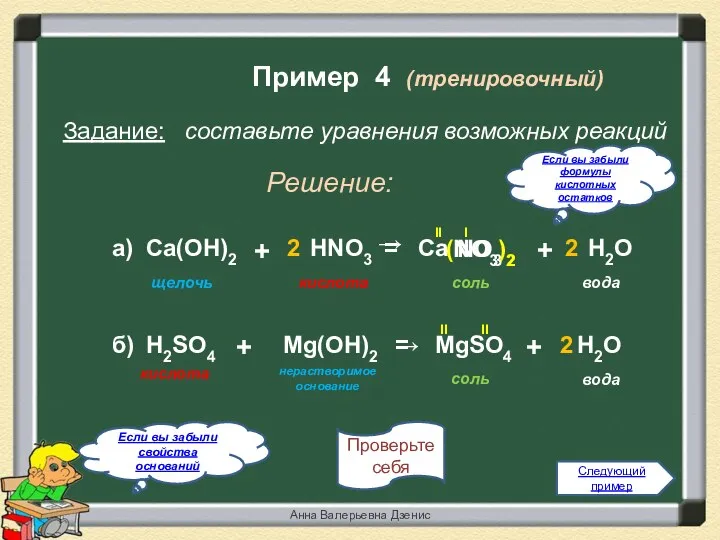
- 6. + Пример 4 (тренировочный) Задание: составьте уравнения возможных реакций Решение: Если вы забыли свойства оснований Проверьте
- 7. Пример 5 (тренировочный) Задание: составьте уравнения возможных реакций Решение: Если вы забыли свойства щелочей Следующий пример
- 8. Пример 6 Задание: составить уравнение возможной реакции Решение: Проверьте себя Следующий пример Н2О + Выполните самостоятельно
- 9. Пример 7 (обучающий) Задание: составить уравнение возможной реакции Решение: Если вы забыли свойства щелочей Следующий пример
- 10. Пример 8 (тренировочный) Задание: составить уравнения возможных реакции Решение: Если вы забыли свойства оснований Проверьте себя
- 11. Пример 9 (обучающий) + Задание: составить уравнение возможной реакции → Решение: Так как в данном случае
- 12. б) а) Пример 10 (тренировочный) Задание: составить уравнения возможных реакций Если вы забыли свойства щелочей Решение:
- 13. Примеры для самопроверки Проверьте себя Задание: составить уравнения возможных реакций е) KOH + СаO → а)
- 14. Проверьте себя щелочь щелочь р-р соли новая соль вода кислота продолжение соль новая соль новое основание
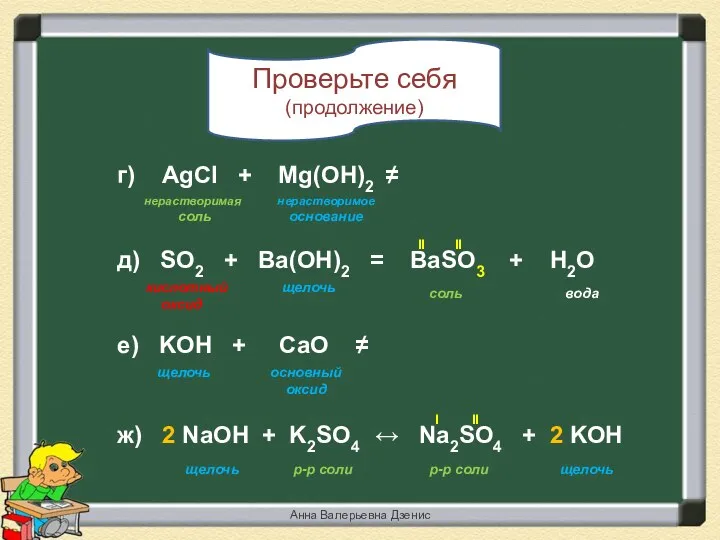
- 15. Проверьте себя (продолжение) кислотный оксид соль основный оксид вода е) KOH + СаO ≠ г) AgCl
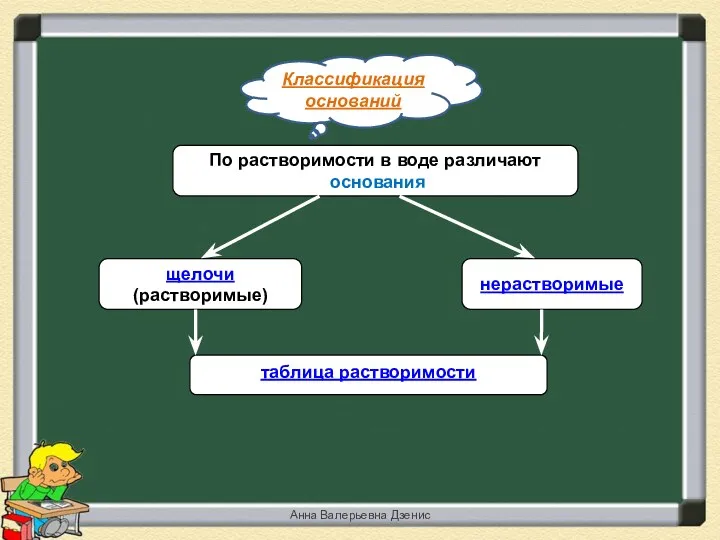
- 16. Классификация оснований По растворимости в воде различают основания щелочи (растворимые) нерастворимые таблица растворимости Анна Валерьевна Дзенис
- 17. Вернуться к классификации оснований Вернуться к примеру 7 Вернуться к примеру 8 Вернуться к самопроверке Вернуться
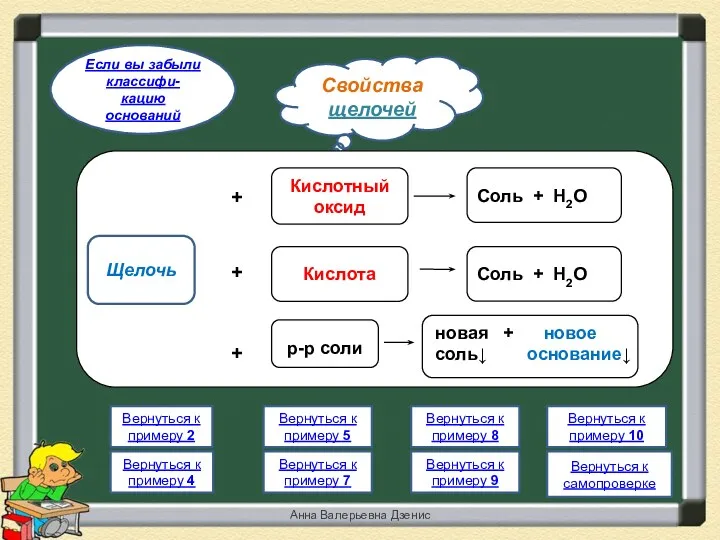
- 18. Свойства щелочей Если вы забыли классифи- кацию оснований Вернуться к примеру 4 Вернуться к примеру 2
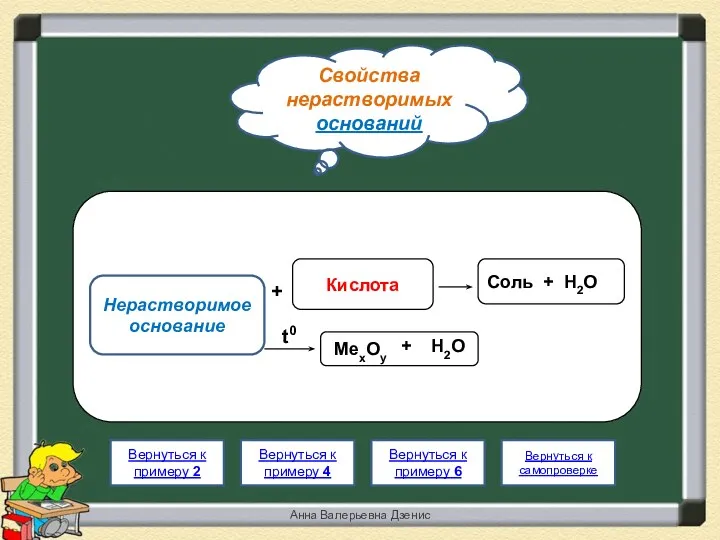
- 19. Свойства нерастворимых оснований Анна Валерьевна Дзенис Вернуться к примеру 4 Вернуться к примеру 6 Вернуться к
- 20. Вернуться к примеру 3 Вернуться к самопроверке Вернуться к примеру 1 Вернуться к примеру 2 Вернуться
- 21. Молодец! Анна Валерьевна Дзенис
- 23. Скачать презентацию















 Осложнения язвенной болезни
Осложнения язвенной болезни 8кл-РМ № 12. Ділові папери. План роботи
8кл-РМ № 12. Ділові папери. План роботи Сергей Анатольевич Иванов Снежный заповедник
Сергей Анатольевич Иванов Снежный заповедник С днем рождения, любимый
С днем рождения, любимый Мастер-класс для родителей Использование нетрадиционных пальчиковых игр для формирования речевых навыков у детей дошкольного возраста
Мастер-класс для родителей Использование нетрадиционных пальчиковых игр для формирования речевых навыков у детей дошкольного возраста Дөнья могҗизалары презентациясе Диск
Дөнья могҗизалары презентациясе Диск Классный час Год Российской культуры
Классный час Год Российской культуры Самоэффективность поведения
Самоэффективность поведения Робот пылесос VR5901LVM
Робот пылесос VR5901LVM Интернет браузеры и приложения
Интернет браузеры и приложения Каналы сбыта и спрос. Затраты по каналам сбыта. Управление сбытовой конкуренцией
Каналы сбыта и спрос. Затраты по каналам сбыта. Управление сбытовой конкуренцией Япония в период мирового экономического кризиса и развязывания войны на Дальнем Востоке (1929—1937 годы)
Япония в период мирового экономического кризиса и развязывания войны на Дальнем Востоке (1929—1937 годы) Смысловые частицы
Смысловые частицы Последовательность рисования для детей 5-7 лет
Последовательность рисования для детей 5-7 лет Amazing mountains and laces
Amazing mountains and laces Гжель
Гжель Презентация Оздоровительная работа
Презентация Оздоровительная работа Скоро в школу.
Скоро в школу. DH_CAMPUS_pptx
DH_CAMPUS_pptx Türkçe 4
Türkçe 4 Презентация к уроку Фелтинг Валяние из шерсти
Презентация к уроку Фелтинг Валяние из шерсти Культура Китая
Культура Китая Дорогами войны. Экскурсия по военно-историческим местам г. Сызрань
Дорогами войны. Экскурсия по военно-историческим местам г. Сызрань Организация технологического приготовления блюд
Организация технологического приготовления блюд Разработка хлебобулочных изделий из ржано-пшеничной муки повышенной биологической ценности
Разработка хлебобулочных изделий из ржано-пшеничной муки повышенной биологической ценности What season do you like best of all?
What season do you like best of all? Кембридж университеті
Кембридж университеті Патриотическое воспитание как одна из задач воспитания подрастающего поколения
Патриотическое воспитание как одна из задач воспитания подрастающего поколения