Содержание
- 2. уксус Карбоновые кислоты
- 3. Цели: Продолжить знакомство с кислородсодержащими соединениями на примере карбоновых кислот. Изучить классификацию, номенклатуру, строение, физические свойства
- 4. Открытие кислот: Благодаря работам известного шведского химика Карла Вильгельма Шееле к концу 18 века стало известно
- 5. Интересные исторические факты, связанные с органическими кислотами: В 1714 г. по указу Петра I в Петербурге
- 6. Интересные исторические факты и карбоновые кислоты: Правильно! Это крапива, содержащая муравьиную кислоту!
- 7. Карбоновые кислоты в природе: Есть ли кислоты опасные для здоровья человека? Да, например: HOOC-COOH Щавелевая кислота.
- 8. Муравьиная кислота НСООН Карбоновые кислоты в природе:
- 9. Уксусная кислота СН3СООН Карбоновые кислоты в природе:
- 10. Карбоновые кислоты в природе: Янтарная кислота НООС-СН2-СН2-СООН
- 11. Карбоновые кислоты в природе: Стеариновая кислота С17Н35СООН
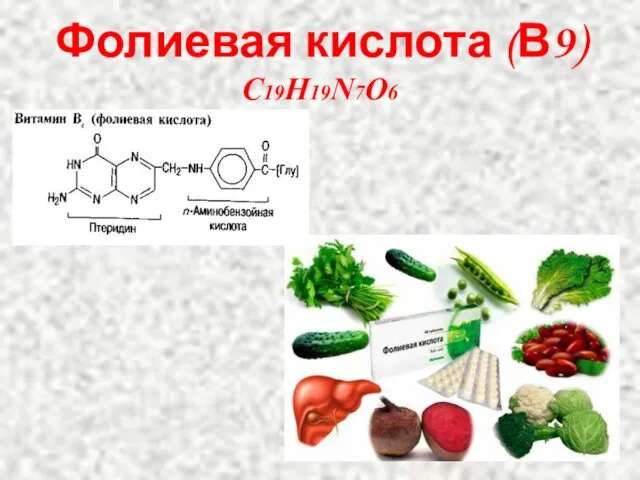
- 12. Фолиевая кислота (В9) C19H19N7O6
- 13. Кислоты нашей пищи
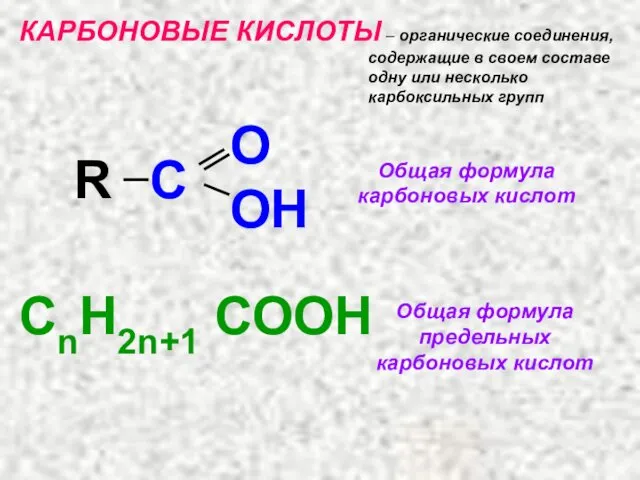
- 14. КАРБОНОВЫЕ КИСЛОТЫ – органические соединения, содержащие в своем составе одну или несколько карбоксильных групп R C
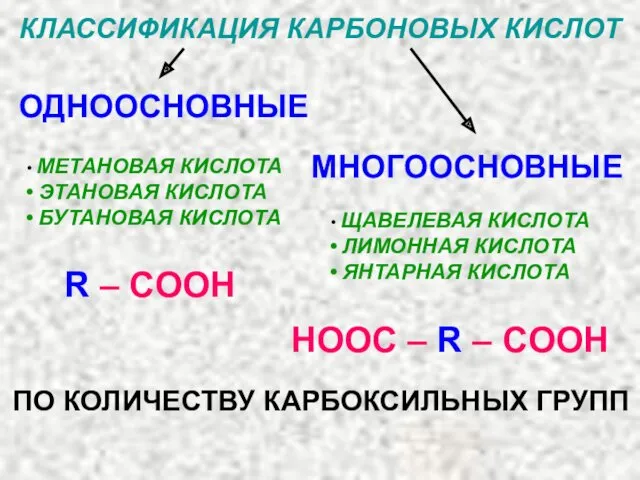
- 15. КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ ОДНООСНОВНЫЕ МНОГООСНОВНЫЕ МЕТАНОВАЯ КИСЛОТА ЭТАНОВАЯ КИСЛОТА БУТАНОВАЯ КИСЛОТА ЩАВЕЛЕВАЯ КИСЛОТА ЛИМОННАЯ КИСЛОТА ЯНТАРНАЯ
- 16. КЛАССИФИКАЦИЯ КАРБОНОВЫХ КИСЛОТ ПРЕДЕЛЬНЫЕ НЕПРЕДЕЛЬНЫЕ АРОМАТИЧЕСКИЕ МЕТАНОВАЯ КИСЛОТА ЭТАНОВАЯ КИСЛОТА БУТАНОВАЯ КИСЛОТА ОЛЕИНОВАЯ КИСЛОТА ЛИНОЛЕВАЯ КИСЛОТА
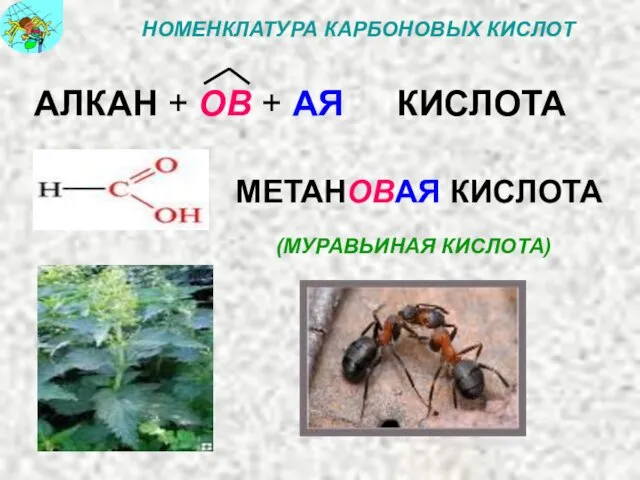
- 19. НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ АЛКАН + ОВ + АЯ КИСЛОТА МЕТАНОВАЯ КИСЛОТА (МУРАВЬИНАЯ КИСЛОТА)
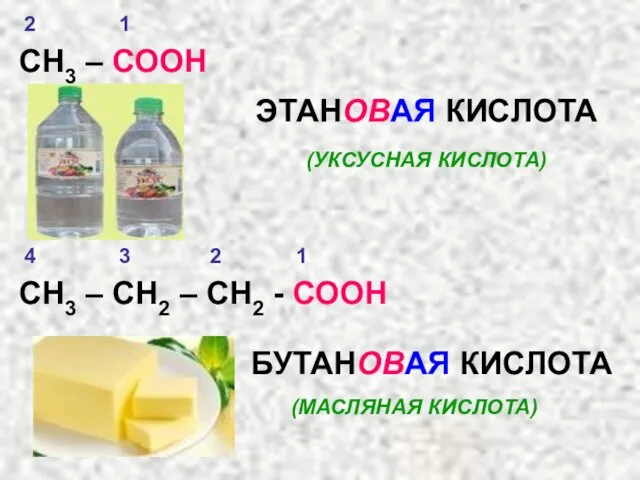
- 21. СН3 – СООН ЭТАНОВАЯ КИСЛОТА (УКСУСНАЯ КИСЛОТА) СН3 – СН2 – СН2 - СООН БУТАНОВАЯ КИСЛОТА
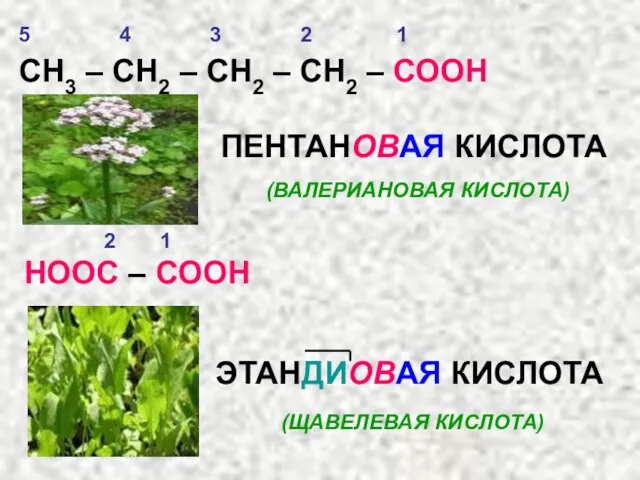
- 23. СН3 – СН2 – СН2 – СН2 – СООН ПЕНТАНОВАЯ КИСЛОТА (ВАЛЕРИАНОВАЯ КИСЛОТА) НООС – СООН
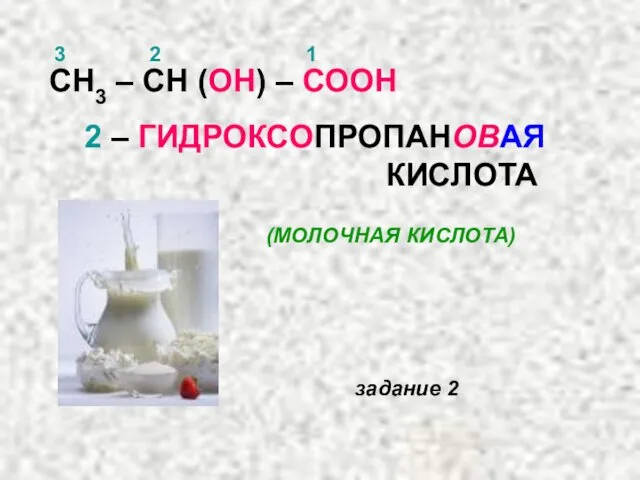
- 25. СН3 – СН (ОН) – СООН 1 2 3 2 – ГИДРОКСОПРОПАНОВАЯ КИСЛОТА (МОЛОЧНАЯ КИСЛОТА) задание
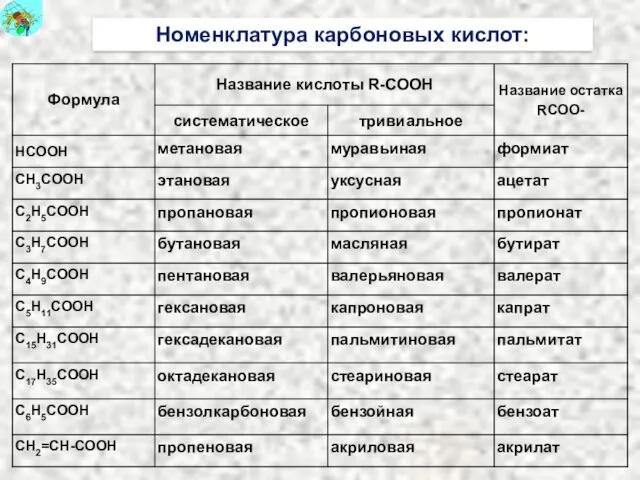
- 26. Номенклатура карбоновых кислот:
- 27. ДАЙТЕ НАЗВАНИЕ ВЕЩЕСТВАМ ПО МЕЖДУНАРОДНОЙ НОМЕНКЛАТУРЕ 1) СН3 – СН(СН3) – СООН 2) СН3 – СН2
- 28. ОТВЕТЫ 1) 2 – МЕТИЛПРОПАНОВАЯ КИСЛОТА 2) 2, 3 – ДИМЕТИЛПЕНТАНОВАЯ КИСЛОТА 3) 2 – МЕТИЛБУТАНОВАЯ
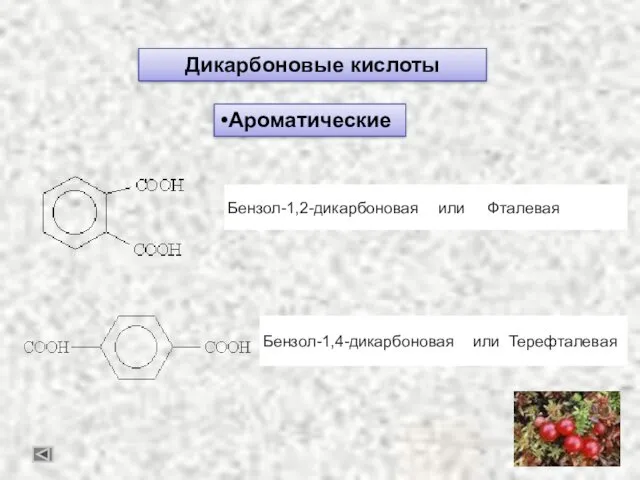
- 29. Карбоновые кислоты. Дикарбоновые кислоты Этандиовая или Щавелевая кислота Пропандиовая кислота или Малоновая. Бутандиовая кислота или Янтарная.
- 30. Дикарбоновые кислоты Ароматические
- 31. ИЗОМЕРИЯ КАРБОНОВЫХ КИСЛОТ Для предельных карбоновых кислот УГЛЕРОДНОГО СКЕЛЕТА МЕЖКЛАССОВАЯ (СЛОЖНЫЕ ЭФИРЫ) Для непредельных карбоновых кислот
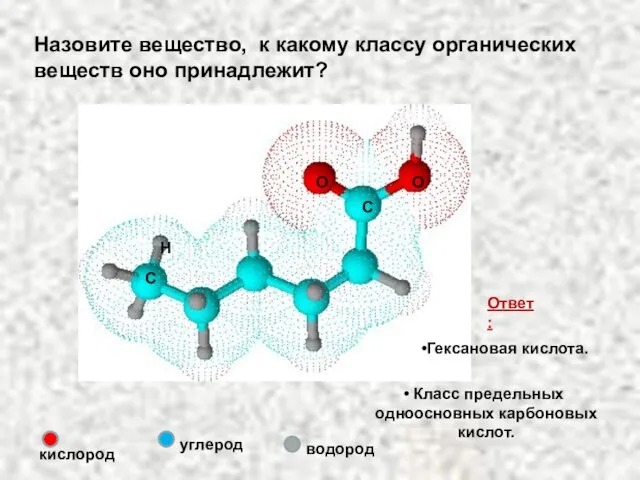
- 32. Назовите вещество, к какому классу органических веществ оно принадлежит? С О О С Н кислород углерод
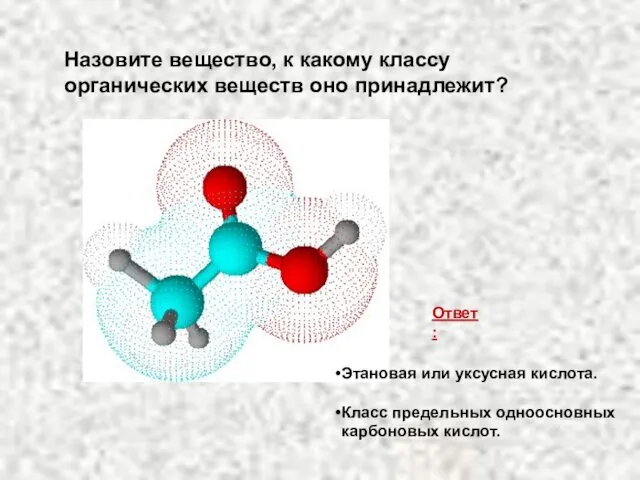
- 33. Назовите вещество, к какому классу органических веществ оно принадлежит? Ответ: Этановая или уксусная кислота. Класс предельных
- 34. ФИЗИЧЕСКИЕ СВОЙСТВА С1 – С3 С4 – С9 C10 и > Жидкости с характерным резким запахом,
- 35. Одноосновные карбоновые кислоты можно представить как: R- COOH где R – углеводородный радикал.(СН3-), Как можно объяснить,
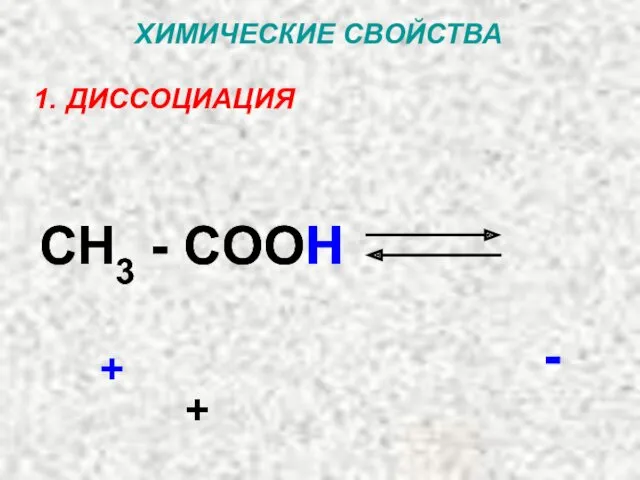
- 36. ХИМИЧЕСКИЕ СВОЙСТВА ДИССОЦИАЦИЯ CH3 - COO H + - + CH3 - COOH
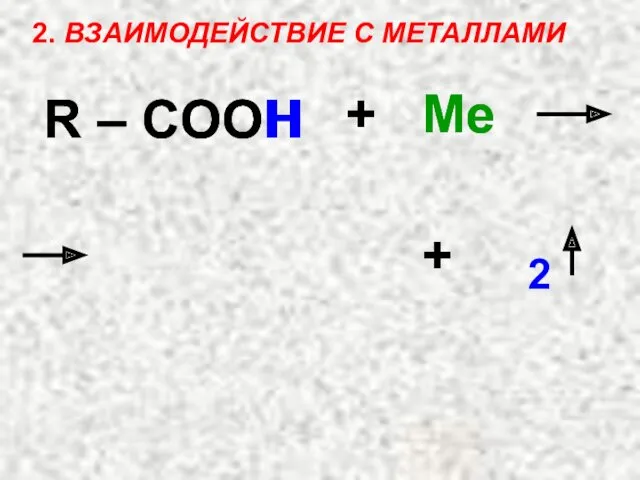
- 37. 2. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ R – COOH + Ме + 2 R – COO H Ме
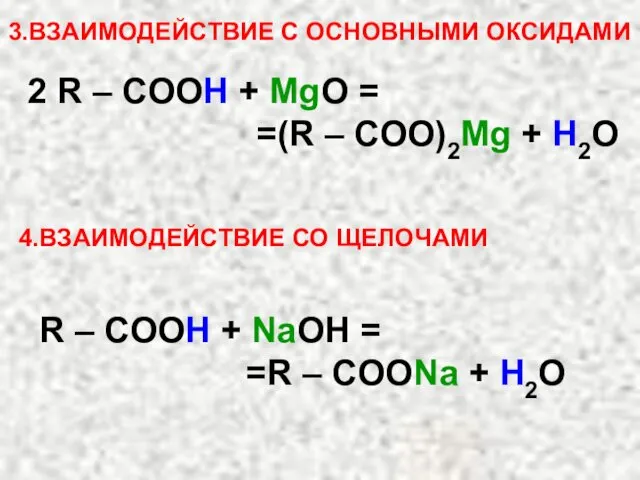
- 38. 3.ВЗАИМОДЕЙСТВИЕ С ОСНОВНЫМИ ОКСИДАМИ 2 R – COOH + MgO = =(R – COO)2Mg + H2O
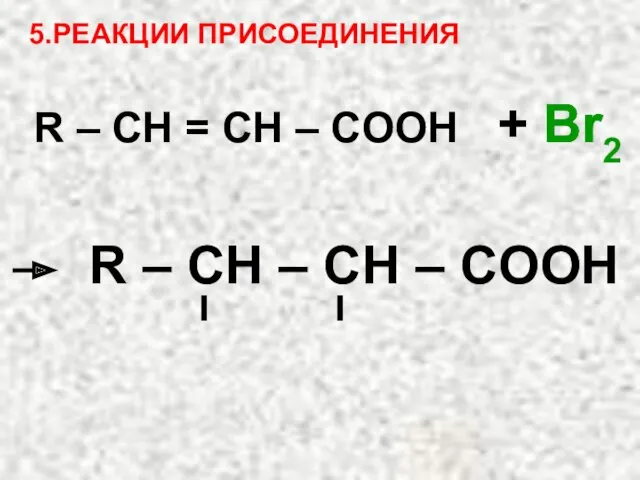
- 39. 5.РЕАКЦИИ ПРИСОЕДИНЕНИЯ R – CH = СH – COOH + Br2 Br Br R – CH
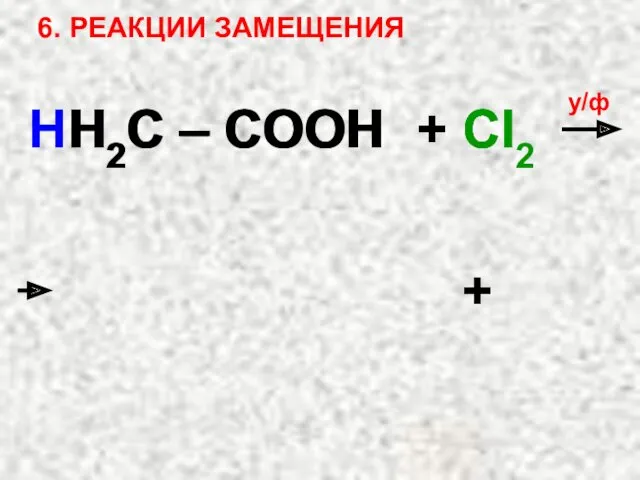
- 40. 6. РЕАКЦИИ ЗАМЕЩЕНИЯ HH2C – COOH + Cl2 у/ф + H2C – COOH Cl Cl H
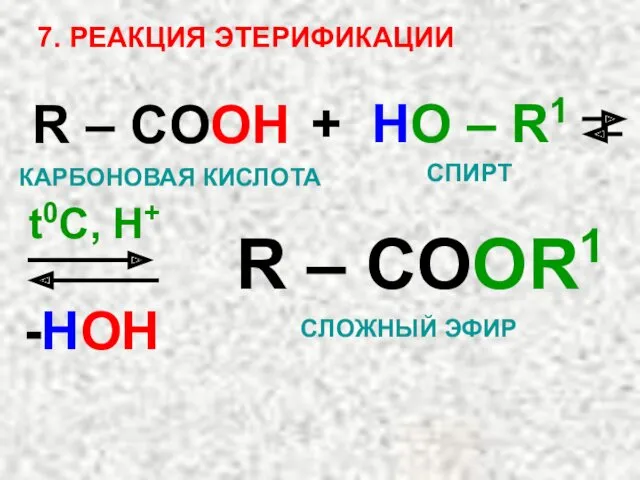
- 41. 7. РЕАКЦИЯ ЭТЕРИФИКАЦИИ R – COOH + HO – R1 R – COOR1 -HOH t0C, H+
- 46. Тестирование: 1. Какие из названных кислот являются органическими? а) муравьиная; б) азотная; в) серная; г) лимонная.
- 47. Выполните задания: 1.Выпишите формулы карбоновых кислот и дайте им названия. C6H5–CH2–OH CH3–CH2–CH2–COOH H–COOH CH3–CH2–COH CH3–O–C2H5 C17H35–COOH
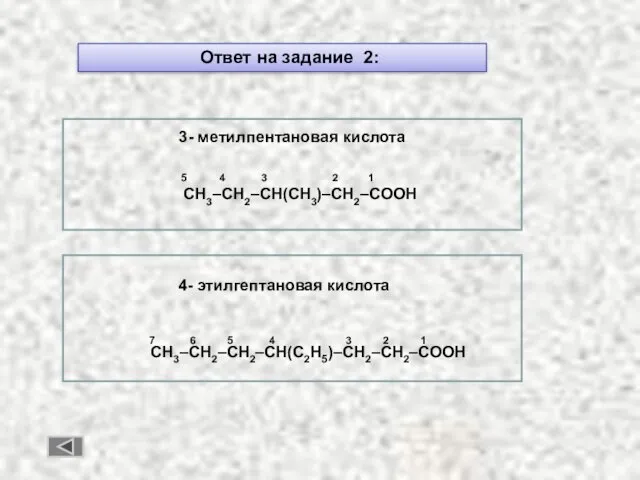
- 48. Ответ на задание 2: 3- метилпентановая кислота 5 4 3 2 1 CH3–CH2–CH(CH3)–CH2–COOH 4- этилгептановая кислота
- 49. Записать формулы изомеров для пентановой (валериановой) кислоты. Дать им названия. Написать два гомолога для этой кислоты
- 50. Всем успехов! 1 2 3
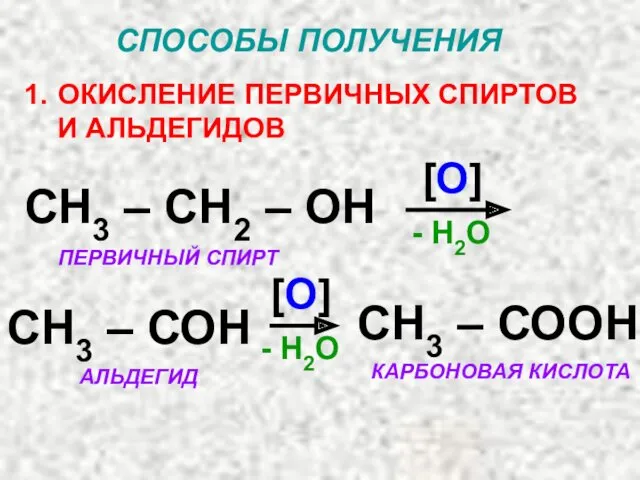
- 51. СПОСОБЫ ПОЛУЧЕНИЯ ОКИСЛЕНИЕ ПЕРВИЧНЫХ СПИРТОВ И АЛЬДЕГИДОВ СН3 – СН2 – ОН [О] - Н2О СН3
- 52. 2. ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ СН3 – СООС2Н5 + НОН Н+ СН3 – СООН + С2Н5ОН
- 53. Схема превращения: С СН4 СН3CI CH3OH HCOH HCOOH CO2 C + … = CH4 2) CH4
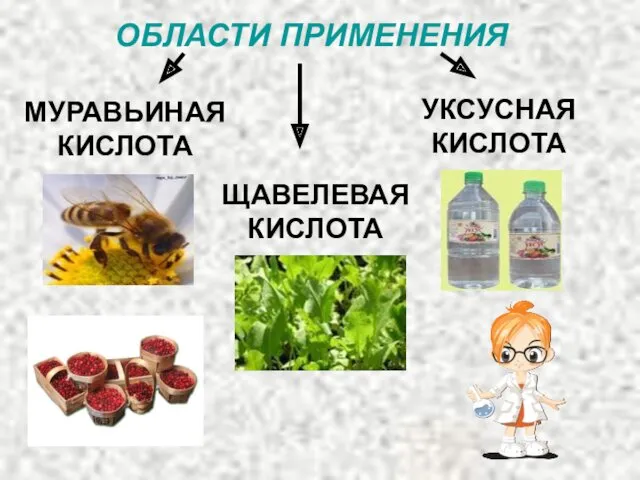
- 54. ОБЛАСТИ ПРИМЕНЕНИЯ МУРАВЬИНАЯ КИСЛОТА УКСУСНАЯ КИСЛОТА ЩАВЕЛЕВАЯ КИСЛОТА
- 58. Итоги урока: 3)Достигли ли мы поставленных целей в начале урока? уксус 1) С какими кислородсодержащими соединениями
- 60. Скачать презентацию




































 Лирика русского рока
Лирика русского рока Особенности перевода Complex Subject
Особенности перевода Complex Subject Совещание первосвященников об убиении Христа. Предательство Иуды
Совещание первосвященников об убиении Христа. Предательство Иуды Организация работы в специализированных (БИТ) и линейных бригадах скорой помощи
Организация работы в специализированных (БИТ) и линейных бригадах скорой помощи Презентация Белгородчина спортивная
Презентация Белгородчина спортивная ЧС гидрологического происхождения. Контрольное тестирование
ЧС гидрологического происхождения. Контрольное тестирование История почтовой открытки
История почтовой открытки Участковые станции
Участковые станции Вчера, сегодня,завтра. Активизация в речи правильного употребления времен глаголов
Вчера, сегодня,завтра. Активизация в речи правильного употребления времен глаголов А. А. Блок Двенадцать
А. А. Блок Двенадцать Разговор с родителями Поощрение или наказание
Разговор с родителями Поощрение или наказание Умный дом
Умный дом Способы решения квадратных уравнений
Способы решения квадратных уравнений Нарушения проводимости блокады сердца
Нарушения проводимости блокады сердца Сюжетно-ролевая игра
Сюжетно-ролевая игра MS Excel: основы работы
MS Excel: основы работы Конструктивные особенности станков с ЧПУ
Конструктивные особенности станков с ЧПУ Клуб Двойная навигация. Контроль давления. УЗИ. Нейростимулция
Клуб Двойная навигация. Контроль давления. УЗИ. Нейростимулция Международный аэропорт Париж-Шарль де Голль
Международный аэропорт Париж-Шарль де Голль Перевёрнутый треугольник (женский тип фигуры)
Перевёрнутый треугольник (женский тип фигуры) Формула объема прямоугольного параллелепипеда Диск
Формула объема прямоугольного параллелепипеда Диск Ауыздың кілегей қабығының гиперкератотикалық өзгерістері бар науқастарға көмекті жоспарлау
Ауыздың кілегей қабығының гиперкератотикалық өзгерістері бар науқастарға көмекті жоспарлау Фильтр оценки состояния для непрерывных систем (наблюдатель вектора состояния)
Фильтр оценки состояния для непрерывных систем (наблюдатель вектора состояния) Световые явления в живой и неживой природе
Световые явления в живой и неживой природе Презентация Огород на подоконнике
Презентация Огород на подоконнике Лепим ягоды и фрукты
Лепим ягоды и фрукты Мешочек для подарков — копия
Мешочек для подарков — копия Использование энергии газового потока дла выработки электрической энергии
Использование энергии газового потока дла выработки электрической энергии