Содержание
- 2. 1. Определение и классификация 2. Отдельные представители 3. Обнаружение кислот 4.Техника безопасности 5. Типичные реакции кислот
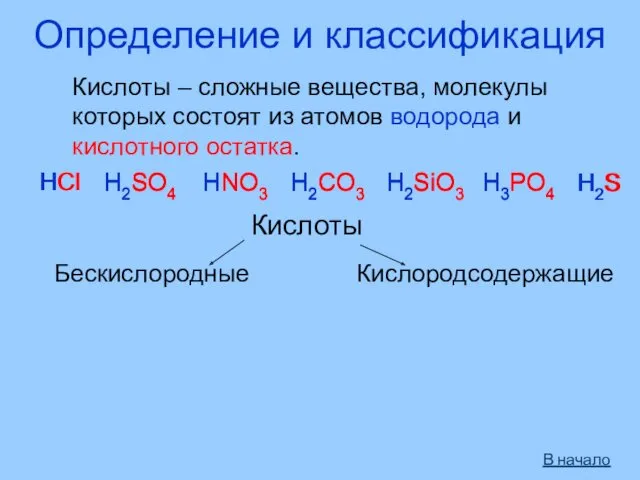
- 3. Определение и классификация Кислоты – сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка.
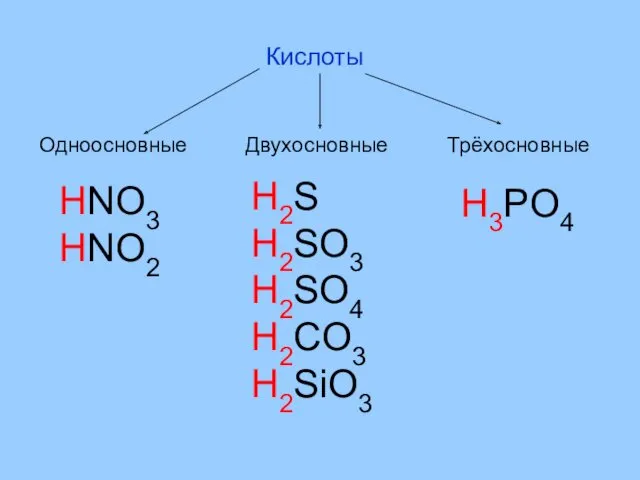
- 4. Кислоты Одноосновные Двухосновные Трёхосновные HNO3 HNO2 H2S H2SO3 H2SO4 H2CO3 H2SiO3 H3PO4
- 5. Классификация кислот
- 6. Кислоты- электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков HCL H++CL- H2SO4 3H++PO43-
- 7. НОМЕНКЛАТУРА КИСЛОТ Бескислородные кислоты: К названию кислотообразующего элемента добавляют гласную «о» и слова «водородная кислота» H2S
- 8. Химические свойства кислот Диссоциация; Взаимодействие с индикаторами; Взаимодействие с металлами; Взаимодействие с основными оксидами; Взаимодействие с
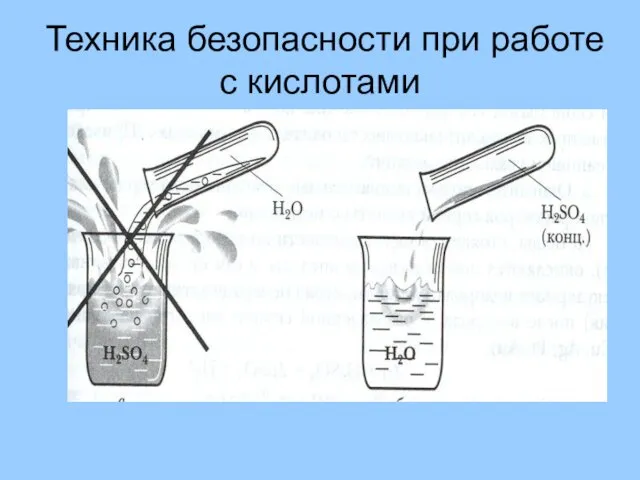
- 9. Техника безопасности при работе с кислотами
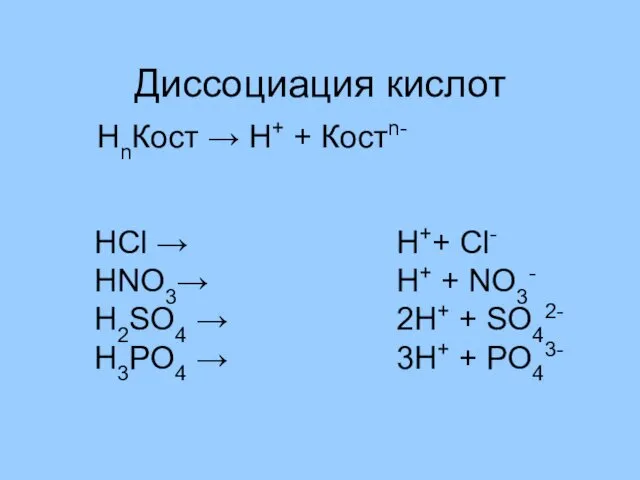
- 10. Диссоциация кислот HCl → HNO3→ H2SO4 → H3PO4 → НnКост → Н+ + Костn- H++ Cl-
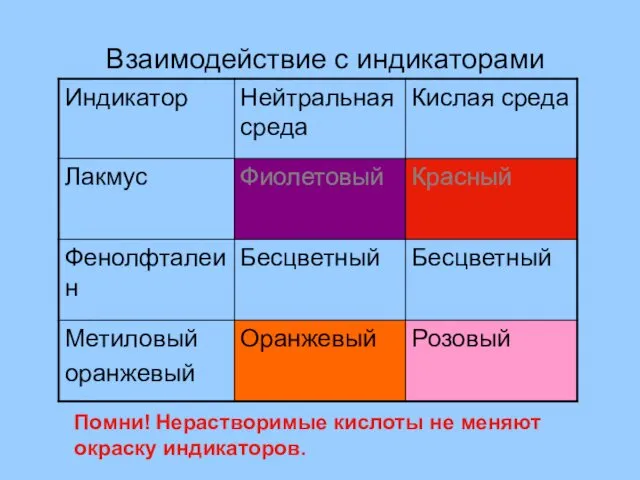
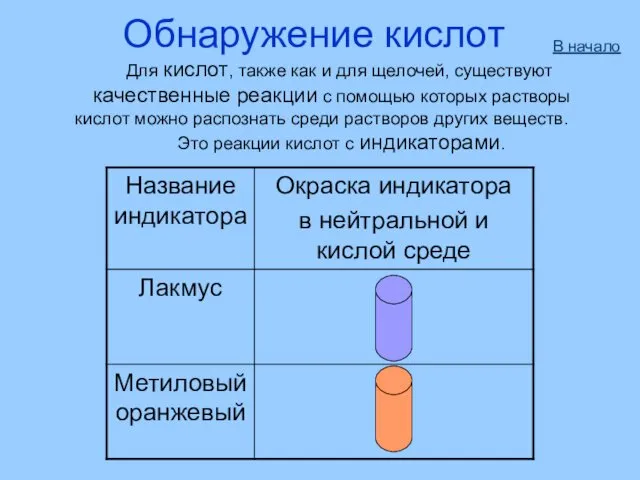
- 11. Взаимодействие с индикаторами Помни! Нерастворимые кислоты не меняют окраску индикаторов.
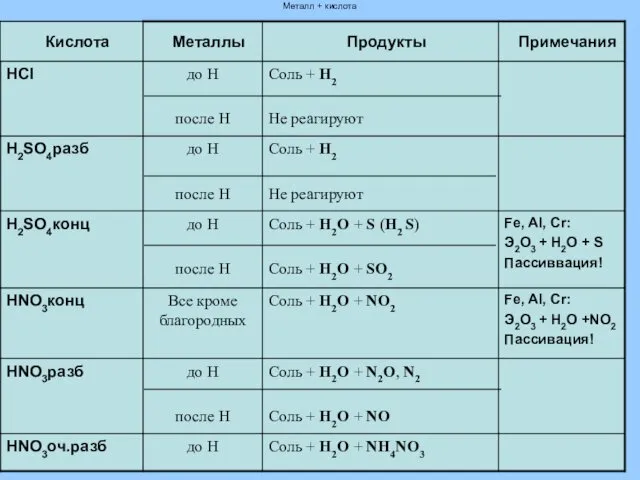
- 12. Взаимодействие с металлами Ме + НnКост → МеnКостm+ Н2 металл + кислота→соль + водород 2 Al
- 13. Металл + кислота
- 14. Взаимодействие с основными оксидами МеxOy + HnКост → МеnКостy + H2O Основный оксид + кислота →
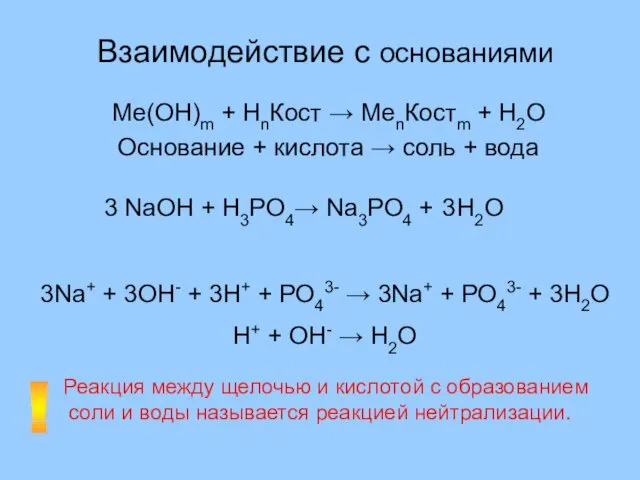
- 15. Взаимодействие с основаниями Ме(ОН)m + НnКост → MenКостm + H2O Основание + кислота → соль +
- 16. Взаимодействие с солями МеxКостy + HnКост → HхКост + МеnКостy Соль + кислота → новая кислота
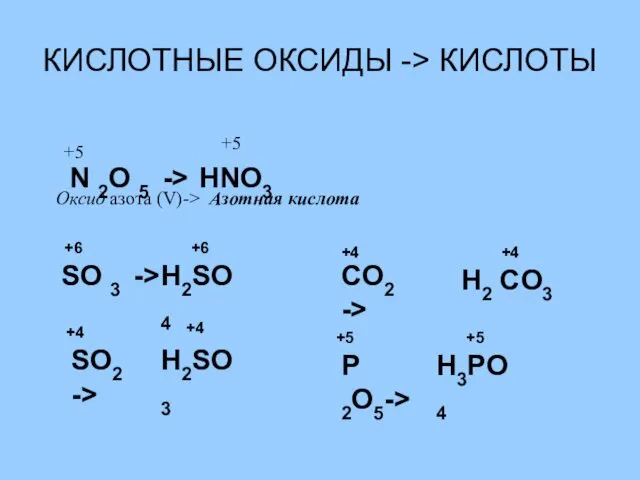
- 17. КИСЛОТНЫЕ ОКСИДЫ -> КИСЛОТЫ N 2O 5 -> HNO3 +5 +5 Оксид азота (V)-> Азотная кислота
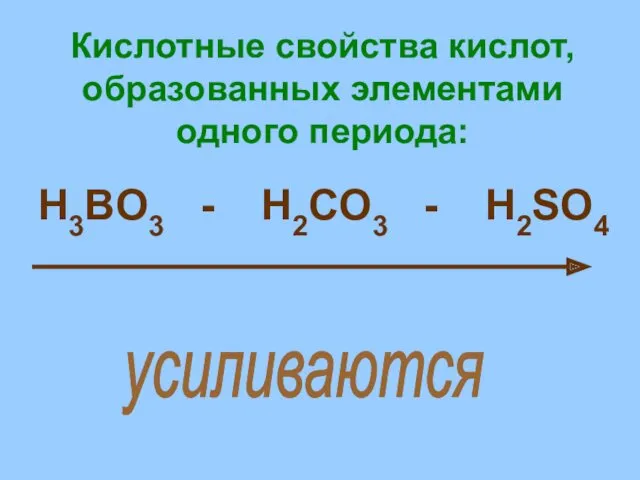
- 18. Кислотные свойства кислот, образованных элементами одного периода: H3BO3 - H2CO3 - H2SO4 усиливаются
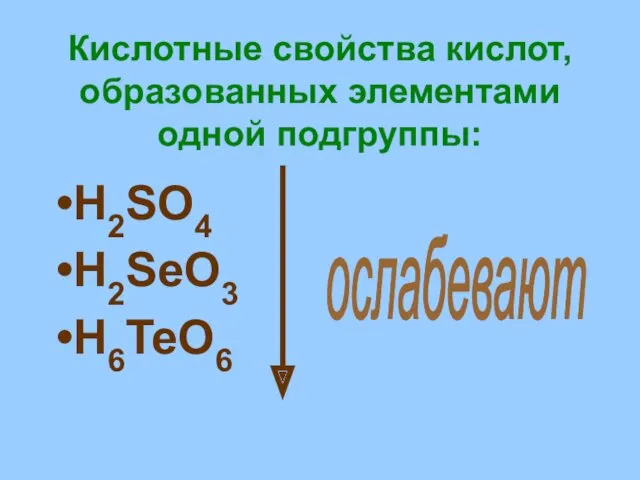
- 19. Кислотные свойства кислот, образованных элементами одной подгруппы: H2SO4 H2SeO3 H6TeO6 ослабевают
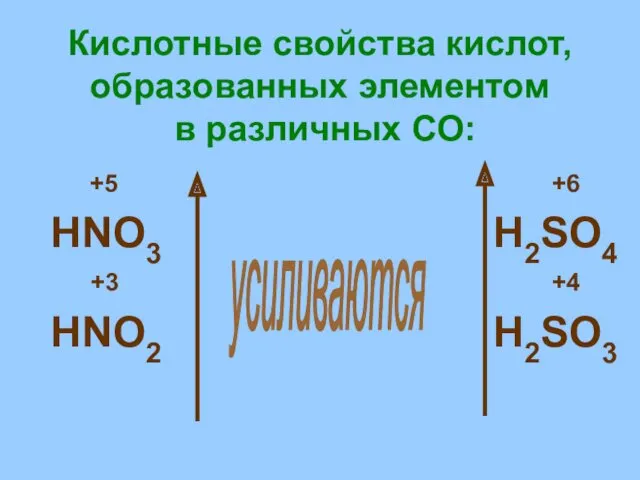
- 20. Кислотные свойства кислот, образованных элементом в различных СО: +5 +6 HNO3 H2SO4 +3 +4 HNO2 H2SO3
- 21. Серная кислота – бесцветная жидкость, вязкая, как масло, не имеющая запаха, почти вдвое тяжелее воды. Серная
- 22. Угольная кислота H2CO3 УГОЛЬНАЯ КИСЛОТА - очень слабая и непрочная кислота. Образуется при растворении диоксида углерода
- 23. СОЛЯНАЯ КИСЛОТА - бесцветная, «дымящая» на воздухе жидкость. Составная часть желудочного сока. Соляная кислота НCl В
- 24. Кислоты в быту
- 25. Газообразный водород совершенно безвкусен. Зато некоторые вещества, в молекулах которых есть атомы водорода, довольно часто оказываются
- 26. Области применения кислот: Азотная кислота широко используется для производства удобрений, красителей, лаков, пластмасс, лекарственных и взрывчатых
- 27. Фосфорная кислота используется в составах для обезжиривания металлических поверхностей перед нанесением защитных покрытий, входит в состав
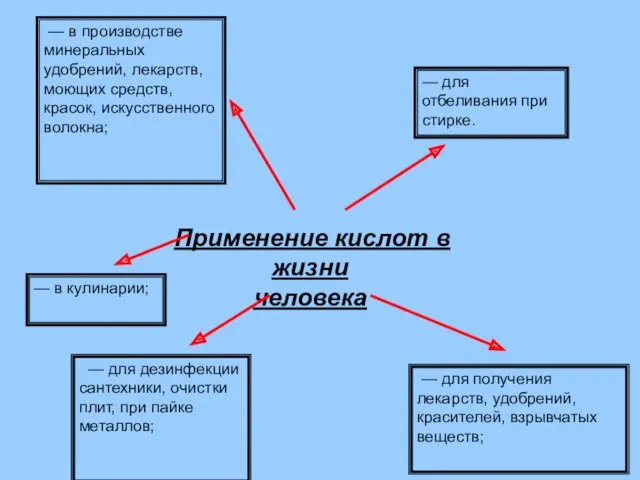
- 28. Применение кислот в жизни человека
- 29. ЗАКОНЧИТЕ УРАВНЕНИЯ РЕАКЦИЙ. Са+ HNO2 -> 2 FeO + HNO2 -> 2 Cu (OH )2+ H
- 30. 1.Формула кислоты это: 1) КOH 2) CаCl2 3) HCL 4) SO2 2. С раствором серной кислоты
- 31. 4. Степень окисления серы в серной кислоте 1) +3; 2) +4; 3) +5; 4) +6. 5.Степень
- 32. 8. Реакция между магнием и соляной кислотой относится к реакциям 1) соединения; 3) разложения; 2) обмена;
- 33. 10.К сильным кислотам относятся вещества ряда 1) HC l; H Br; H2S 2) H2S; H2SO3; H2SO4
- 34. Обнаружение кислот Для кислот, также как и для щелочей, существуют качественные реакции с помощью которых растворы
- 35. Техника безопасности При растворении серной кислоты нужно вливать её тонкой струёй в воду при помешивании В
- 36. ЗНАЧЕНИЕ КИСЛОТ В ЖИЗНИ ЧЕЛОВЕКА Пищевкусовые добавки Консервирование Производство лекарственных средств, красителей, полимеров, взрывчатых веществ, удобрений,
- 37. Продолжите уравнения реакций 1. Кислота + основание → соль + вода Н Сl + Na OH
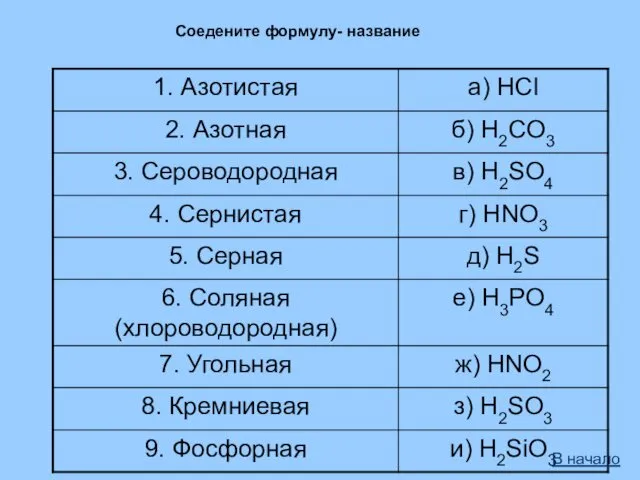
- 38. В начало Соедените формулу- название
- 39. Каким правилом техники безопасности пренебрёг лаборант? В начало
- 41. Скачать презентацию
























 Три признака параллельности двух прямых
Три признака параллельности двух прямых Титульные листы
Титульные листы Общие сведения о системе государственного радиолокационного опознавания Пароль. Лекция 19
Общие сведения о системе государственного радиолокационного опознавания Пароль. Лекция 19 Шизофрения и расстройства шизофренического спектра
Шизофрения и расстройства шизофренического спектра Математическая индукция
Математическая индукция Энергетические характеристики доменного производства
Энергетические характеристики доменного производства ГУЗ Павловская РБ имени заслуженного врача России А.И.Марьина. Годовой отчет
ГУЗ Павловская РБ имени заслуженного врача России А.И.Марьина. Годовой отчет Европейская часть России.дидактические материалы по географии 9 кл.
Европейская часть России.дидактические материалы по географии 9 кл. Сұйық отынды химиялық әдіспен өңдеу
Сұйық отынды химиялық әдіспен өңдеу Иосиф Виссарионович Сталин
Иосиф Виссарионович Сталин Приложение:презентация по теме Духовно-нравственное воспитание личности актуальная проблема современного педагогического образования
Приложение:презентация по теме Духовно-нравственное воспитание личности актуальная проблема современного педагогического образования Дом культуры Приморский, г. Новосибирск
Дом культуры Приморский, г. Новосибирск Исследовательский проект на тему Кошки – домашние животные
Исследовательский проект на тему Кошки – домашние животные 20231110_idioadaptatsii_nasekomyh
20231110_idioadaptatsii_nasekomyh Padezhi_imen_suschestvitelnykh
Padezhi_imen_suschestvitelnykh Общая экология
Общая экология Культура и искусство первой половины XX века
Культура и искусство первой половины XX века Функции цен
Функции цен Схема смены направления
Схема смены направления Управление вентиляционной установкой в автоматическом режиме
Управление вентиляционной установкой в автоматическом режиме Свобода и необходимость в человеческой деятельности. Свобода и ответственность
Свобода и необходимость в человеческой деятельности. Свобода и ответственность Turi̇zm ve temel kavramlari
Turi̇zm ve temel kavramlari Класс Паукообразные
Класс Паукообразные Трехмерное моделирование при кадастровом учете объектов капитального строительства
Трехмерное моделирование при кадастровом учете объектов капитального строительства Рисунок. Рисунок натюрморта
Рисунок. Рисунок натюрморта Водный транспорт
Водный транспорт Графический диктант для дошкольников
Графический диктант для дошкольников Я управляю собой
Я управляю собой