Содержание
- 2. Повторение: 1. Расставьте коэффициенты в следующих уравнениях реакций. Определите типы реакций: СаСО3 → СаО + CO2
- 3. Повторение 2. Напишите уравнения реакций по названиям исходных веществ и продуктов реакций. Определите типы реакций. А)
- 4. Первые попытки классификации химических элементов До 1200 г. нашей эры человек был знаком с семью металлами:
- 5. Но наука никогда не стоит на месте: Учёных – химиков того времени волновал вопрос: «Как классифицировать
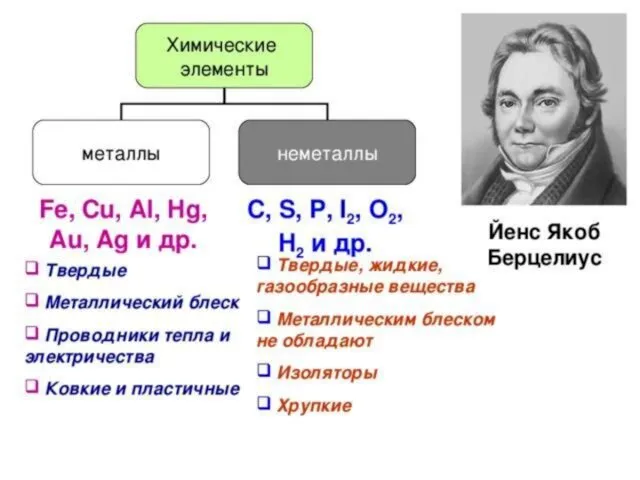
- 7. Химические свойства металлов и неметаллов Взаимодействие с водой: А) типичные металлы образуют основные оксиды, которым соответствуют
- 8. Классификация на металлы и неметаллы является неполной, так как существуют амфотерные соединения, проявляющие и кислотные и
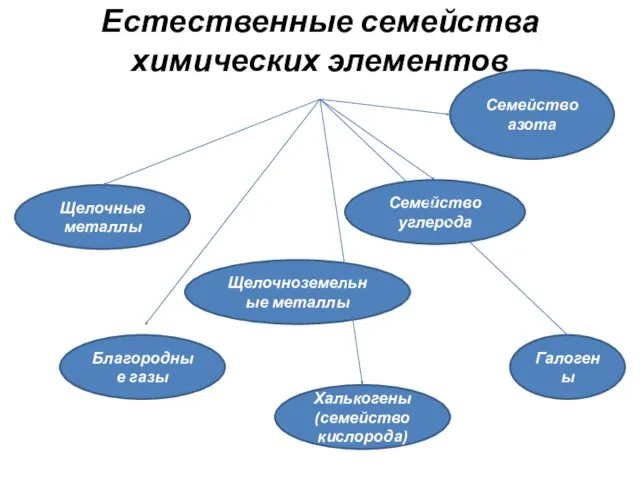
- 9. В середине XIX века химические элементы стали объединять в группы, получившие названия естественных семейств. Семейства –
- 10. Естественные семейства химических элементов Щелочные металлы Щелочноземельные металлы Благородные газы Семейство углерода Халькогены (семейство кислорода) Галогены
- 11. Щелочные металлы Элементы данного семейства: Li, Na, K, Rb, Cs, Fr Особенности данного семейства: А)При взаимодействии
- 12. Щелочноземельные металлы 1. Элементы данного семейства: Ca, Sr, Ba 2. Особенности данного семейства: А) Металлы и
- 13. Галогены 1. Элементы данного семейства: F, Cl, Br, I, At 2. Особенности данного семейства: А)Образуют простые
- 14. Хальгогены 1. Элементы данного семейства: O, S, Se, Te 2. Особенности данного семейства: А)Образуют кислотные оксиды
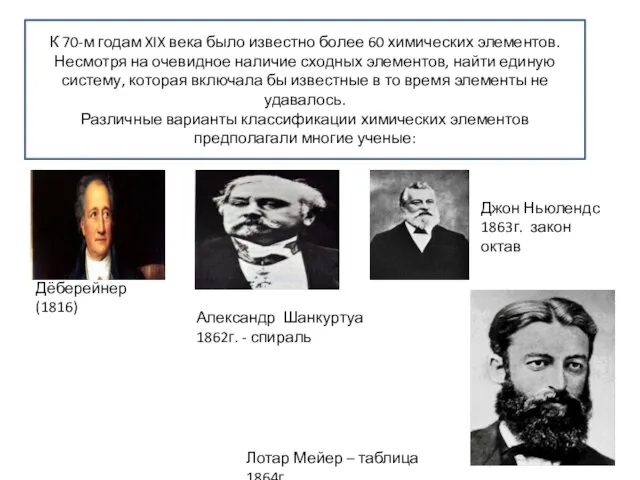
- 15. К 70-м годам XIX века было известно более 60 химических элементов. Несмотря на очевидное наличие сходных
- 17. Скачать презентацию











 Презентация к докладу Совершенствование профессиональных качеств учителя как один из путей повышения социального статуса педагога
Презентация к докладу Совершенствование профессиональных качеств учителя как один из путей повышения социального статуса педагога Programmable logic. Types
Programmable logic. Types Wypadki przy pracy rolniczej związane z czynnikiem ludzkim – analiza przyczyn wypadków w świetle działalności Państwowej
Wypadki przy pracy rolniczej związane z czynnikiem ludzkim – analiza przyczyn wypadków w świetle działalności Państwowej Экология. предмет, задачи, методы
Экология. предмет, задачи, методы Воспитатель, семья и ребенок в высокотехнологичном обществе. Диск
Воспитатель, семья и ребенок в высокотехнологичном обществе. Диск Чи варто змінювати свій мобільний телефон на смартфон?
Чи варто змінювати свій мобільний телефон на смартфон? Бензиновые двигатели с непосредственным впрыском. Кислородные датчики
Бензиновые двигатели с непосредственным впрыском. Кислородные датчики судостроительные верфи
судостроительные верфи Стандартизація продукції тваринництва
Стандартизація продукції тваринництва Круговорот воды в природе
Круговорот воды в природе Экологические группы растений по отношению к воде
Экологические группы растений по отношению к воде Из опыта работы с кохлеарно имплантированными детьми 1, 2 года обучения.
Из опыта работы с кохлеарно имплантированными детьми 1, 2 года обучения. Формирование толерантности на уроках и во внеклассной работе как средство успешной социализации младших школьников.
Формирование толерантности на уроках и во внеклассной работе как средство успешной социализации младших школьников. Шаблон Педагогика
Шаблон Педагогика Ориентация окон по сторонам. Свет в загородном доме
Ориентация окон по сторонам. Свет в загородном доме Процесс очистки и диагностики промысловых газопроводов
Процесс очистки и диагностики промысловых газопроводов Кинезиологические упражнения как средство активизации межполушарного взаимодействия и стимулирования познавательной деятельности.
Кинезиологические упражнения как средство активизации межполушарного взаимодействия и стимулирования познавательной деятельности. Famous people of Great Britain. Agatha Christie (15 September 1890 – 12 January 1976)
Famous people of Great Britain. Agatha Christie (15 September 1890 – 12 January 1976) Военные действия весной и летом 1942 г. Сталинград
Военные действия весной и летом 1942 г. Сталинград 20231113_selskoe_hozyaystvo
20231113_selskoe_hozyaystvo Выравнивание стен. Гипсовые штукатурки и шпаклёвки
Выравнивание стен. Гипсовые штукатурки и шпаклёвки Перипартальная кардиомиопатия. Кардиомиопатия беременных и женщин послеродового периода
Перипартальная кардиомиопатия. Кардиомиопатия беременных и женщин послеродового периода Nauka o organizacji i przedsiębiorstwie. Struktura społeczna i fizyczna organizacji. (Wyklad 6)
Nauka o organizacji i przedsiębiorstwie. Struktura społeczna i fizyczna organizacji. (Wyklad 6) Балеты Михаила Фокина антрепризе Сергея Дягилева
Балеты Михаила Фокина антрепризе Сергея Дягилева Компьютерная игра (презентация) Кто живет во дворе? к сценарию В гостях у бабушки Диск
Компьютерная игра (презентация) Кто живет во дворе? к сценарию В гостях у бабушки Диск Музей кукол.
Музей кукол. Государственная тайна
Государственная тайна Формирование экологической культуры на уроках географии и во внеурочное время
Формирование экологической культуры на уроках географии и во внеурочное время