Содержание
- 2. Химическая реакция - процесс превращения одних веществ в другие, отличающиеся от исходных составом или строением
- 3. Признаки химических реакций изменение цвета образование(растворение) осадка изменение запаха выделение (поглощение) энергии выделение газа
- 4. Сущность химических процессов Разрыв химических связей в реагентах. Возникновение новых связей в продуктах реакции. Получение готового
- 5. Типы химических реакций По числу и составу реагирующих веществ. По изменению степеней окисления химических элементов, образующих
- 6. Реакции, идущие с изменением состава вещества Реакции соединения (присоединения) Реакции разложения (отщепления) Реакции замещения Реакции обмена
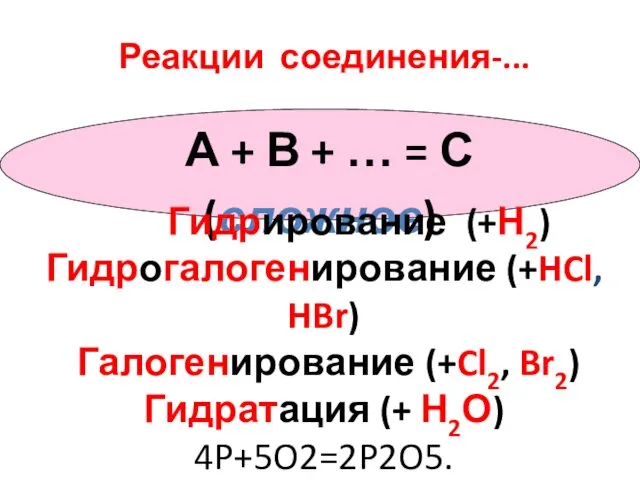
- 7. Реакции соединения-... А + В + … = С(сложное) Гидрирование (+Н2) Гидрогалогенирование (+HCl, HBr) Галогенирование (+Cl2,
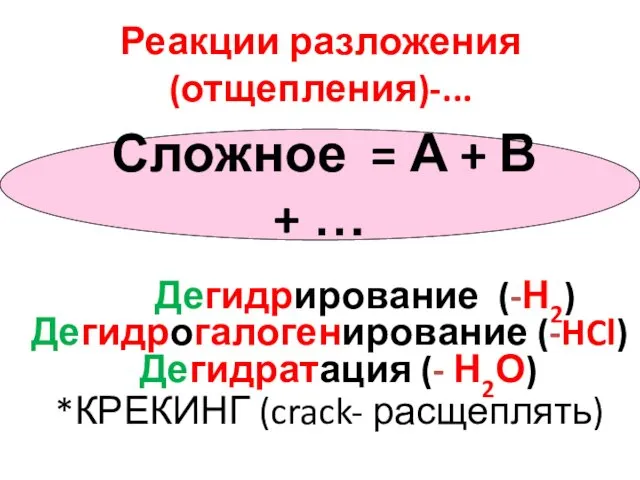
- 8. Реакции разложения (отщепления)-... Сложное = А + В + … Дегидрирование (-Н2) Дегидрогалогенирование (-HCl) Дегидратация (-
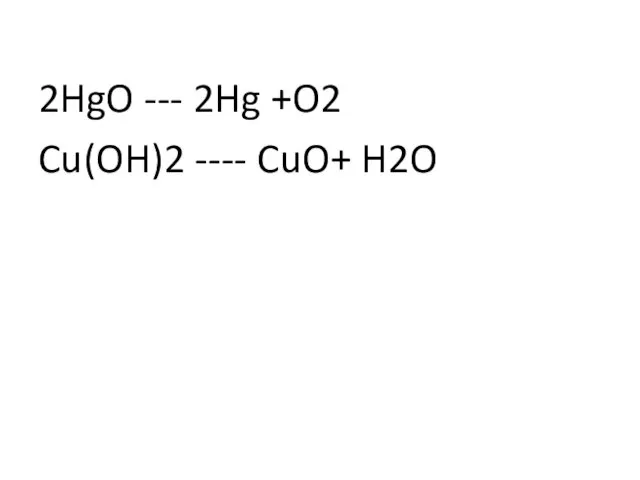
- 9. 2HgO --- 2Hg +O2 Cu(OH)2 ---- CuO+ H2O
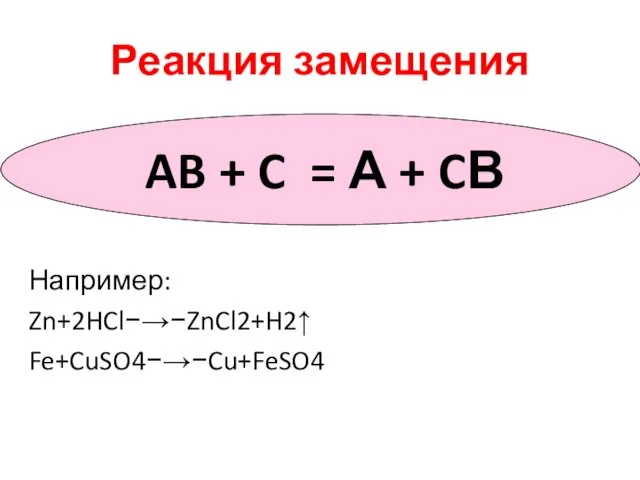
- 10. Реакция замещения Например: Zn+2HCl−→−ZnCl2+H2↑ Fe+CuSO4−→−Cu+FeSO4 AB + C = А + CВ
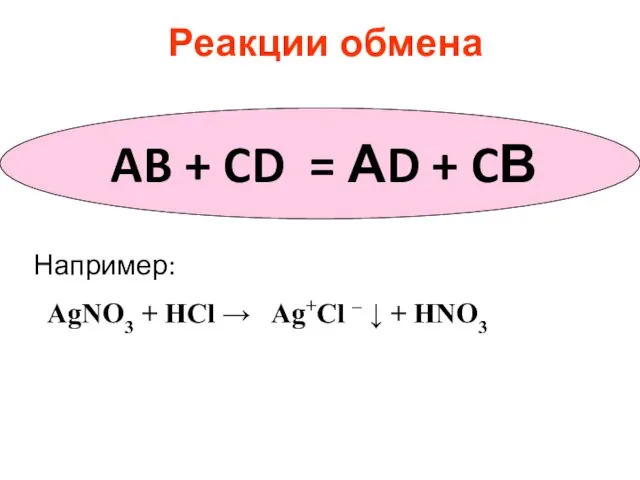
- 11. Реакции обмена Например: AB + CD = АD + CВ AgNO3 + HCl → Ag+Cl –
- 12. Условия протекания реакций обмена между растворами (правило Бертолле): 1) выпадение осадка (нерастворимого вещества) 2) выделение газа
- 13. NaOH + CuSO4---- Cu(OH)2 + Na2SO4 CaCO3 ---- CaO + CO2 (разложения) SO2+O2----SO3 ( соединения) Fe2O3
- 14. По тепловому эффекту Экзотермические реакции – реакции, протекающие с выделением энергии во внешнюю среду. К ним
- 15. Эндотермические реакции: Эндотермические реакции – реакции, протекающие с поглощением энергии во внешнюю среду. К ним относятся
- 16. По изменению степени окисления Окислительно-восстановительные реакции – реакции, идущие с изменением степеней окисления элементов. (OBP) 0
- 17. Не окислительно-восстановительные реакции - реакции, идущие без изменения степеней окисления элементов. К ним относятся все реакции
- 18. По фазовому составу Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты реакции находятся в
- 19. По использованию катализатора Некаталитические реакции - реакции, идущие без участия катализатора: 2HgO ⭢t 2Hg + O2⭡
- 20. По направлению: Необратимые реакции - протекают в данных условиях только в одном направлении. К таким реакциям
- 21. Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях. Таких реакций подавляющее большинство. Например:
- 23. Скачать презентацию














 Презентация Мой город
Презентация Мой город Адмiнiстративне i кримiнальне право. Головнi аспекти
Адмiнiстративне i кримiнальне право. Головнi аспекти Напряженно-деформированное состояние оболочечных конструкций, выполненных из материалов с усложненными механическими свойствами
Напряженно-деформированное состояние оболочечных конструкций, выполненных из материалов с усложненными механическими свойствами Познавательный проект на тему: Удомельский район в годы Великой Отечественной войны
Познавательный проект на тему: Удомельский район в годы Великой Отечественной войны Матрицы. Определитель матрицы
Матрицы. Определитель матрицы Дизартрия. Классификация клинических форм дизартрии
Дизартрия. Классификация клинических форм дизартрии radio_siti
radio_siti Тренажёр для подготовки к аттестационному тестированию по педагогике
Тренажёр для подготовки к аттестационному тестированию по педагогике Сюжетно-ролевая игра – средство формирования у дошкольников элементарных знаний об окружающем мире презентация
Сюжетно-ролевая игра – средство формирования у дошкольников элементарных знаний об окружающем мире презентация Резьбообрабатывающие станки
Резьбообрабатывающие станки Литературный поиск. Базы данных
Литературный поиск. Базы данных Наречие как часть речи. Правописание наречий
Наречие как часть речи. Правописание наречий Секты современной России
Секты современной России Проектирование, строительство и эксплуатация автомобильных дорог. Исследование характеристик колейности по Башкортостану
Проектирование, строительство и эксплуатация автомобильных дорог. Исследование характеристик колейности по Башкортостану Алексей Николаевич Плещеев В бурю
Алексей Николаевич Плещеев В бурю Буклет для родителей Информационная безопасность детей в Интернете
Буклет для родителей Информационная безопасность детей в Интернете Карцов Владимир Геннадьевич и Гиттис Изабелла Васильевна
Карцов Владимир Геннадьевич и Гиттис Изабелла Васильевна Собрание для родителей будущих первоклассников
Собрание для родителей будущих первоклассников Контур многократной принудительной циркуляции
Контур многократной принудительной циркуляции Анимация. Мультипликация. Виды анимации
Анимация. Мультипликация. Виды анимации Мягкие лекарственные формы
Мягкие лекарственные формы Неравновесные явления в растворах электролитов. Электрическая проводимость растворов электролитов
Неравновесные явления в растворах электролитов. Электрическая проводимость растворов электролитов урок Серная кислота
урок Серная кислота Творческий проект Логарифмическая линейка
Творческий проект Логарифмическая линейка Разработка ресурсосберегающего способа производства топливно-плавильных материалов на основе техногенного сырья (Н3)
Разработка ресурсосберегающего способа производства топливно-плавильных материалов на основе техногенного сырья (Н3) Представление целых чисел на координатной оси
Представление целых чисел на координатной оси Основы ландшафтной колористики
Основы ландшафтной колористики Песня по картинке
Песня по картинке