Содержание
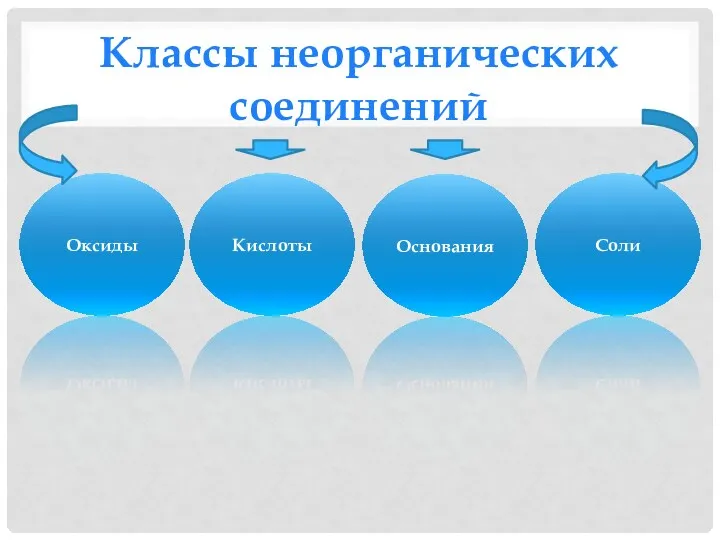
- 2. Классы неорганических соединений Оксиды Кислоты Основания Соли
- 3. оксиды Бинарные соединения, состоящие из двух элементов, одним из которых является кислород
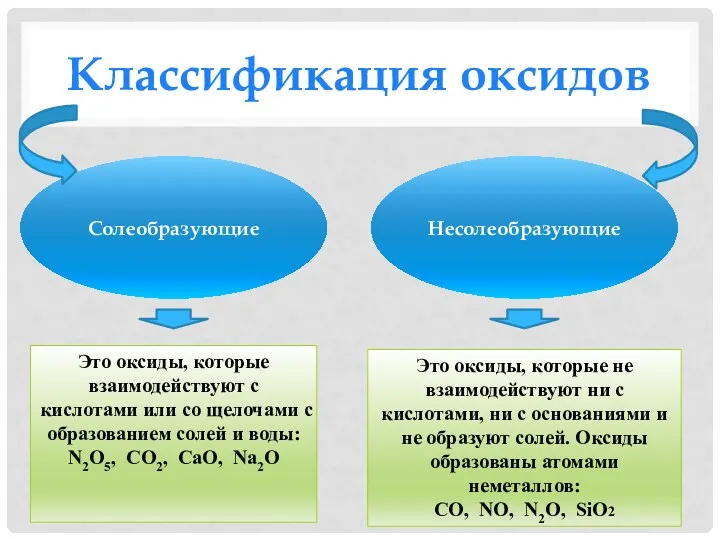
- 4. Классификация оксидов Солеобразующие Несолеобразующие Это оксиды, которые не взаимодействуют ни с кислотами, ни с основаниями и
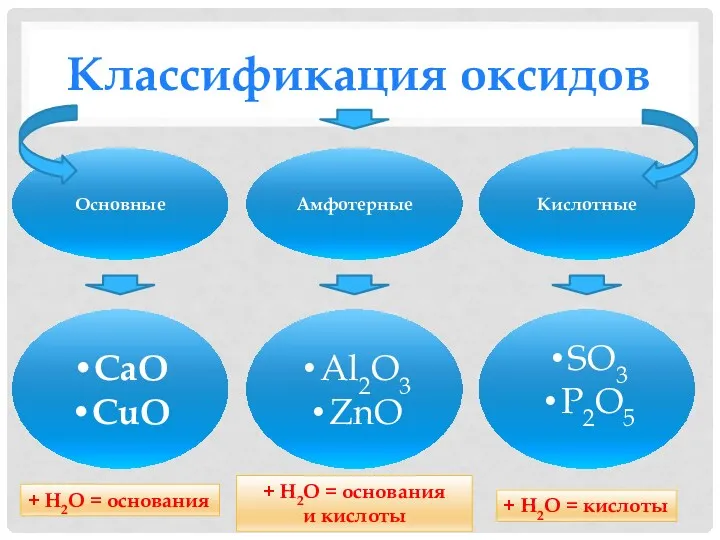
- 5. Классификация оксидов Основные Амфотерные Кислотные CaO CuO Al2O3 ZnO SO3 P2O5 + Н2О = основания +
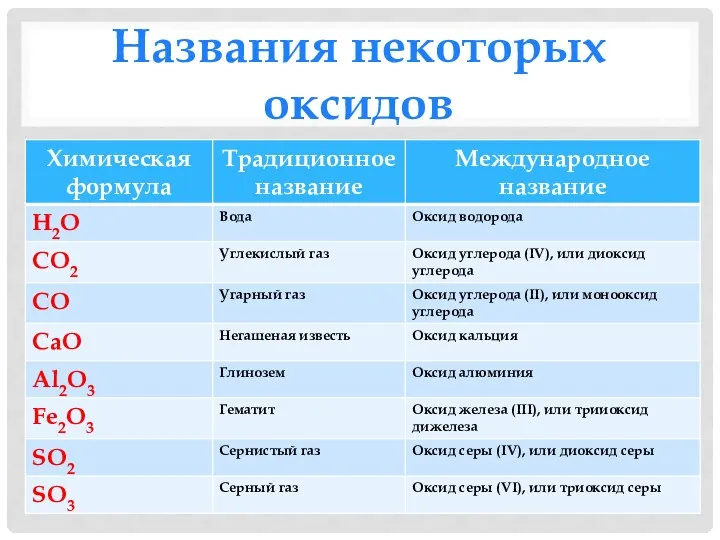
- 6. Названия некоторых оксидов
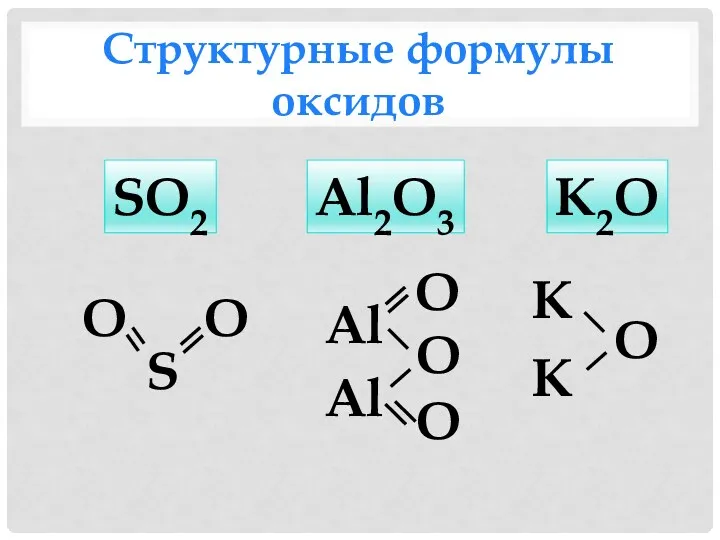
- 7. Структурные формулы оксидов SO2 S О О Al2O3 Al Al О О О К2O О К
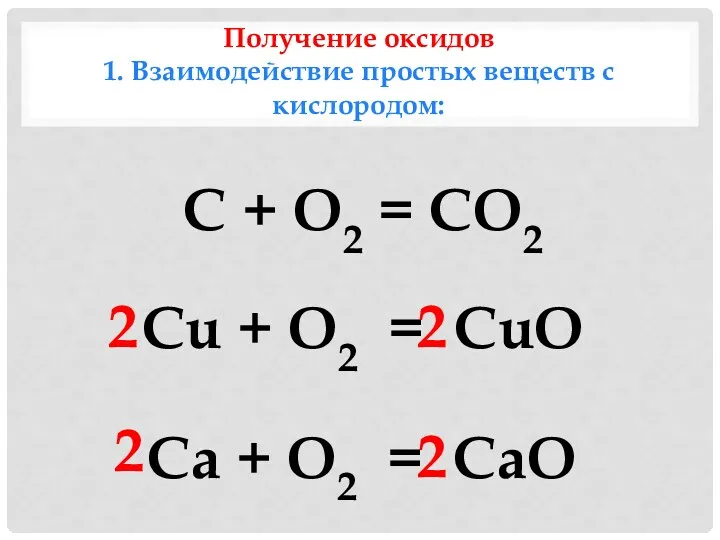
- 8. Получение оксидов 1. Взаимодействие простых веществ с кислородом: С + O2 = CO2 Cu + O2
- 9. Получение оксидов 2. Горение сложных веществ: CH4 + O2 = CO2 + H2O 2 2 Метан
- 10. Получение оксидов 3. Окисление оксидов: FeO + O2 = Fe2O3 CO + O2 = CO2 2
- 11. Получение оксидов 4. Разложение нерастворимых оснований при нагревании: 2 Mg(OH)2 = MgO + H2O Fe(OH)3 =
- 12. Получение оксидов 5. Разложение солей: CaCO3 = CaO + CO2 CaSO4 = CaO + SO3
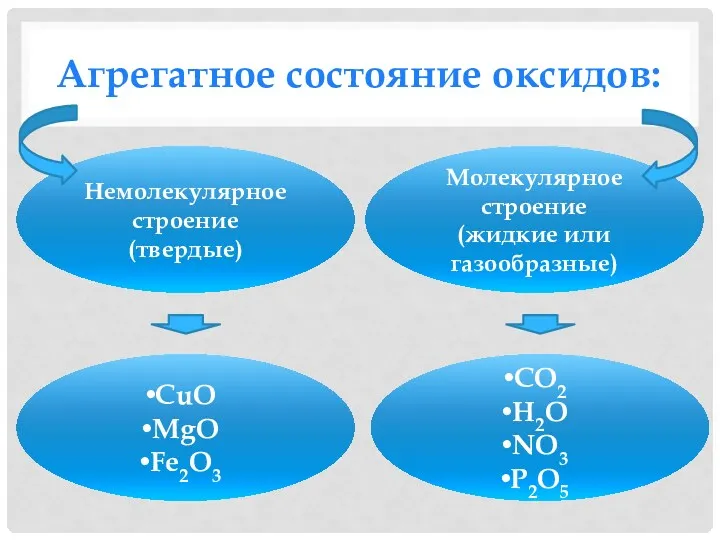
- 13. Агрегатное состояние оксидов: Немолекулярное строение (твердые) Молекулярное строение (жидкие или газообразные) CuO MgO Fe2O3 CO2 H2O
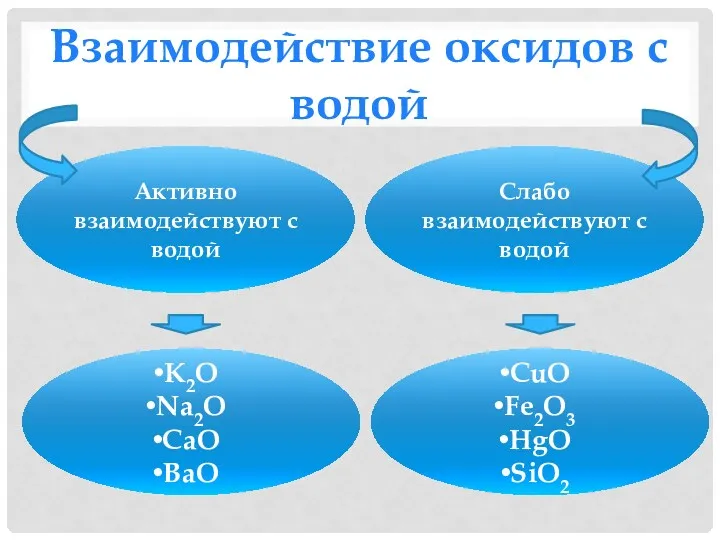
- 14. Взаимодействие оксидов с водой Активно взаимодействуют с водой Слабо взаимодействуют с водой K2O Na2O CaO BaO
- 15. Химические свойства основных оксидов 1. Взаимодействие основных оксидов с водой и образованием щелочи: Na2O + H2O
- 16. Химические свойства основных оксидов 2. Взаимодействие основных оксидов с сильными кислотами с образованием соли и воды:
- 17. Химические свойства основных оксидов 3. Взаимодействие основных и кислотных оксидов между собой с образованием соли: CaO
- 18. Химические свойства кислотных оксидов 1. Взаимодействие с водой с образование кислот: SO3 + H2O = H2SO4
- 19. Химические свойства кислотных оксидов 2. Взаимодействие кислотных оксидов со щелочами с образованием соли и воды: NaOH
- 20. Химические свойства кислотных оксидов 3. Взаимодействие кислотных оксидов с основными оксидами с образованием соли: SiO2 +
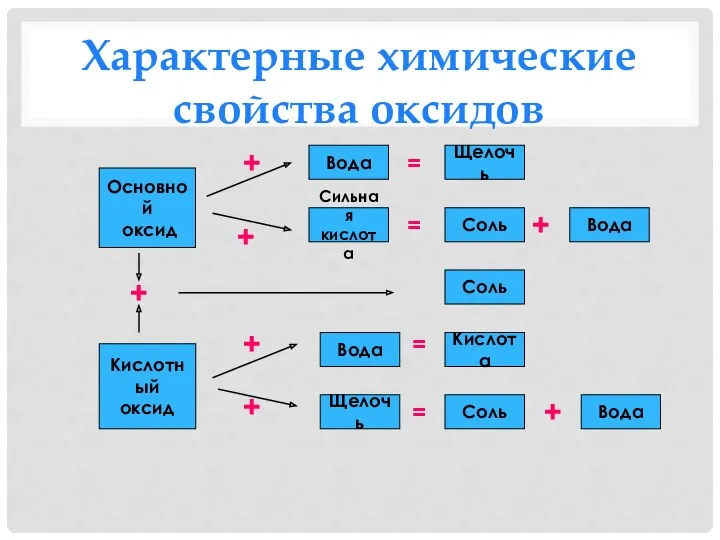
- 21. Характерные химические свойства оксидов Основной оксид Кислотный оксид Щелочь Вода Сильная кислота Вода Вода Вода Соль
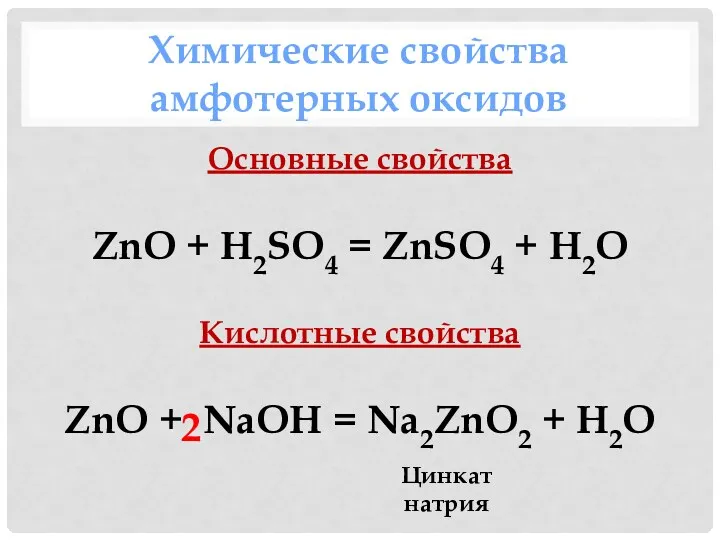
- 22. Химические свойства амфотерных оксидов Основные свойства ZnO + H2SO4 = ZnSO4 + H2O Кислотные свойства ZnO
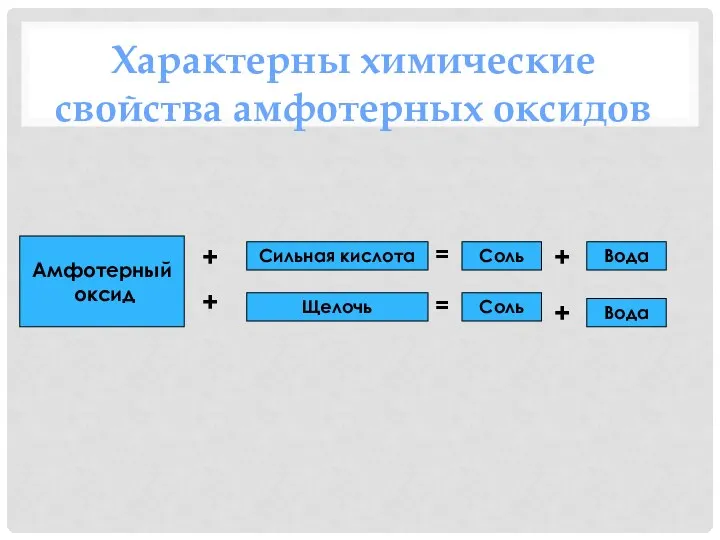
- 23. Амфотерный оксид Сильная кислота Щелочь Соль Соль Вода Вода + + + + = = Характерны
- 25. Скачать презентацию











 Автоматическая стабилизация и управление углом тангажа
Автоматическая стабилизация и управление углом тангажа Семейный проект Мои летние достижения
Семейный проект Мои летние достижения Вирус гриппа
Вирус гриппа Классный час, посвящённый памяти В. Высоцкого.
Классный час, посвящённый памяти В. Высоцкого. Расчет прогибов железобетонных элементов. (Тема 15)
Расчет прогибов железобетонных элементов. (Тема 15) Теории управления персоналом
Теории управления персоналом Экскурсия по уникальным природным объектам Рамешковского района
Экскурсия по уникальным природным объектам Рамешковского района Time. Useful words
Time. Useful words Кирило - Мефодіївське братство. Історія України
Кирило - Мефодіївське братство. Історія України Информационные технологии производственного менеджмента на предприятии
Информационные технологии производственного менеджмента на предприятии Роль химии в жизни человека
Роль химии в жизни человека Маркетинговые исследования
Маркетинговые исследования Родительское собрание на тему Домашние задания
Родительское собрание на тему Домашние задания Программа комплексного развития систем ком. инфраструктуры гор. округа Верхняя Пышма Свердловской обл на период до 2025
Программа комплексного развития систем ком. инфраструктуры гор. округа Верхняя Пышма Свердловской обл на период до 2025 Производство чугуна и стали
Производство чугуна и стали Расчет и конструирование крупнопанельных зданий
Расчет и конструирование крупнопанельных зданий Первая помощь при острой сердечной недостаточной
Первая помощь при острой сердечной недостаточной Страницы для портфолио дошкольника
Страницы для портфолио дошкольника Вести от Иисуса для последнего времени. Часть 4
Вести от Иисуса для последнего времени. Часть 4 Моделирование систем. Управление рисками, системный анализ и моделирование. Лекции 11-12
Моделирование систем. Управление рисками, системный анализ и моделирование. Лекции 11-12 Откуда пришел сахар
Откуда пришел сахар КАК ЧЕЛОВЕК ИЗМЕНИЛ ЗЕМЛЮ(ПРЕЗЕНТАЦИИ К УРОКУ)
КАК ЧЕЛОВЕК ИЗМЕНИЛ ЗЕМЛЮ(ПРЕЗЕНТАЦИИ К УРОКУ) Безработица. Причины, формы и последствия безработицы
Безработица. Причины, формы и последствия безработицы презентация Всесторонне развитие детей средствами произведений К.И.Чуковского
презентация Всесторонне развитие детей средствами произведений К.И.Чуковского презентация с заданиями для тренировки внимания
презентация с заданиями для тренировки внимания Өмір бойы білім алу- бәсекенің талабы
Өмір бойы білім алу- бәсекенің талабы Вид. Критерии вида
Вид. Критерии вида Развитие биоэнергетики как одна из актуальных проблем аграрной экономики и менеджмента
Развитие биоэнергетики как одна из актуальных проблем аграрной экономики и менеджмента