Содержание
- 2. Литература Основная литература: Фридрихсберг, Д.А.Курс коллоидной химии.— Электрон. дан. — СПб.:Лань, 2010. — 416 с. —
- 3. . Гельфман М.И.Коллоидная химия / М. И. Гельфман, О. В. Ковалевич, В. П. Юстратов. - Изд.
- 4. . Дополнительная литература: Ершов, Ю.А.Коллоидная химия. Физическая химия дисперсных систем. М.: Издат. группа "ГЕОТАР-Медиа", 2013. -
- 5. Коллоидные системы и предмет коллоидной химии Свойства коллоидных систем: Рассеивание света (опалесценция) (указывает на неоднородность, многофазность
- 6. Коллоидная химия – наука о поверхностных явлениях и дисперсных системах. К поверхностным явлениям относятся процессы, идущие
- 7. . Причиной поверхностных явлений является существование на границе раздела контактирующих фаз ненасыщенного поля межатомных, межмолекулярных сил,
- 8. . Поверхностные слои жидких и твердых тел, прилегающих к поверхности раздела фаз, резко отличаются по многим
- 9. . Наличие избыточной энергии в поверхностном слое молекул обусловлено неполной скомпенсированностью межмолекулярных сил притяжения у молекул
- 10. . Коллоидная химия изучает дисперсные системы (гетерогенные системы, состоящие из двух и более фаз): дисперсная фаза
- 11. . Коллоидные системы имеют два характерных признака: гетерогенность дисперсность
- 12. . Дисперсные частицы могут иметь самую различную форму: цилиндрическую сферическую прямоугольную неправильную
- 13. Количественные характеристики дисперсной системы Размер частиц dср , dmin , dmax. Концентрация частиц ν = nd
- 14. .
- 15. Классификация дисперсных систем 1. По размеру частиц дисперсной фазы : а) наносистемы (ультрадисперсные) d = 1
- 16. . 3. По концентрации частиц дисперсной фазы: а) малая б) большая 4. По характеру распределения фаз:
- 17. . 5. По взаимодействию между частицами дисперсной фазы (по кинетическим свойствам): а) свободно-дисперсные (малая концентрация дисперсной
- 18. . 6. По взаимодействию между частицами дисперсной фазы и дисперсионной средой: а) лиофильные – образуются путем
- 19. 7. По агрегатному состоянию фаз
- 20. Физическая химия поверхностных явлений Межмолекулярные связи Межмолекулярное взаимодействие может иметь различный характер: химические связи – образуются
- 21. . Йоханнес Дидерик Ван дер Ва́альс (1837 — 1923) Голландский физик, лауреат Нобелевской премии по физике
- 22. Отличия молекулярных сил притяжения от химических а) по величине энергии: Емол = 5 – 50 кДж/моль
- 23. Молекулярные силы притяжения включают в себя а) ориентационные силы ( силы Кеезома) Возникают между полярными молекулами
- 24. . Ке́езом Виллем Хендрик (Keesom) (1876—1876) Нидерландский физик. Фундаментальные труды по физике низких тем-ператур. Получил твёрдый
- 25. . б) индукционные силы (силы Дебая). Диполь у неполярной молекулы возникает в электрическом поле или под
- 26. . Пе́тер Йо́зеф Вильге́льм Деба́й (1884 —1966) Нидерландский физик и физикохимик, лауреат Нобелевской премии по химии
- 27. . в) дисперсионные силы (силы Лондона) Действуют между всеми молекулами. Возникают из-за непрерывного движения электронов в
- 28. . Фриц ЛОНДОН (1900 - 1954) Физик-теоретик. Работы посвящены спектроскопии, квантовой механике, физике низких температур, теории
- 29. Силы отталкивания Наряду с силами притяжения между молекулами возникают и силы отталкивания. Теоретических моделей, описывающих эти
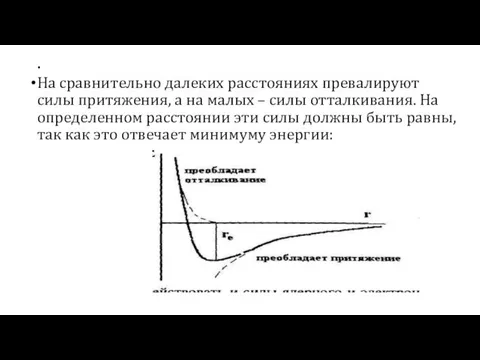
- 30. Суммарное выражение для описания сил межмолекулярного взаимодействия Уравнение Леннарда-Джонса:
- 31. . На сравнительно далеких расстояниях превалируют силы притяжения, а на малых – силы отталкивания. На определенном
- 32. Поверхностное натяжение Определения поверхностного натяжения I. Возьмем объект такой конфигурации, чтобы при его разрыве плоскостью скольжения
- 33. . На новой поверхности образуется слой молекул, обладающих большей энергией, чем молекулы внутри фазы. Коэффициент пропорциональности
- 34. . II. Поверхность раздела фаз обладает избытком нескомпенсированной энергии. Этот избыток в расчете на единицу поверхности
- 35. . при S, V, ni и q = const dU = σ ds Поверхностное натяжение –
- 36. . Так как объединенное уравнение может быть записано относительно других термодинамических потенциалов, то при соответствующих параметрах
- 37. . Для изобарно-изотермических условий можно встретить такое определение: Поверхностное натяжение (σ ) – это избыточная удельная
- 38. . III. Поверхностное натяжение помимо энергетического (термодинамического) и физического смыслов имеет и силовой (механический). Это может
- 39. . A D F На проволочной рамке помещается подвижная перекладина АD длиной L, легко скользящая по
- 40. . Приложим к подвижной перекладине АD направленную вниз силу F . Под действием силы F перекладина
- 41. . Если T=const, то работа затрачивается только на увеличение площади пленки: ds= 2 L dx dW
- 42. .
- 43. Причины возникновения поверхностного натяжения Выделим молекулу Б в объемной фазе и молекулу А в поверхностном слое.
- 44. . Силы сцепления, действующие со стороны окружающих молекул на молекулу Б, уравновешивают друг друга и их
- 45. . Притяжением со стороны молекул воздуха можно пренебречь и считать, что сила притяжения поверхностных молекул жидкости,
- 46. . Внутреннее давление жидкости – это сила притяжения между молекулами жидкости в ее объеме. Силы притяжения,
- 48. Скачать презентацию












































 Анализ результатов ОГЭ-2018 по обществознанию
Анализ результатов ОГЭ-2018 по обществознанию Презентация к Методике написания программы организации летнего отдыха в ОУ.
Презентация к Методике написания программы организации летнего отдыха в ОУ. Азотные удобрения
Азотные удобрения Результаты показателей мониторинга оценки качества
Результаты показателей мониторинга оценки качества Создание презентации
Создание презентации Современные аспекты и методы исследования осадочных пород
Современные аспекты и методы исследования осадочных пород Значение млекопитающих в природе и жизни человека
Значение млекопитающих в природе и жизни человека Как войти в личный кабинет, РАНХиГС
Как войти в личный кабинет, РАНХиГС Этические принципы Роберта Пиля, как основа полицейской службы
Этические принципы Роберта Пиля, как основа полицейской службы Маңғыстау ауданы Жармыш селосы МКҚК “Еркетай” балабақшасы ProPowerPoint.ru
Маңғыстау ауданы Жармыш селосы МКҚК “Еркетай” балабақшасы ProPowerPoint.ru Мастер-класс Техника акварель. Алтей
Мастер-класс Техника акварель. Алтей Криминалистика: общие положения. Лекция № 1
Криминалистика: общие положения. Лекция № 1 А. Куприн. Рождественский рассказ Чудесный доктор
А. Куприн. Рождественский рассказ Чудесный доктор ICT in Core Sectors of Development. ICT Standardization
ICT in Core Sectors of Development. ICT Standardization Констутиционный правовой статус Алтайского края
Констутиционный правовой статус Алтайского края Презентация Географическое положение Северной Америки
Презентация Географическое положение Северной Америки Качество и эффективность УР
Качество и эффективность УР Новогодние алкогольные фанты
Новогодние алкогольные фанты Презентация по теме Космос
Презентация по теме Космос Каламбур как средство выразительности
Каламбур как средство выразительности Sotsiaalpedagoogika eesmärgid koolis
Sotsiaalpedagoogika eesmärgid koolis тест русская равнина
тест русская равнина Презентация Праздник Белых журавлей
Презентация Праздник Белых журавлей Вещества и их свойства
Вещества и их свойства Использование инновационной аппаратуры для оказания психиатрической и наркологической помощи населению
Использование инновационной аппаратуры для оказания психиатрической и наркологической помощи населению Жиры и мыло
Жиры и мыло Mark Twain
Mark Twain Информационная безопасность и системы физической защиты критически важных объектов
Информационная безопасность и системы физической защиты критически важных объектов