Содержание
- 2. План Сущность метода Требования, предъявляемые к реакциям в комплексиметрии Классификация методов комплексиметрии Комплексонометрия Комплексоны Комплексы с
- 3. Требования, предъявляемые к реакциям Стехиометричность Полнота протекания реакции (β ≥ 108) Реакции комплексообразования должны протекать быстро
- 4. Классификация Меркуриметрия Фторометрия Цианометрия Комплексонометрия
- 5. Комплексоны Комплексон I, нитрилотриуксусная кислота (НТК) Комплексон II, этилендиаминотетрауксусная кислота дигидрат (ЭДТУК)
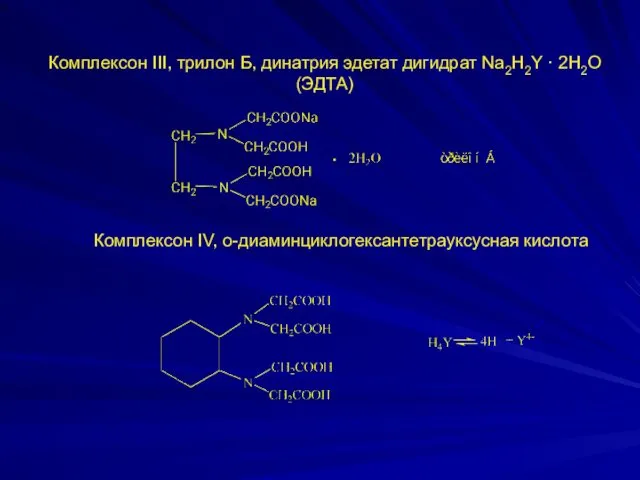
- 6. Комплексон III, трилон Б, динатрия эдетат дигидрат Na2H2Y · 2H2O (ЭДТА) Комплексон IV, о-диаминциклогексантетрауксусная кислота
- 7. ЭДТУК - слабая 4-х основная кислота H4Y ⮀ H+ + H3Y- рКа1 = 2,0 H3Y- ⮀
- 8. При рН 3 – 6 доминирующая форма Н2Y2- 6 – 10 - “ - HY3- >10
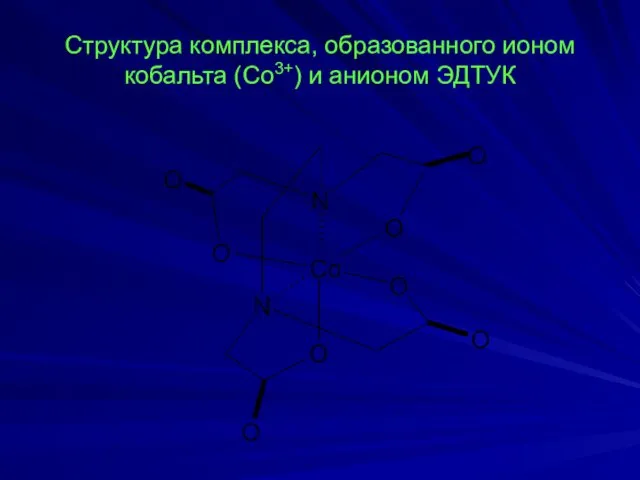
- 9. Структура комплекса, образованного ионом кобальта (Со3+) и анионом ЭДТУК
- 10. комплексы состава MY(n-4) В умеренно кислых растворах : Mn+ + H2Y2- ⮀ [MY](n-4) + 2 H+
- 11. Наиболее устойчивыми являются комплексы с ЭДТА: Bi3+ (lg β=27,9), Fe3+ (lg β=25,1), Cr3+ (lg β=23,0), т.е.
- 12. Первичные стандарты: металлический цинк, алюминий, магний, ZnSO4∙7H2O, MgSO4∙7H2O.
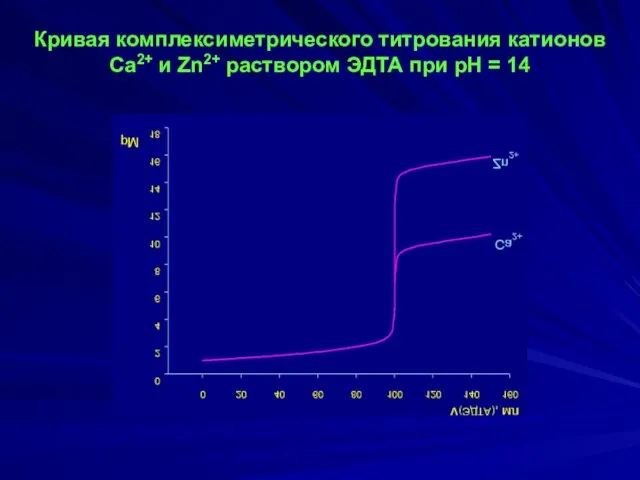
- 13. Кривая комплексиметрического титрования катионов Ca2+ и Zn2+ раствором ЭДТА при рН = 14
- 14. Принцип действия металлохромных индикаторов M2+ + H2Ind ⮀ [MInd] + 2 H+ цвет 1 цвет 2
- 15. β[МInd]
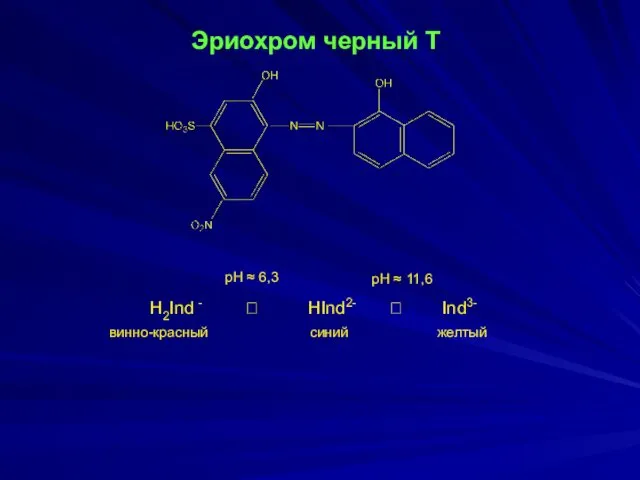
- 16. Эриохром черный Т H2Ind - ⮀ HInd2- ⮀ Ind3- pH ≈ 6,3 pH ≈ 11,6 винно-красный
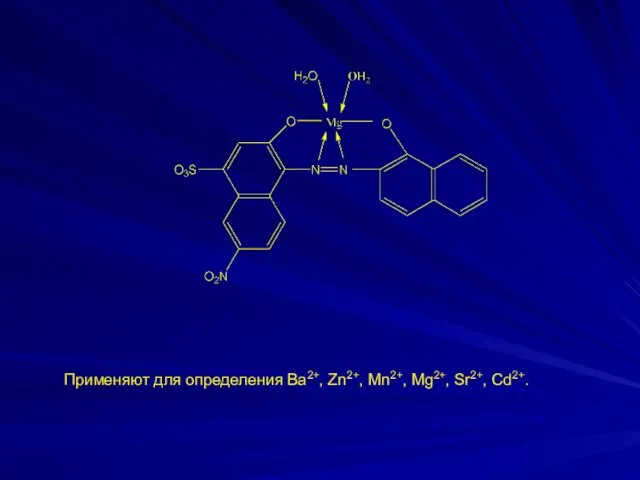
- 17. Применяют для определения Ва2+, Zn2+, Mn2+, Mg2+, Sr2+, Cd2+.
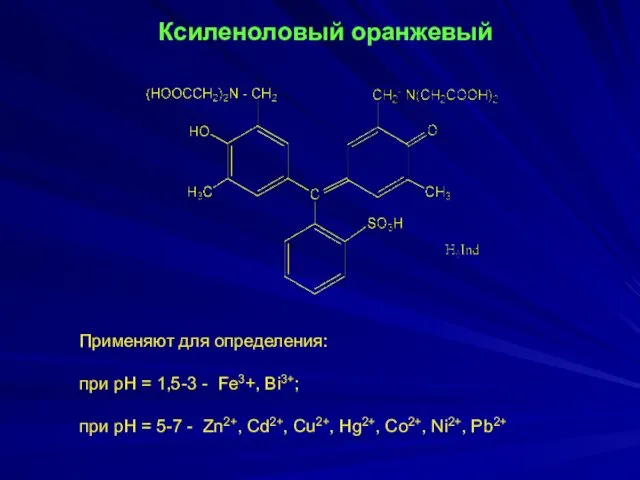
- 18. Ксиленоловый оранжевый Применяют для определения: при рН = 1,5-3 - Fe3+, Bi3+; при рН = 5-7
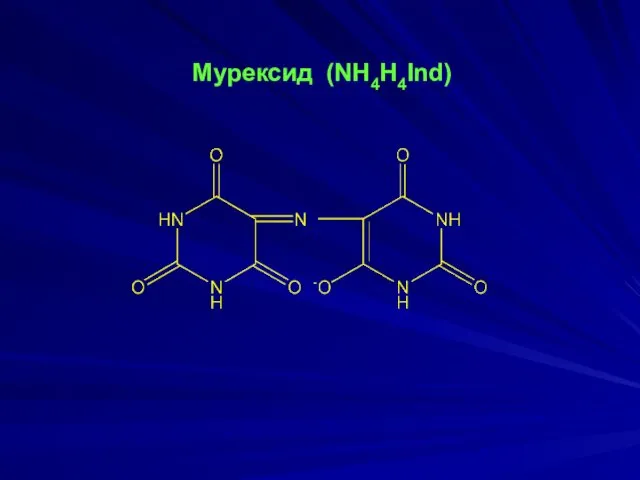
- 19. Мурексид (NH4H4Ind)
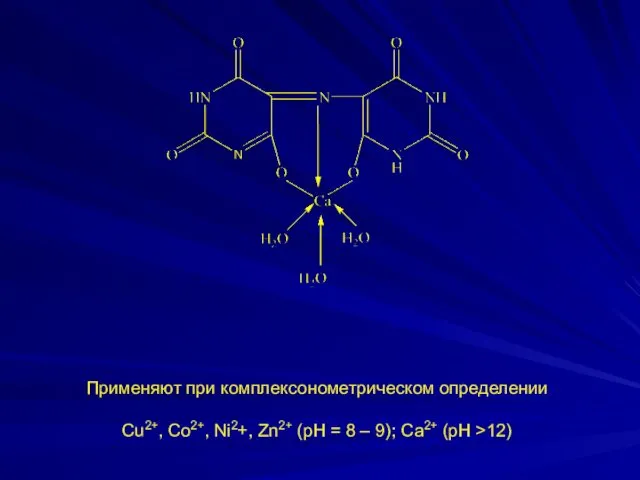
- 20. Применяют при комплексонометрическом определении Cu2+, Co2+, Ni2+, Zn2+ (рН = 8 – 9); Са2+ (рН >12)
- 21. Меркуриметрия Для определения анионов Cl -, Br -, I -, CN -, SCN -. а) Hg2+
- 23. Скачать презентацию









![Принцип действия металлохромных индикаторов M2+ + H2Ind ⮀ [MInd] +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/42358/slide-13.jpg)
![β[МInd]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/42358/slide-14.jpg)

 Презентация Химическая связь - металлическая,водородная, Ван-дер-Ваальсова
Презентация Химическая связь - металлическая,водородная, Ван-дер-Ваальсова Модель сетевого взаимодействия МОУ в образовательном округе
Модель сетевого взаимодействия МОУ в образовательном округе Отдел продаж Skoda. Итоги за март 2018 года
Отдел продаж Skoda. Итоги за март 2018 года Презентация. Трудности адаптации первоклассников в школе.
Презентация. Трудности адаптации первоклассников в школе. Каллиграфическая минутка на уроках русского языка в начальной школе
Каллиграфическая минутка на уроках русского языка в начальной школе Анализ национальной и конфессиональной политики в Архангельской области
Анализ национальной и конфессиональной политики в Архангельской области Химические свойства металлов
Химические свойства металлов ДБА ПроСтор для свиней
ДБА ПроСтор для свиней Type of holidays
Type of holidays Стратегии ценообразования
Стратегии ценообразования Формирование связной речи у дошкольников старшего возраста с ОНР.
Формирование связной речи у дошкольников старшего возраста с ОНР. Современные исследования о проблемах психического развития детей с нарушением интеллекта
Современные исследования о проблемах психического развития детей с нарушением интеллекта Презентация к 70-летию победы в ВО войне
Презентация к 70-летию победы в ВО войне Введение в историю первобытного общества
Введение в историю первобытного общества Четырёхгранный замысел бога для человека. Познание бога и непрекращающиеся отношения с ним
Четырёхгранный замысел бога для человека. Познание бога и непрекращающиеся отношения с ним Аталық жыныс мүшелері
Аталық жыныс мүшелері Активизация умственной деятельности и самостоятельности на уроках математики
Активизация умственной деятельности и самостоятельности на уроках математики Тренажер четырехпроводной схемы смены направления с защитой от подпитки проводов контроля свободности перегона
Тренажер четырехпроводной схемы смены направления с защитой от подпитки проводов контроля свободности перегона Введение в курс Общей биологии 10 класс. 3
Введение в курс Общей биологии 10 класс. 3 Активные формы работы с педагогами
Активные формы работы с педагогами CS 5220: computer communications. Evolution of Communication Networks
CS 5220: computer communications. Evolution of Communication Networks Тыныш болат сипаттамасы
Тыныш болат сипаттамасы ИНДИВИДУАЛЬНОЕ ЗАНЯТИЕ КЛАСС ГУО ТЕМА: ЗВУК [ Л ] ЭТАП : Постановка звука ( л)
ИНДИВИДУАЛЬНОЕ ЗАНЯТИЕ КЛАСС ГУО ТЕМА: ЗВУК [ Л ] ЭТАП : Постановка звука ( л) Досуг в честь Дня народного единства Растим патриотов России
Досуг в честь Дня народного единства Растим патриотов России Презентация по основам философии Тема: Философия Китая для студентов всех специальностей техникума
Презентация по основам философии Тема: Философия Китая для студентов всех специальностей техникума Родительское собрание в 1 классе:Первый раз в первый класс
Родительское собрание в 1 классе:Первый раз в первый класс Наименьшее общее кратное (2). 6 класс
Наименьшее общее кратное (2). 6 класс Проектная работа по теме Загрязнение поселка Бородинский твердыми бытовыми отходами
Проектная работа по теме Загрязнение поселка Бородинский твердыми бытовыми отходами