Содержание
- 2. Вопросами изменения энергии занимается термодинамика − наука, которая изучает следующие вопросы. Переходы энергии из одной формы
- 3. Химические реакции обычно сопровождаются выделением или поглощением энергии в различных формах: световая, электрическая, тепловая. Раздел термодинамики,
- 4. В термодинамике для изучения выделяют термодинамическую систему − совокупность тел, выделенную из окружающего пространства и являющуюся
- 5. Системы могут отличаться количеством фаз. Фаза – это часть системы, однородная во всех ее точках по
- 6. Одна и та же система может находиться в различных состояниях. Для характеристики состояния системы используются такие
- 7. Термодинамические функции – переменные величины, которые используются для характеристики состояния системы и тех изменений, которые в
- 8. Термодинамические функции зависящие от параметров системы- тепловые эффекты (Q) и работа, совершаемая системой (А), не являются
- 9. 2. Первый закон термодинамики. Первый закон термодинамики является формой выражения закона сохранения энергии и устанавливает количественное
- 10. Для изохорного процесса первый закон термодинамики запишется в виде Для изобарного процесса: Qp = ΔU +
- 11. 4. Тепловые эффекты химических реакций Тепловой эффект реакции − количество теплоты, которое выделяется или поглощается системой
- 12. Как и другие функции состояния, энтальпия зависит от количества вещества, поэтому ее величину (ΔН) обычно относят
- 13. 5. Термохимические уравнения Термохимические уравнения реакций − уравнения, в которых указан тепловой эффект, условия реакций и
- 14. Особенности термохимических уравнений. Тепловой эффект зависит от массы реагирующего вещества, поэтому его обычно рассчитывают на один
- 15. Тепловые эффекты зависят от агрегатного состояния реагентов и продуктов; оно указывается в термохимических уравнениях индексами: ж
- 16. 6. Закон Гесса и его следствия В основе термохимических расчетов лежит закон открытый российским ученым Гессом
- 17. С+О2 ΔН1 СО2 СО + ½О2 ΔН2 ΔН3 1. C(граф.) +O2 (г) = CO2 (г) ,
- 18. Как известно, тепловые эффекты образования СО2 (ΔН1) и горения СО (ΔН3) определяются экспериментально. Тепловой же эффект
- 19. В термохимических расчетах широко используют два следствия закона Гесса. 1. Тепловой эффект реакции равен сумме энтальпий
- 20. Так как абсолютную энтальпию вещества определить невозможно, то для измерений и расчетов необходимо определить начало отсчета,
- 21. Второе следствие закона Гесса относится к органическим веществам. Тепловой эффект реакции с участием органических веществ равен
- 22. Например, теплоту сгорания этанола C2H5OH(ж) + 3O2 = 2CO2 + 3H2O(г) можно рассчитать по уравнению: ΔH0х.р.
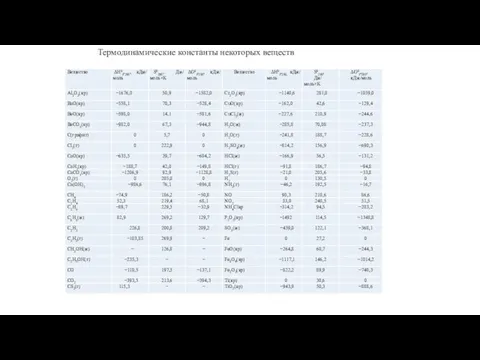
- 23. Термодинамические константы некоторых веществ
- 24. Значения теплот сгорания также приведены в справочниках. В технике для характеристики тепловых качеств отдельных видов топлива
- 25. 6. Энтальпии физико-химических процессов Все фазовые переходы первого рода сопровождаются выделением или поглощением энергии, например: Сграфит
- 26. Для химических реакций вообще возможны самые разнообразные величины ΔН: от отрицательных значений, составляющих несколько тысяч (для
- 28. Скачать презентацию
























 Теплоходи. Винайдення, історія та будуванння теплоходів
Теплоходи. Винайдення, історія та будуванння теплоходів Житие Сергия Радонежского
Житие Сергия Радонежского Презентация класса Диск
Презентация класса Диск С Днём Рождения !!!
С Днём Рождения !!! Архитектура микропроцессора
Архитектура микропроцессора Кому на Руси жить хорошо
Кому на Руси жить хорошо 25.05.2012г. Так прошел наш Последний звонок. Фотоматериалы.
25.05.2012г. Так прошел наш Последний звонок. Фотоматериалы. Что такое деньги, урок по экономике
Что такое деньги, урок по экономике Jcb loadall 550-80 vs mlt 845-120. Superior by design
Jcb loadall 550-80 vs mlt 845-120. Superior by design Сооружение опор выше обреза фундамента. Тема № 3
Сооружение опор выше обреза фундамента. Тема № 3 Автомобильная промышленость США
Автомобильная промышленость США Старческий психоз
Старческий психоз Кафедра маркетинга
Кафедра маркетинга Формирование моторных навыков письма и метод полного физического реагирования на уроках иностранного языка
Формирование моторных навыков письма и метод полного физического реагирования на уроках иностранного языка Стерилизация и дезинфекция. Современные системы экспрессконтроля стерилизации и дезинфекции
Стерилизация и дезинфекция. Современные системы экспрессконтроля стерилизации и дезинфекции альманах
альманах Технология обслуживания устройства плавного пуска ПВИ-250 МВПП
Технология обслуживания устройства плавного пуска ПВИ-250 МВПП Общеразвивающие упражнения
Общеразвивающие упражнения Leс_Массивы
Leс_Массивы Системы мониторинга переходных режимов
Системы мониторинга переходных режимов Климатические пояса земли
Климатические пояса земли Презентация по производственной практике. Рекламное предприятие ГК Хром Дизайн
Презентация по производственной практике. Рекламное предприятие ГК Хром Дизайн The east region of Kazakhstan
The east region of Kazakhstan Проект по специальности строительство и эксплуатация автомобильных дорог и аэродромов Дорога в облака
Проект по специальности строительство и эксплуатация автомобильных дорог и аэродромов Дорога в облака Загадки о животных
Загадки о животных Презентация Артикуляционная гимнастика. Свистящие звуки
Презентация Артикуляционная гимнастика. Свистящие звуки Города побратимы
Города побратимы Оборот земель сельскохозяйственного назначения
Оборот земель сельскохозяйственного назначения