Слайд 2

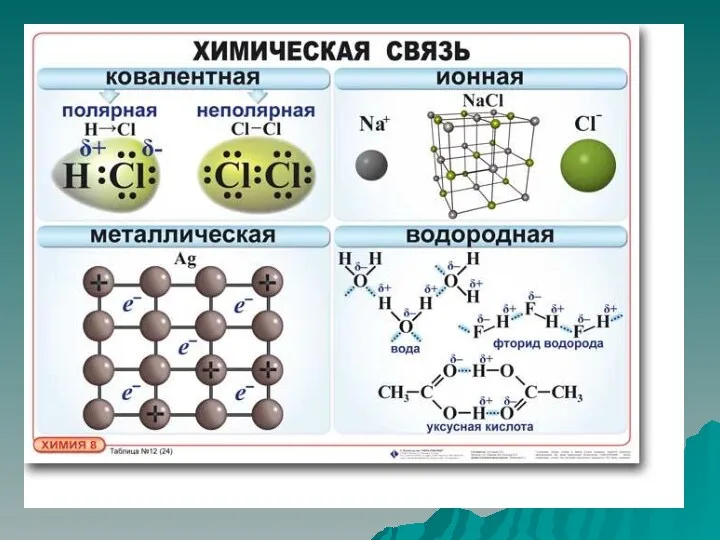
Химическая связь
– это вид взаимодействия, при котором происходит перераспределение электронов между
атомами.
Слайд 3
Слайд 4
Слайд 5

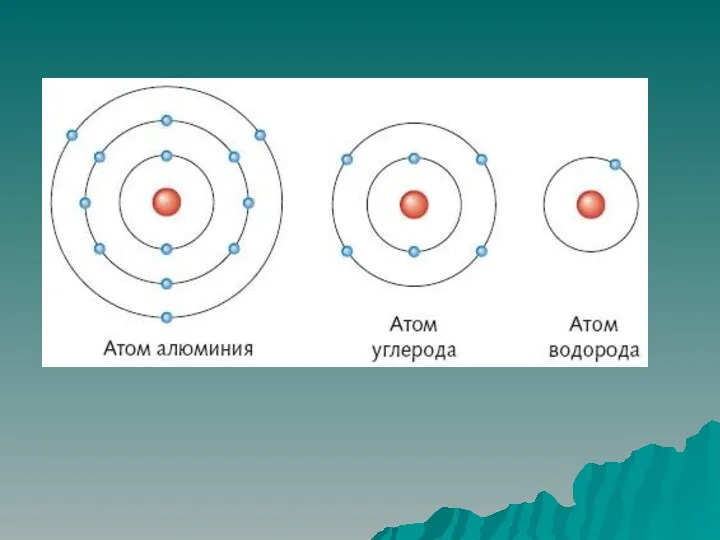
Если число электронов на внешнем уровне атома максимальное, то такой уровень
называется завершенным.
такие атомы не вступают в химической взаимодействие при обычных условиях. Это благородные элементы – 8 главная подгруппа.
Внешний уровень других атомов незавершенным. Они стремятся довести его до 8-электронного.
Электроны внешнего энергетического уровня являются валентными
При взаимодействии этих электронов образуется химическая связь.
В молекуле электроны становятся общими.
Слайд 6

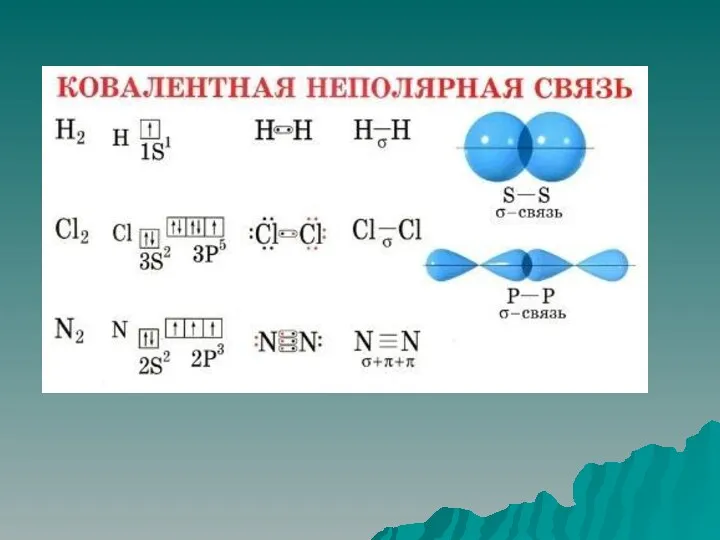
Ковалентная связь
Ковалентная связь – это тип химической связи между двумя атомами,
возникающий при обобществлении электронов, которые принадлежат этим атомам
Образуются общие электронные пары.
Слайд 7
Слайд 8

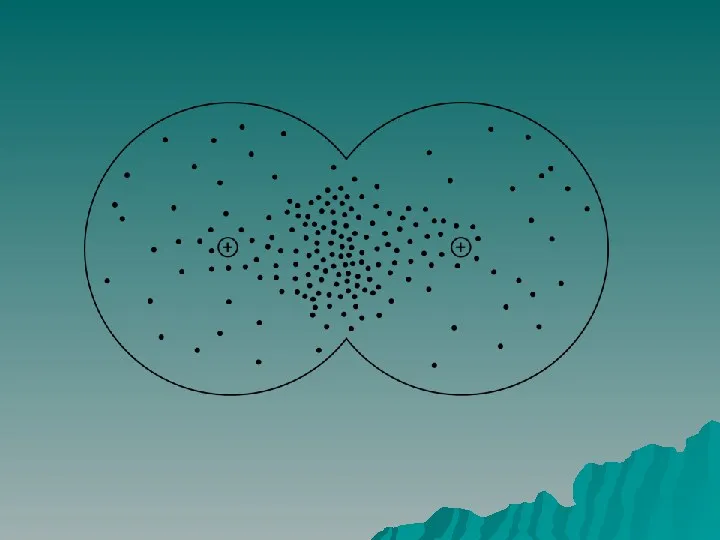
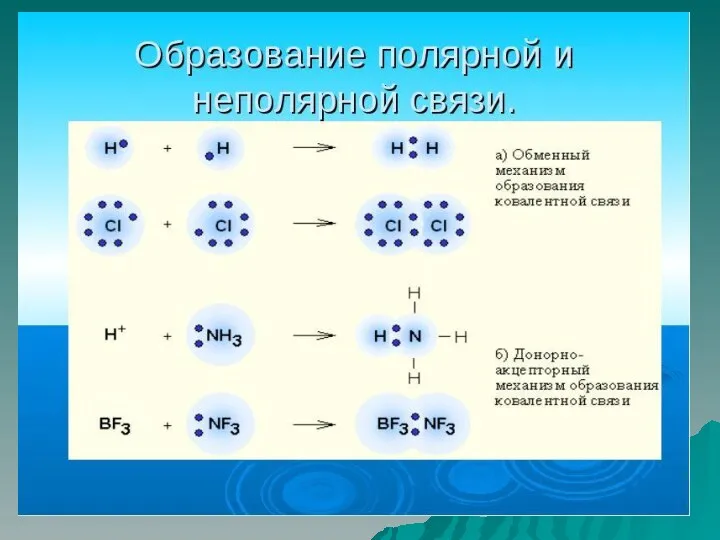
Метод валентных схем
Ковалентная вязь образуется между двумя атомами за счет перекрывания
одноэлектронных валентных облаков (обменный механизм) или перекрывания двухэлектронных валентных облаков и вакантных облаков (донорно-акцепторный механизм)
Слайд 9
Слайд 10

Слайд 11

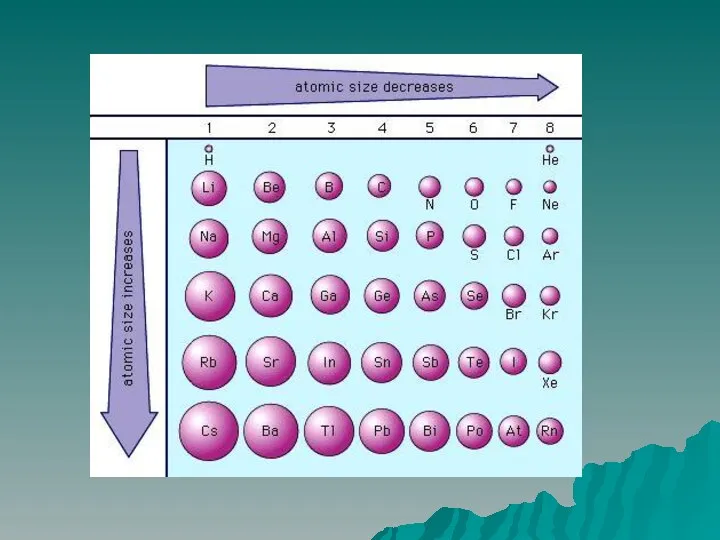
Характеристики ковалентной связи
Энергия связи – эта та энергия, которую необходимо затратить
для разрыва данной связи. Измеряется в кДж/моль
Зависит от радиуса перекрывающихся облаков.
Слайд 12
Слайд 13
Слайд 14

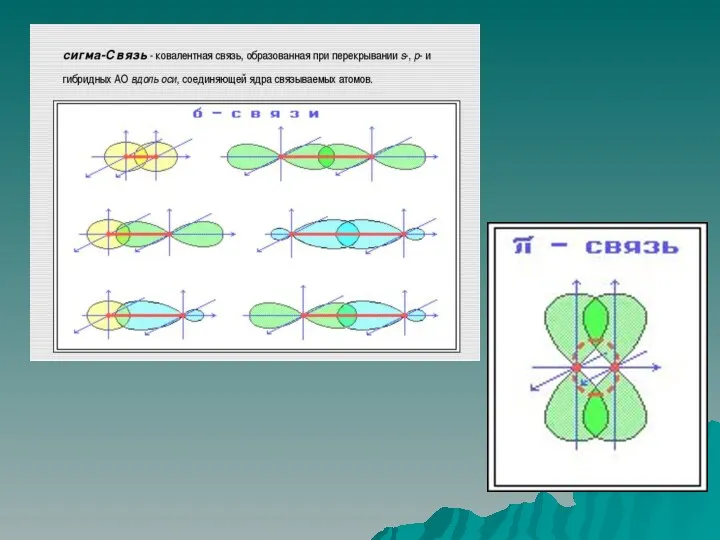
Способ перекрывания электронных облаков
σ - связь образуется при перекрывании вдоль линии,
соединяющей центры атомов. Более прочная.
π – связь образуется при боковом перекрывании в двух областях пространства. Между р-орбиталями
Слайд 15
Слайд 16

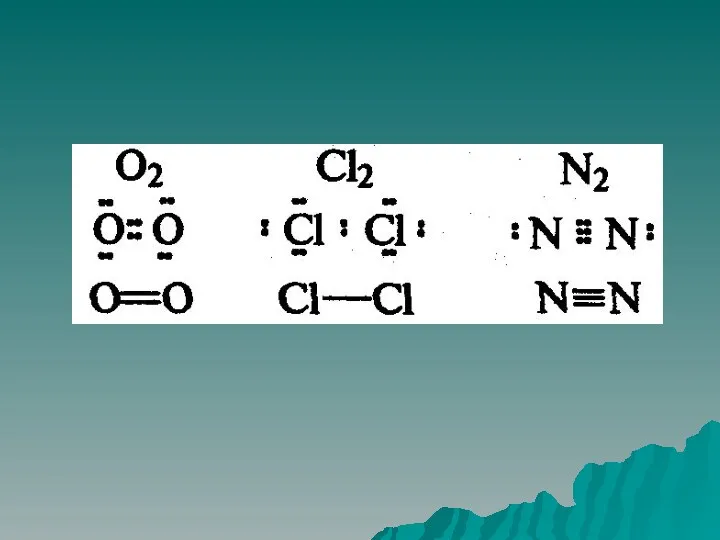
Кратность связи – число химических связей между двумя атомами
Ее можно показать
сплошной линией между атомами либо – точками –
Чем больше кратность связи, тем прочнее связь
Слайд 17
Слайд 18

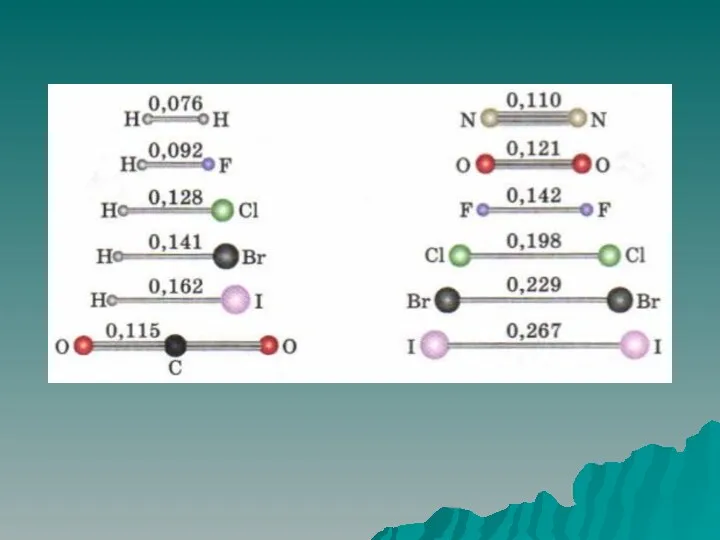
Длина связи – расстояние между ядрами атомов в молекуле.
зависит:
радиусов атома НF,
HCl, HBr, HJ
от кратности связи
Чем больше кратность связи и меньше радиус атомов, тем сильнее химическая связь, ее энергия.
Слайд 19
Слайд 20

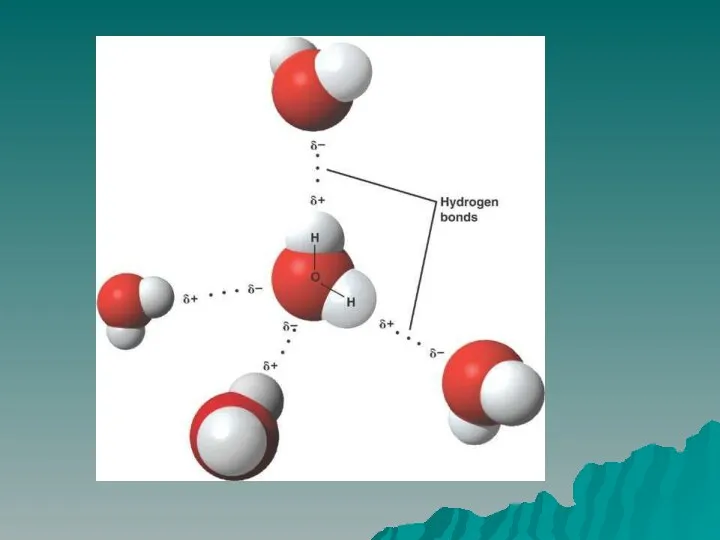
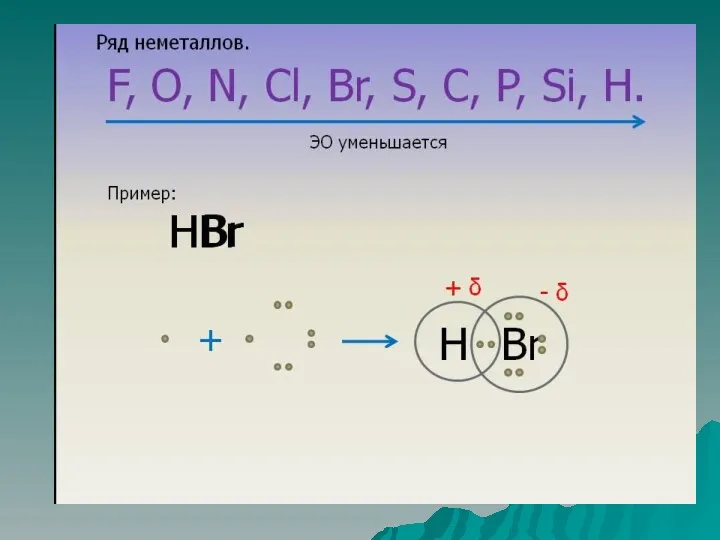
Полярность связи – смещение общей электронной плотность к более электроотрицательному атому.
В
зависимости от этого ковалентная связь делится на полярную и неполярную.
Слайд 21

Слайд 22
Слайд 23

Неполярная ковалентная связь –электронная плотность между атомами распределяется равномерно. К ней
относятся двухатомные молекулы, состоящие из одного элемента: кислород, азот, хлор и т.д.
Полярная ковалентная связь – электронное облако смещено к более электроотрицательному атому. Газы: HCl, H2O, NH3 и т.д.
Слайд 24
Слайд 25

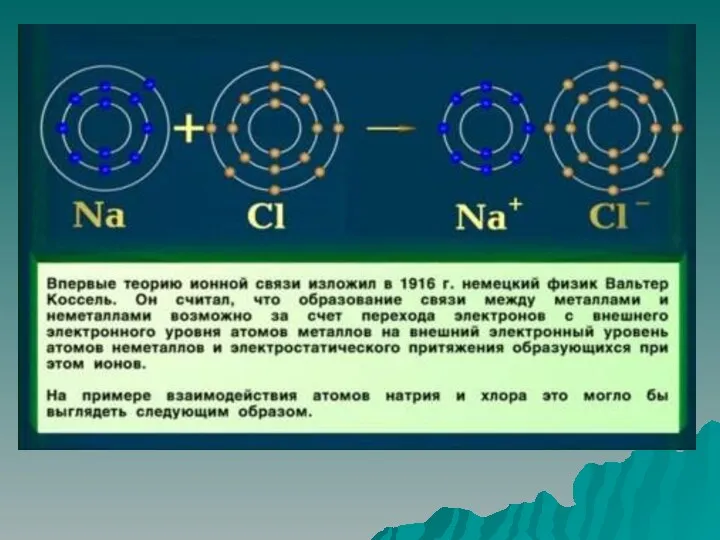
Степень окисления – это условный заряд, который приобретает элемент, исходя из
того, что связь чисто ионная
У элементов 1-3 группы в соединениях всегда положительная степень окисления.
У элементов 4-7 группы максимальная положительная степень окисления равна номеру группы, а промежуточные через единицу от максимальной.
Чем выше в группе находится элемент, тем характернее для него максимальная положительная степень окисления
У элементов 4-7 группы максимальная отрицательная степень окисления равна разности (8 - номеру группы), а промежуточные через единицу от максимальной.
S -2, 0, +2, +4, +6
Слайд 26
Слайд 27

Слайд 28
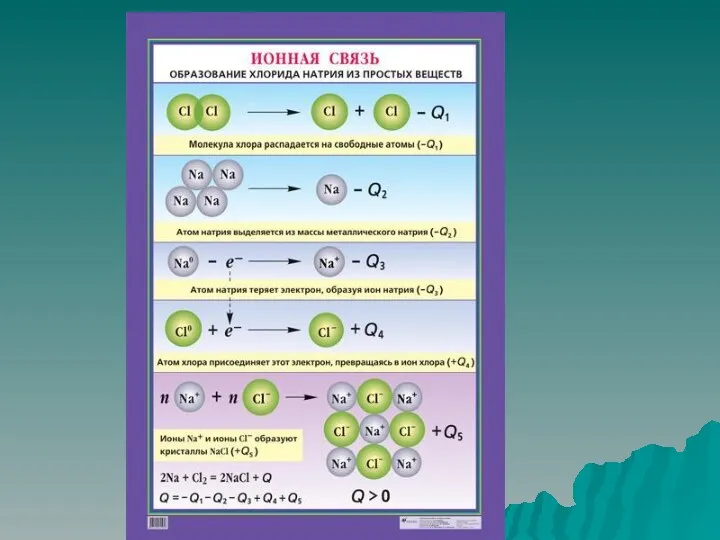
Слайд 29

Слайд 30
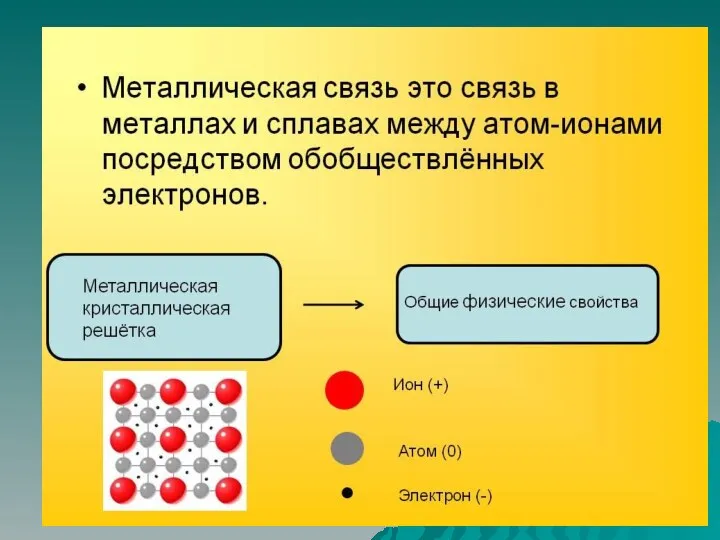
Слайд 31
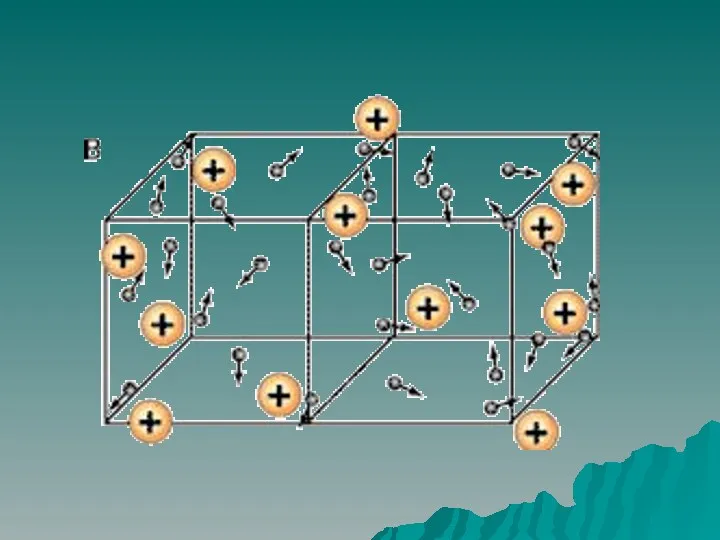






























 Гранулалар. Спансулалар. Дражелер. Кондитерлік дәрілік түрлері
Гранулалар. Спансулалар. Дражелер. Кондитерлік дәрілік түрлері Герои Отечества
Герои Отечества Сельское хозяйство: растениеводство и животноводство
Сельское хозяйство: растениеводство и животноводство развитие ребенка
развитие ребенка Исполнительная власть
Исполнительная власть Дом, в котором уютно всем
Дом, в котором уютно всем Гидроэнергетика. Гидравлическая энергия
Гидроэнергетика. Гидравлическая энергия Презентация Белки – основа органической жизни
Презентация Белки – основа органической жизни Проект Домашние любимцы
Проект Домашние любимцы Обучающая игра Нажми на мышку.
Обучающая игра Нажми на мышку. Сельскохозяйственный снабженческо-сбытовой потребительский кооператив Альянс фермервест. История создания и опыт работы
Сельскохозяйственный снабженческо-сбытовой потребительский кооператив Альянс фермервест. История создания и опыт работы Основные понятия и определения предмета защиты информации
Основные понятия и определения предмета защиты информации Монтаж квартальных сетей и вводов
Монтаж квартальных сетей и вводов Убранство избы. Работа с бумагой. Плетение. Изделие Коврик
Убранство избы. Работа с бумагой. Плетение. Изделие Коврик 900 дней и ночей
900 дней и ночей О компании General Motors
О компании General Motors Язвенная болезнь желудка
Язвенная болезнь желудка Проект Мой город - Москва
Проект Мой город - Москва Логистический канал и логистическая цепь
Логистический канал и логистическая цепь Влияние творческой деятельности на развитие воображения и творческого мышления младших школьников
Влияние творческой деятельности на развитие воображения и творческого мышления младших школьников Река и ее части
Река и ее части Культура Просвещения
Культура Просвещения Презентация к проекту (Алина)
Презентация к проекту (Алина) Договор на выполнение научно-исследовательских, опытно-конструкторских и технологических работ
Договор на выполнение научно-исследовательских, опытно-конструкторских и технологических работ Анемиялық, лейкемиялық, геморрагиялық синдромдар
Анемиялық, лейкемиялық, геморрагиялық синдромдар Ягодно-грибная поляна
Ягодно-грибная поляна Логопедическое занятие: Нахождение приставки в словах.
Логопедическое занятие: Нахождение приставки в словах. Монастырь. Монахи
Монастырь. Монахи