Содержание
- 2. Координационная теория, предложенная в 1893 году А. Вернером и дополненная Л.А.Чугаевым. Лев Александрович Чугаев (1873-1922) Альфред
- 3. Комплексные соединения – устойчивые хим. соединения сложного состава, в которых хотя бы одна связь, образована по
- 4. [Ag(NH3)2] внутренняя сфера внешняя сфера комплексообразователь лиганды Cl координационное число [Fe(CN)6] K3 комплексный катион комплексный анион
- 5. по составу: Основания [Ag(NH3)2]OH Кислоты Н[AuCl4] Соли Na2[Zn(OH)4] КЛАССИФИКАЦИЯ Неэлектролиты [Pt(NH3)2Cl2]
- 6. по виду лигандов: Амино- [Cu(NH3)4](OH)2 Аква- [Cr(H2O)6]Cl3 Гидроксо- Na2[Zn(OH)4]
- 7. по заряду внутренней сферы: Катионные [Ag(NH3)2]+OH Нейтральные [Pt(NH3)2Cl2]0 Анионные Na2[Zn(OH)4] -
- 8. Диссоциация комплексных соединений Первичная диссоциация – распад КС в растворе на ионы внешней и внутренней сфер
- 9. Вторичная диссоциация – распад внутренней сферы на составляющие ее компоненты. Процесс протекает по типу слабых электролитов,
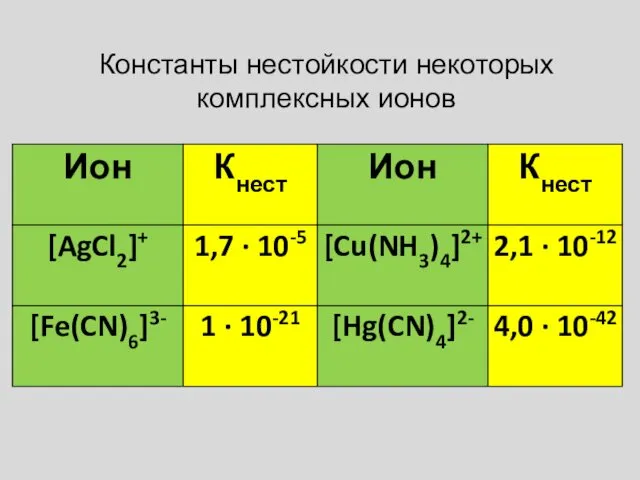
- 10. Устойчивость комплексных соединений Для качественной характеристики устойчивости КС используют: Константа нестойкости комплекса (Кнест) . Чем меньше
- 11. Константа устойчивости (Kуст) - величина, обратная Кнест . Чем больше значение Куст, тем более устойчиво КС
- 12. Константы нестойкости некоторых комплексных ионов
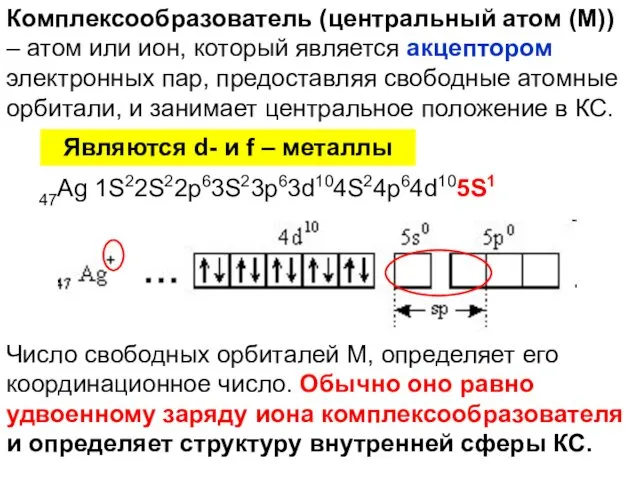
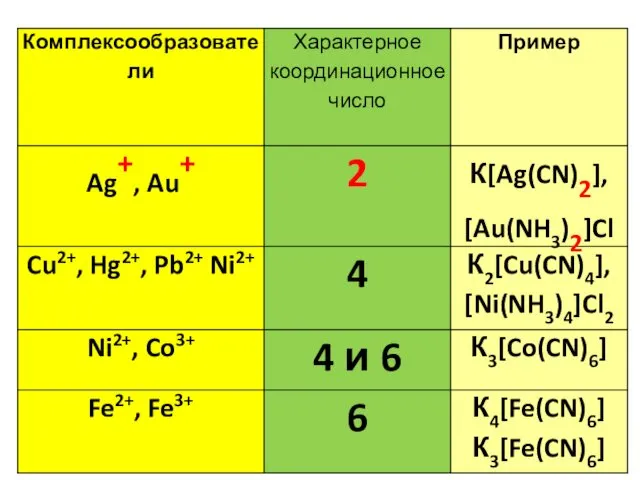
- 13. Комплексообразователь (центральный атом (М)) – атом или ион, который является акцептором электронных пар, предоставляя свободные атомные
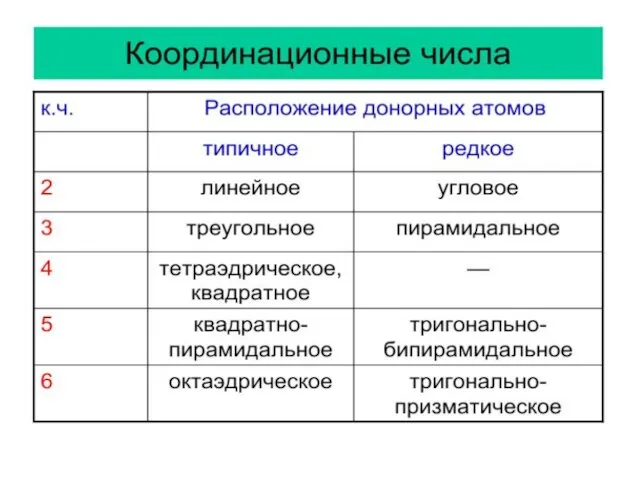
- 16. Лиганды (L) – молекулы или ионы, которые являются донорами электронных пар и связаны непосредственно с комплексообразователем.
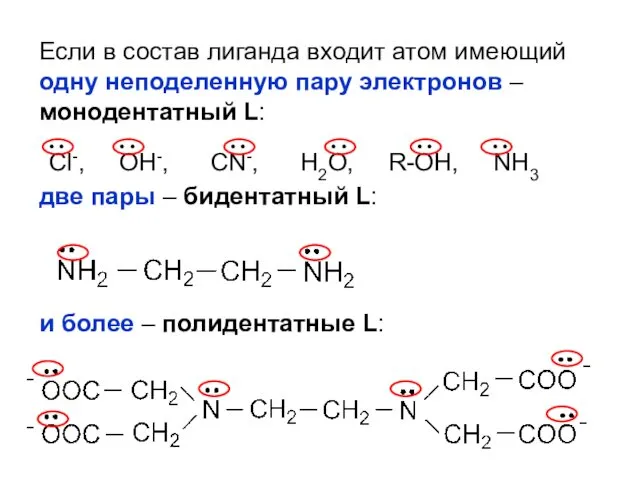
- 17. Если в состав лиганда входит атом имеющий одну неподеленную пару электронов – монодентатный L: две пары
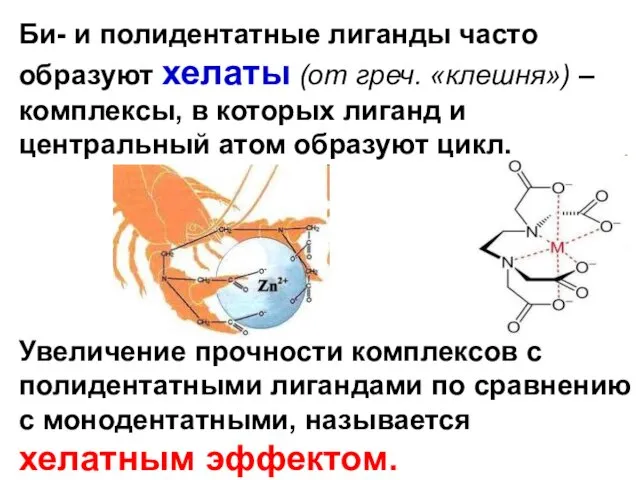
- 18. Би- и полидентатные лиганды часто образуют хелаты (от греч. «клешня») – комплексы, в которых лиганд и
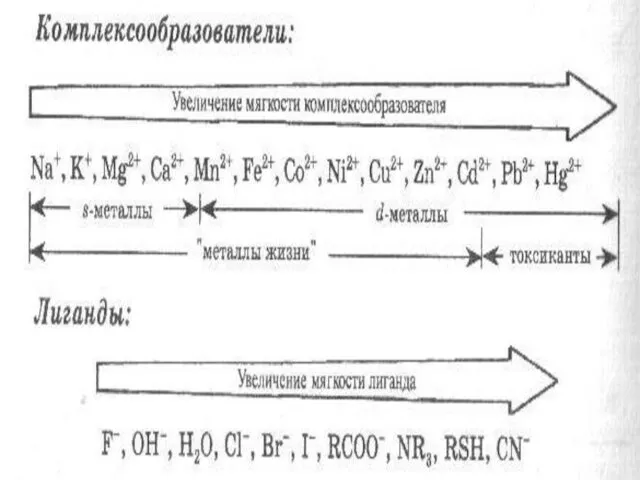
- 19. Эффективность донорно-акцепторного взаимодействия L и M (прочность связи) определяется их поляризуемостью. Чем меньше радиус и число
- 21. Наиболее прочная связь возникает между «мягкими» L и M. Белки содержат «мягкие» группы – -COO-, –NH2
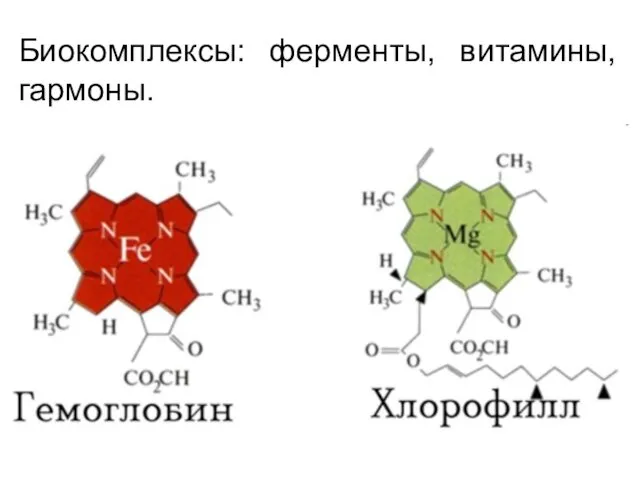
- 22. Биокомплексы: ферменты, витамины, гармоны.
- 23. Очень «мягкие»: Cd2+, Pb2+, Hg2+, сильно токсичны, т.к. образуют прочные комплексы с белком (особенно содержащие группу
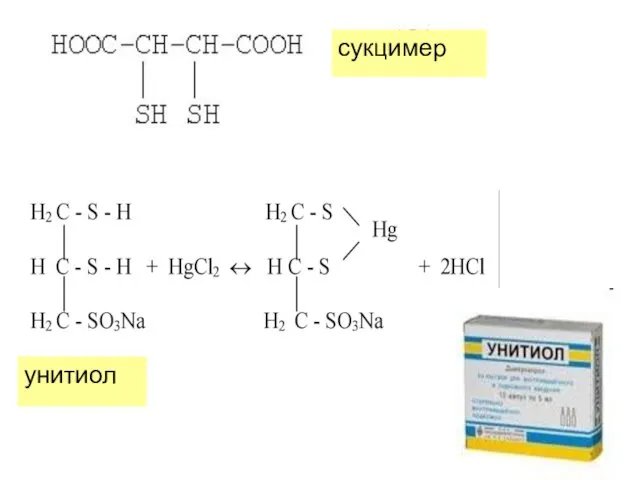
- 24. Детоксикацию организма от металлов токсикантов проводят при помощи лиганд-препаратов на основе полидентатных L – хелатотератия. Эффективными
- 25. унитиол
- 27. Скачать презентацию


![[Ag(NH3)2] внутренняя сфера внешняя сфера комплексообразователь лиганды Cl координационное число [Fe(CN)6] K3 комплексный катион комплексный анион](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43573/slide-3.jpg)
![по составу: Основания [Ag(NH3)2]OH Кислоты Н[AuCl4] Соли Na2[Zn(OH)4] КЛАССИФИКАЦИЯ Неэлектролиты [Pt(NH3)2Cl2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43573/slide-4.jpg)
2 Аква- [Cr(H2O)6]Cl3 Гидроксо- Na2[Zn(OH)4]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43573/slide-5.jpg)
![по заряду внутренней сферы: Катионные [Ag(NH3)2]+OH Нейтральные [Pt(NH3)2Cl2]0 Анионные Na2[Zn(OH)4] -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/43573/slide-6.jpg)









 Беҙҙә ҡышлаусы ҡоштар
Беҙҙә ҡышлаусы ҡоштар Операции над графами и их свойства
Операции над графами и их свойства Экстрагенитальная патология и беременность
Экстрагенитальная патология и беременность Белая снежинка мастер-класс
Белая снежинка мастер-класс Личное и групповое снаряжение. Снаряжение для водного туризма, экипировка туриста-водника
Личное и групповое снаряжение. Снаряжение для водного туризма, экипировка туриста-водника Тропинками родного края
Тропинками родного края Экологические проблемы
Экологические проблемы Презентация к классному часу Если добрый ты-это хорошо учителя начальных классов МКОУ СОШ №8с. Тахта Ипатовского района Ставропольского края Остренко Л. П.
Презентация к классному часу Если добрый ты-это хорошо учителя начальных классов МКОУ СОШ №8с. Тахта Ипатовского района Ставропольского края Остренко Л. П. Блокада Ленинграда: малые памятники.
Блокада Ленинграда: малые памятники. ВИКТОРИНА. ЖИВОТНЫЙ МИР
ВИКТОРИНА. ЖИВОТНЫЙ МИР Построение рабочих зон гидравлических экскаваторов. Практическое занятие 4
Построение рабочих зон гидравлических экскаваторов. Практическое занятие 4 Реки
Реки История политических учений
История политических учений Синдром нарушения (дефицита) внимания с гиперактивностью (СНВГ или СДВГ)
Синдром нарушения (дефицита) внимания с гиперактивностью (СНВГ или СДВГ) 20231109_my_bedroom
20231109_my_bedroom Балетмейстер
Балетмейстер Открытый урок Сложные эфиры. Жиры.
Открытый урок Сложные эфиры. Жиры. Презентация Настольный календарь
Презентация Настольный календарь Футболки с принтом “Jack in Prague”. Описание макета. Требования к макету
Футболки с принтом “Jack in Prague”. Описание макета. Требования к макету Психологический портрет подростка
Психологический портрет подростка Мелкая моторика
Мелкая моторика Автономнае пребывание человека в природной среде
Автономнае пребывание человека в природной среде Доктор Антон Павлович Чехов
Доктор Антон Павлович Чехов Нептун
Нептун Основные водоотведения
Основные водоотведения Киноафоризмы
Киноафоризмы Искусство Древнего Китая. Живопись
Искусство Древнего Китая. Живопись Виды устройств вывода информации. Лекция №20
Виды устройств вывода информации. Лекция №20