Содержание
- 2. Актуализация опорных знаний Какую тему начали изучать на прошлом уроке? В каком виде металлы встречаются в
- 3. « Металлы в природе. Способы получения металлов» Тема урока:
- 4. С развитием производства металлов и сплавов связано возникновение цивилизаций: Медный век Бронзовый век Железный век
- 5. Самые известные памятники Древнего мира египетские пирамиды – огромные каменные гробницы фараонов Каменные пирамиды являются творениями
- 6. Обратите внимание, медь – первый металл, который стали использовать для изготовления орудий труда и оружия.
- 7. Почему медь, а не железо? Железо более распространенный в природе металл, чем медь. Массовая доля железа
- 8. Минералы куприт и малахит содержат сульфидную медь(II) Напишите уравнение обжига минерала с целью перевода сульфида меди
- 9. Проверьте правильность составления уравнений реакций CuO + C = Cu + CO (1 балл) t 2CuS
- 10. Лабораторный опыт 1. Получение металлической меди восстановлением оксида меди(II) углем I). Лабораторный опыт проводится учениками предварительно,
- 11. Насыпаем в фарфоровую чашку черный порошок оксида меди(II) и активированный уголь Нагревание производим длительное время без
- 12. III). Укажите признаки протекающей реакции. Лабораторный опыт 1. Получение металлической меди восстановлением оксида меди(II) углем IV).
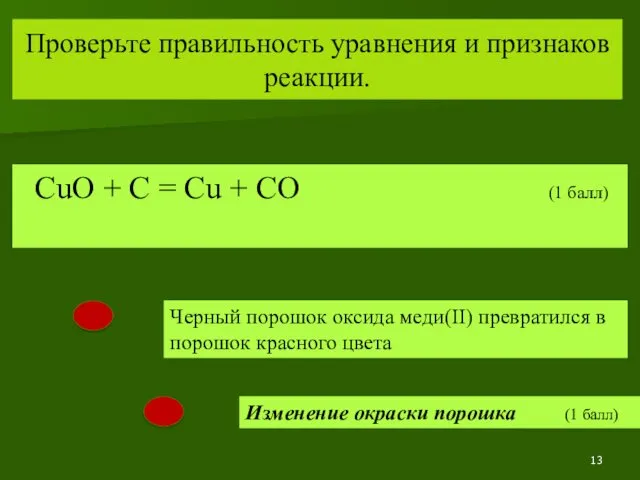
- 13. Проверьте правильность уравнения и признаков реакции. CuO + C = Cu + CO (1 балл) Черный
- 14. Этимология слова «металл»
- 15. Происхождение термина «металл» В начале XXVII века М. В. Ломоносов насчитывал семь металлов. (Au, Ag, Cu,
- 16. В природе металлы могут встречаться Только в свободном (самородном) виде (благородные металлы - Au золото, Pt
- 18. Нахождение железа в природе
- 19. Минералы и горные породы, содержащие металлы или их соединения и пригодные для промышленного получения металлов, называются
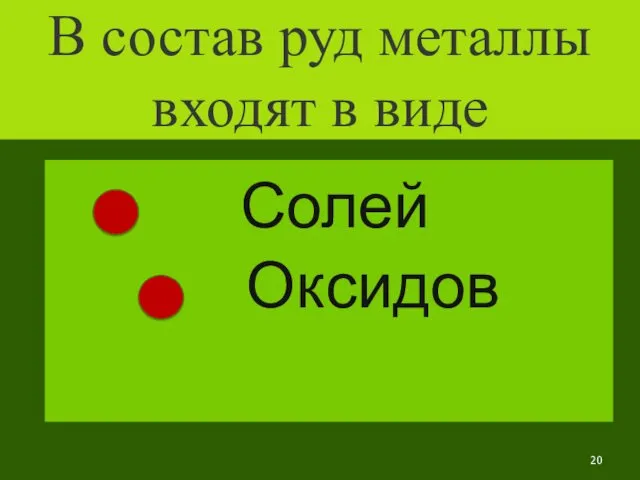
- 20. В состав руд металлы входят в виде Солей Оксидов
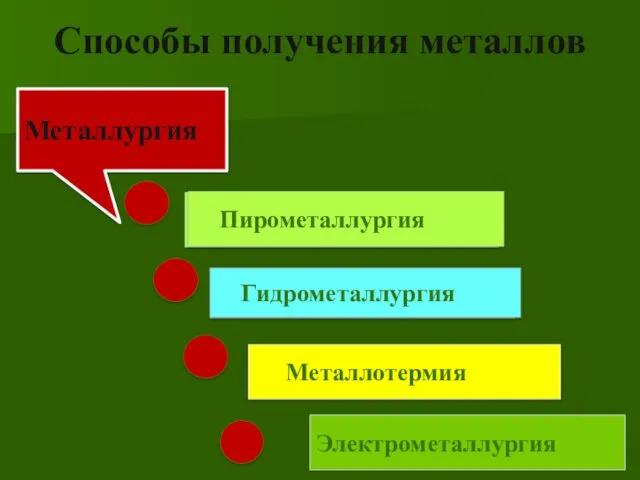
- 21. Способы получения металлов Электрометаллургия Электрометаллургия
- 22. В XIX веке русским учёным Н. Н. Бекетовым был научно обоснован и предложен пирометаллургический метод получения
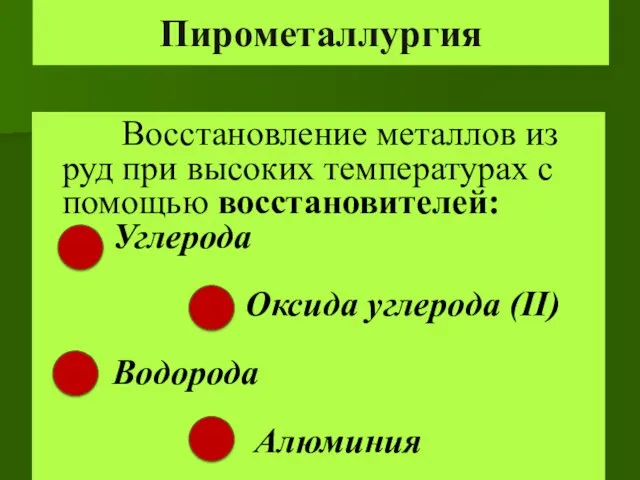
- 23. Пирометаллургия Восстановление металлов из руд при высоких температурах с помощью восстановителей: Углерода Оксида углерода (II) Водорода
- 24. Пирометаллургия Лабораторный опыт 1 « Получение металлической меди восстановлением оксида меди(II) углем» демонстрирует пирометаллургический способ получения
- 25. В 1863 году Н. Н. Бекетов составил «вытеснительный ряд», который является прототипом электрохимического ряда напряжений металлов.
- 26. Пирометаллургический способ 1 стадия: обжиг с целью перевода сульфидов в оксиды ZnS + O2 → ZnO
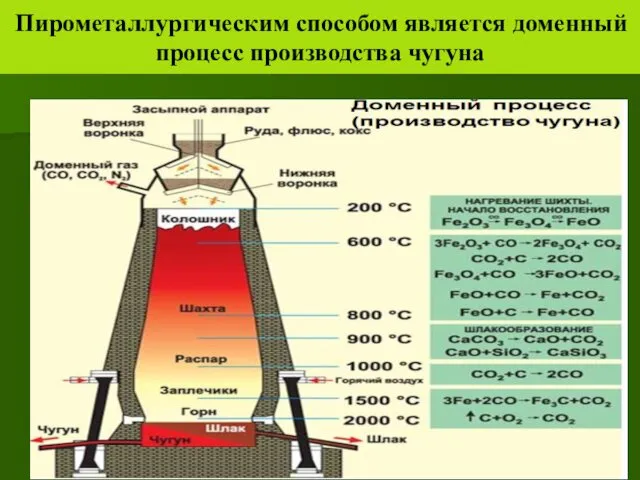
- 27. Пирометаллургическим способом является доменный процесс производства чугуна
- 28. Металлотермический способ Металлотермия- метод получения металлов, основанный на выделении металлов из оксидов более активными металлами Al,
- 29. Гидрометаллургический способ Гидрометаллургия- методы получения металлов, основанных на химических реакциях, происходящих в растворах: 1 стадия: перевод
- 30. Лабораторный опыт 2. Получение металлической меди гидрометаллургическим способом Вспомните главное правило ТБ при выполнении лабораторных опытов.
- 31. Проверьте правильность уравнений и признаков реакции. На железной пластине оседает красная металлическая медь. Раствор зеленеет. CuSO4
- 32. Электрометаллургический способ Электрометаллургия методы получения металлов, основанные на выделении металлов из растворов или расплавов их соединений
- 34. Скачать презентацию


























 Гламурнее не бывает
Гламурнее не бывает Уход за детьми с наследственными заболеваниями
Уход за детьми с наследственными заболеваниями Вкладки - методы изготовления
Вкладки - методы изготовления Учебно-методические комплексы для начальной школы
Учебно-методические комплексы для начальной школы Подготовка нефти. Обезвоживание нефти
Подготовка нефти. Обезвоживание нефти Организация мед помощи в ДДУ и школе
Организация мед помощи в ДДУ и школе Мемлекеттік басқару стилін жетілдіру. Лекция 10
Мемлекеттік басқару стилін жетілдіру. Лекция 10 Башкиры (самоназвание башкорт)
Башкиры (самоназвание башкорт) Электронное портфолио Савосиной Елены Леонидовны
Электронное портфолио Савосиной Елены Леонидовны Культура Киевской Руси
Культура Киевской Руси Автоматизация водопроводных и канализационных насосных станции
Автоматизация водопроводных и канализационных насосных станции Урок географии в 5 классе в рамках ФГОС От плоской Земли к земному шару.
Урок географии в 5 классе в рамках ФГОС От плоской Земли к земному шару. Моя любимая семья
Моя любимая семья Водный транспорт
Водный транспорт Теоретические и методические основы обучения (дидактика)
Теоретические и методические основы обучения (дидактика) В помощь молодому избирателю
В помощь молодому избирателю Сценарии возможных аварий с выбросом аммиака на объекте ОАО Молочный завод
Сценарии возможных аварий с выбросом аммиака на объекте ОАО Молочный завод Приборы безопасности. Системы обеспечения безопасности движения
Приборы безопасности. Системы обеспечения безопасности движения Текст Скворечник. Коррекционное образовательное учреждение
Текст Скворечник. Коррекционное образовательное учреждение Е. Благинина Кукушка и Котёнок
Е. Благинина Кукушка и Котёнок ТРИЗ в музыкальном воспитании
ТРИЗ в музыкальном воспитании Презентация: Знаете ли вы что...?
Презентация: Знаете ли вы что...? Samsung Ex-link
Samsung Ex-link Исследование темы История моей семьи
Исследование темы История моей семьи Ячеечная модель. (Тема 3)
Ячеечная модель. (Тема 3) Гипсовые пазогребнеевые плиты
Гипсовые пазогребнеевые плиты Scratch введение
Scratch введение Налоги и его сущность
Налоги и его сущность