Содержание
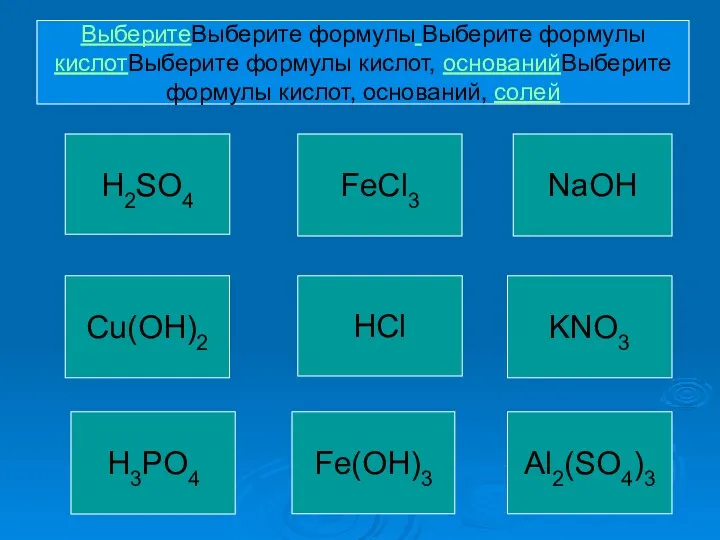
- 2. NaOH Al2(SO4)3 KNO3 HCl Cu(OH)2 H3PO4 FeCl3 Fe(OH)3 H2SO4 ВыберитеВыберите формулы Выберите формулы кислотВыберите формулы кислот,
- 3. Кислоты- это сложные вещества, состоящие из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
- 4. Основания- это сложные вещества, состоящие из атомов металлa и одной или нескольких гидроксогрупп M (OH) n
- 5. Соли- это сложные вещества, образованные атомами металла и кислотными остатками. M Kt n x -x +n
- 6. В трёх пробирках находятся раствор щёлочи, раствор кислоты и вода. Как опытным путём определить, в какой
- 7. Изменение цвета индикаторов
- 8. NaOH + HCL = NaCl + H2O
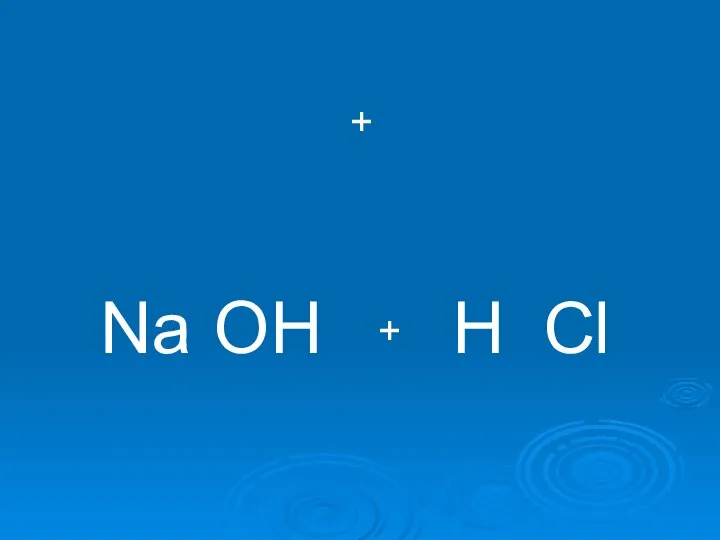
- 9. Na OH H Cl + +
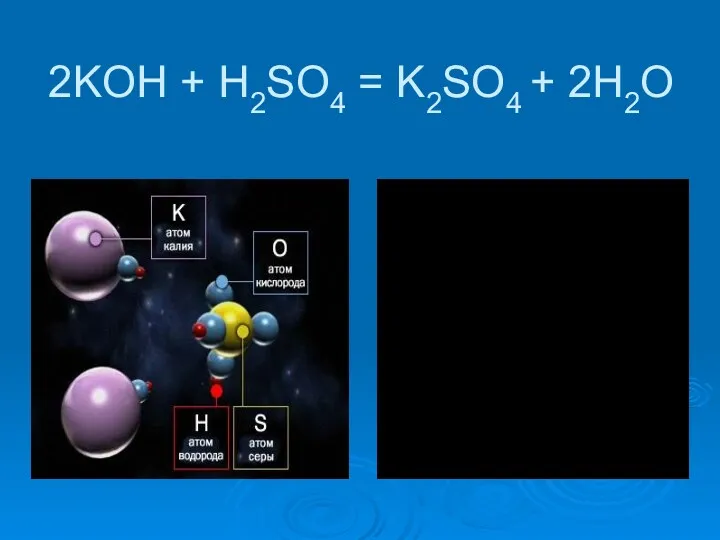
- 10. 2KOH + H2SO4 = K2SO4 + 2H2O
- 11. Растворимое основание кислота соль вода + + =
- 12. Лабораторная работа н/р основание кислота вода соль + = + Гидроксид меди (2) HCl Соляная кислота
- 13. Fe(OH)3 3HCl FeCl3 3H3O 2Fe(OH)3 3H2SO4 Fe2 (SO4)3 6H2O Гидроксид железа(3) Гидроксид железа(3) Соляная кислота Хлорид
- 14. кислота основание соль вода + = +
- 15. Самостоятельная работа Напишите уравнения реакций нейтрализации, с помощью которых можно получить: 1 вариант а) нитрат алюминия
- 17. Скачать презентацию









 Проект Умный дом
Проект Умный дом Космологический аргумент. Христианская апологетика
Космологический аргумент. Христианская апологетика Мультимедийная презентация к семинару Формирование лексико-грамматических категорий у дошкольников
Мультимедийная презентация к семинару Формирование лексико-грамматических категорий у дошкольников Antalis в мире и в России. Бумажная лавка в Москве и Санкт-Петербурге
Antalis в мире и в России. Бумажная лавка в Москве и Санкт-Петербурге Формирование микроклимата в помещении
Формирование микроклимата в помещении ЭРДУ аппарата Smart 1
ЭРДУ аппарата Smart 1 Презентация Выдающиеся спортсмены Саратовской области
Презентация Выдающиеся спортсмены Саратовской области Правописание суффиксов разных частей речи и личных окончаний глаголов. (ОГЭ. Задание 5)
Правописание суффиксов разных частей речи и личных окончаний глаголов. (ОГЭ. Задание 5) Інформаційні основи маркетингових рішень
Інформаційні основи маркетингових рішень Изучение и совершенствование техники волейбола. 5-11 класс
Изучение и совершенствование техники волейбола. 5-11 класс Общеучебные умения и навыки- необходимые условия успешного обучения
Общеучебные умения и навыки- необходимые условия успешного обучения Захист навколишнього середовища
Захист навколишнього середовища ЕГЭ 2018. Результаты ГИА выпускников, освоивших программу среднего общего образования по биологии
ЕГЭ 2018. Результаты ГИА выпускников, освоивших программу среднего общего образования по биологии Проценты и отношения. Решение задач
Проценты и отношения. Решение задач Информационные технологии и информационные системы. (Лекция 2)
Информационные технологии и информационные системы. (Лекция 2) Решение задач с помощью уравнений
Решение задач с помощью уравнений Основные виды помех средствам активной радиолокации
Основные виды помех средствам активной радиолокации Просвещенный абсолютизм. Союз государей с философами
Просвещенный абсолютизм. Союз государей с философами Плакат. Цілі і види плаката
Плакат. Цілі і види плаката Административное наказание
Административное наказание Школьный историко-краеведческий музей с. Среднее Погромное – хранитель славных страниц истории родного края
Школьный историко-краеведческий музей с. Среднее Погромное – хранитель славных страниц истории родного края Отдел Покрытосеменные. Общая характеристика и значение. 6 класс
Отдел Покрытосеменные. Общая характеристика и значение. 6 класс Магистральные трубопроводы
Магистральные трубопроводы Подготов к ГИА.
Подготов к ГИА. Конспект занятия по развитию мелкой моторики с использованием пескографии Sand-art и ИКТ во второй младшей группе. Тема: Помогите рыбкам
Конспект занятия по развитию мелкой моторики с использованием пескографии Sand-art и ИКТ во второй младшей группе. Тема: Помогите рыбкам Prezentatsia_VKR_BUrdin
Prezentatsia_VKR_BUrdin Скрининг–программа, ее содержание и роль в диагностике ранних отклонений в состоянии здоровья детей
Скрининг–программа, ее содержание и роль в диагностике ранних отклонений в состоянии здоровья детей Gianni Versace
Gianni Versace