Содержание
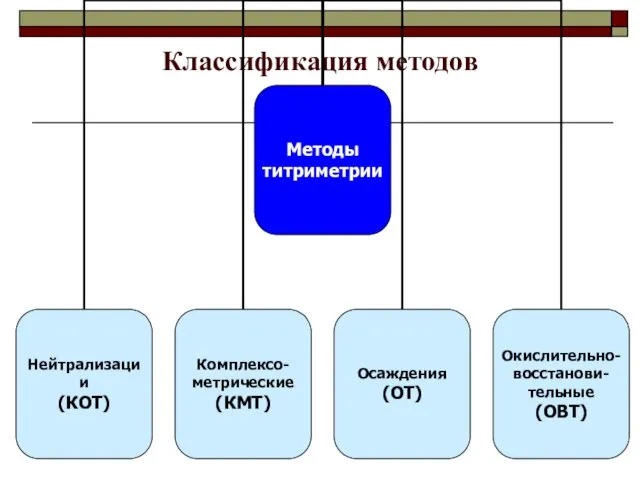
- 2. Классификация методов
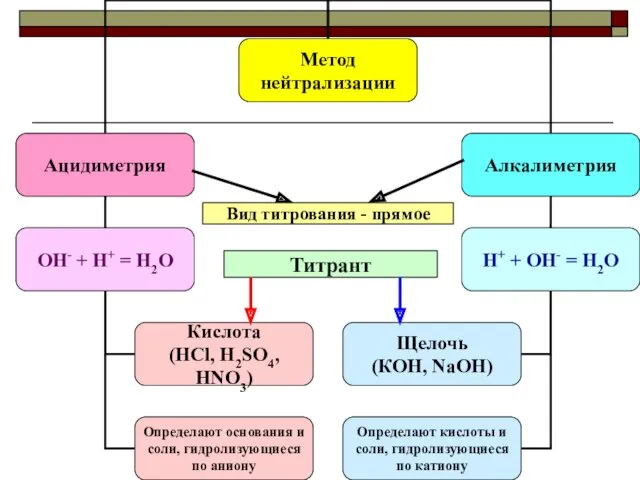
- 3. Методы кислотно-основного титрования (КОТ) В основе методов КОТ лежит реакция нейтрализации. Что это за реакция? КОТ
- 4. Протолитическая теория кислот и оснований
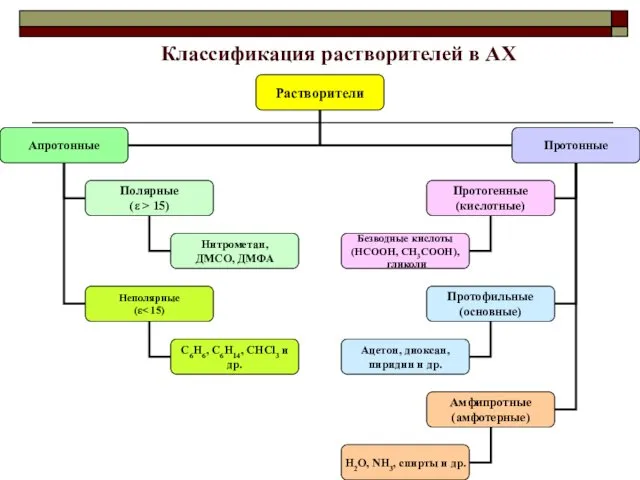
- 5. Классификация растворителей в АХ
- 7. Вид титрования - прямое Титрант
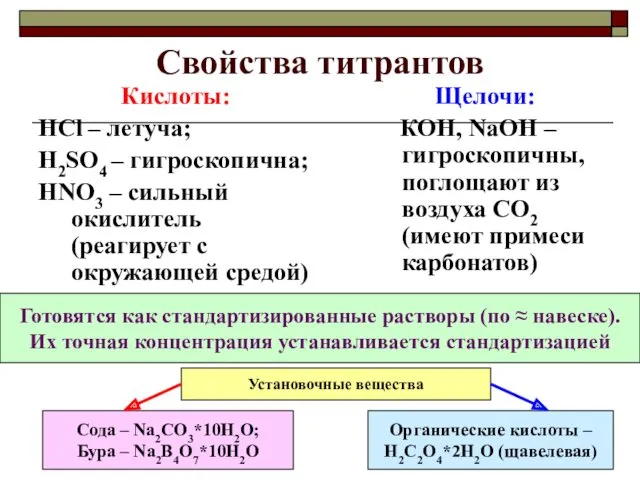
- 8. Свойства титрантов Кислоты: HCl – летуча; H2SO4 – гигроскопична; HNO3 – сильный окислитель (реагирует с окружающей
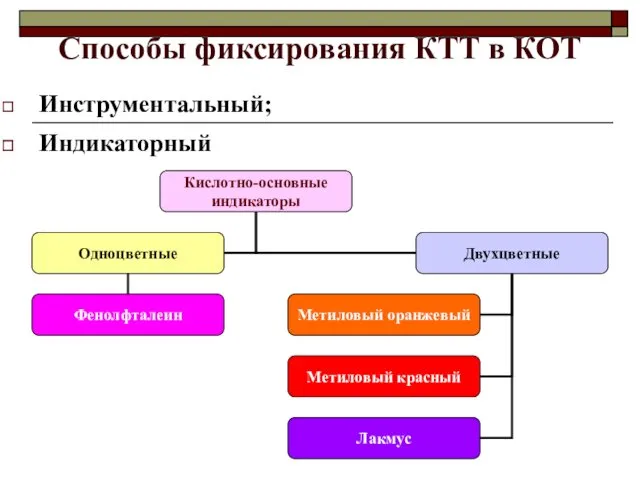
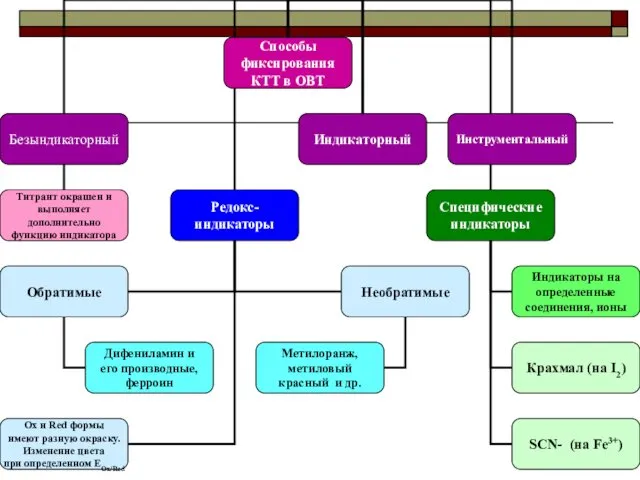
- 9. Способы фиксирования КТТ в КОТ Инструментальный; Индикаторный
- 10. Область перехода окраски индикатора в КОТ М/О рТ Ф/Н рТ >7,0 >7,0 =7,0 =7,0 3,1 –
- 11. Алгоритм выбора индикатора Определите рН среды раствора определяемого вещества Выберите титрант согласно найденного значения рН Напишите
- 12. Примеры работы с алгоритмом выбора индикатора 1. CH3COOH, pH 2. NaOH 3. CH3COOH + NaOH =
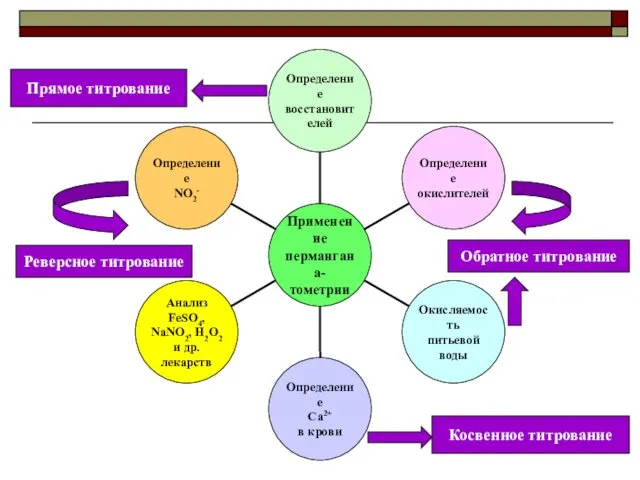
- 13. Применение КОТ Определение кислот Определение оснований Определение гидролизующихся солей Определение временной (карбонатной) жесткости воды Определение кислотности
- 14. КОМПЛЕКСОМЕТРИЯ (КМТ) В основе методов КМТ лежат реакции комплексообразования. Что это за реакции? Реакции комплексообразования должны
- 15. КОМПЛЕКСОНОМЕТРИЯ (КМТ) Метод комплексонометрического титрования – это разновидность комплексометрии. В основе комплексонометрии лежит реакция образования комплексных
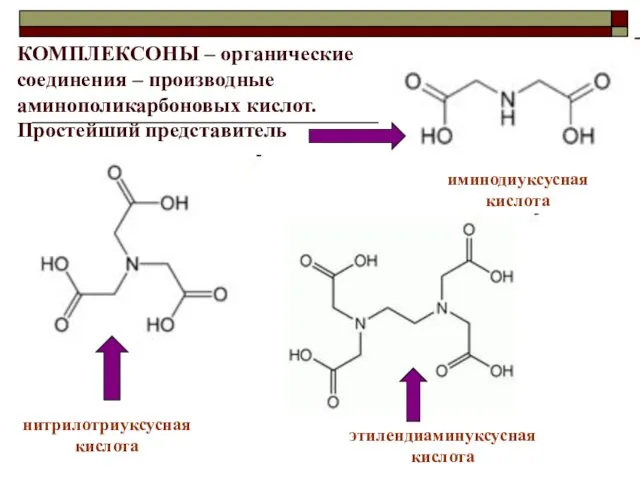
- 16. КОМПЛЕКСОНЫ – органические соединения – производные аминополикарбоновых кислот. Простейший представитель иминодиуксусная кислота нитрилотриуксусная кислота этилендиаминуксусная кислота
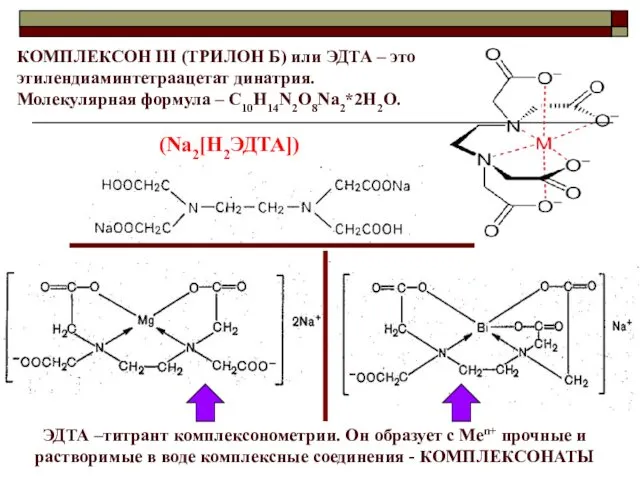
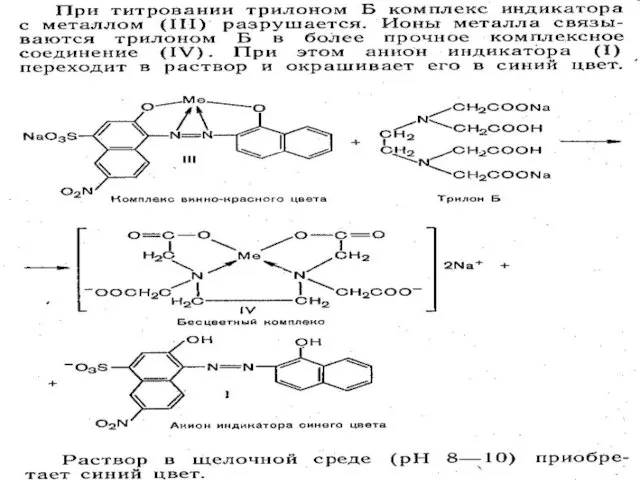
- 17. КОМПЛЕКСОН III (ТРИЛОН Б) или ЭДТА – это этилендиаминтетраацетат динатрия. Молекулярная формула – С10Н14N2O8Na2*2H2O. (Na2[H2ЭДТА]) ЭДТА
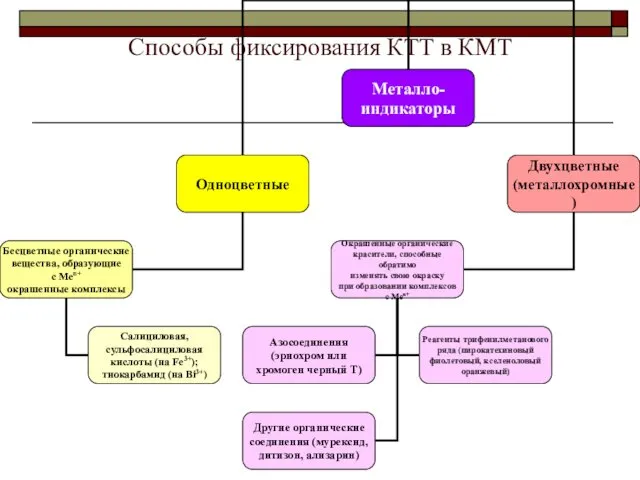
- 18. Способы фиксирования КТТ в КМТ
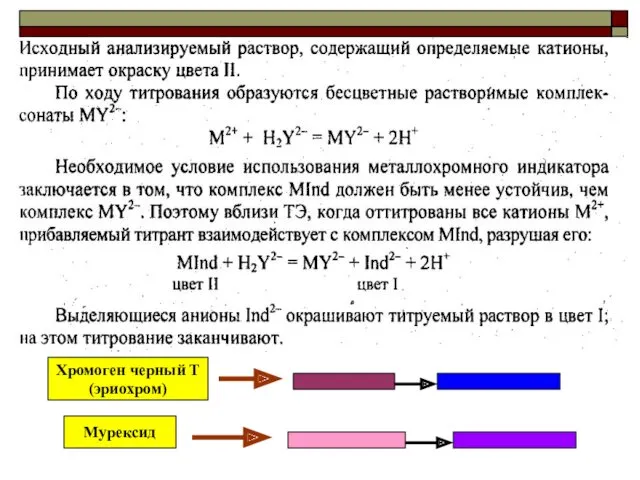
- 19. Принцип действия металлоиндикатора
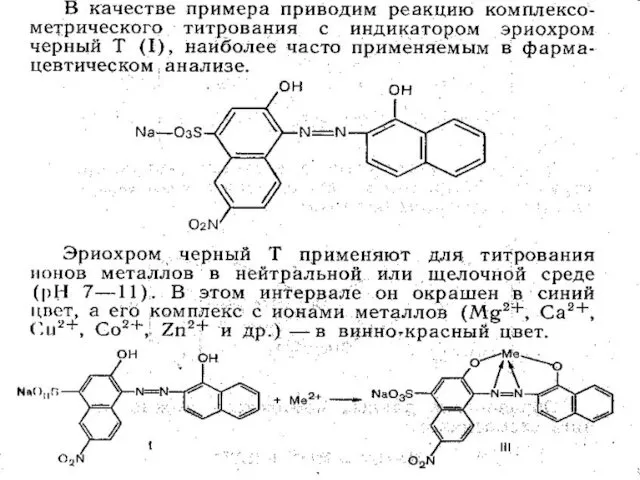
- 20. Хромоген черный Т (эриохром) Мурексид
- 23. Условия титрования КМТ Титрант ЭДТА Строго определенное значение рН среды, создаваемое добавлением буферных растворов Энергичное перемешивание
- 24. Приготовление титранта ЭДТА можно готовить как по точной (стандартный), так и по приблизительной навеске (стандартизированный). Точную
- 25. Применение комплексонометрии Определение общей жесткости воды, осадков Определение содержания Са2+ и Mg2+ в почве Определение многих
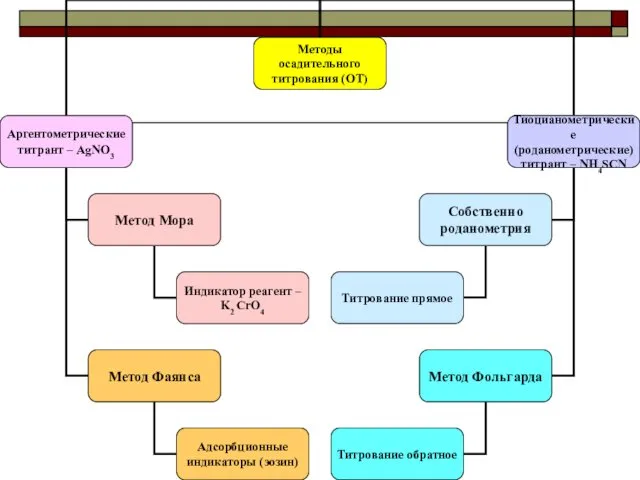
- 26. ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ (ОТ) В основе методов ОТ лежат реакции осаждения. Что это за реакции? Требования к
- 28. Принцип действия индикаторов - реагентов Метод МОРА – K2CrO4
- 29. Принцип действия индикаторов - реагентов Роданометрические методы – железоаммонийные квасцы NH4Fe(SO4)2*12H2O
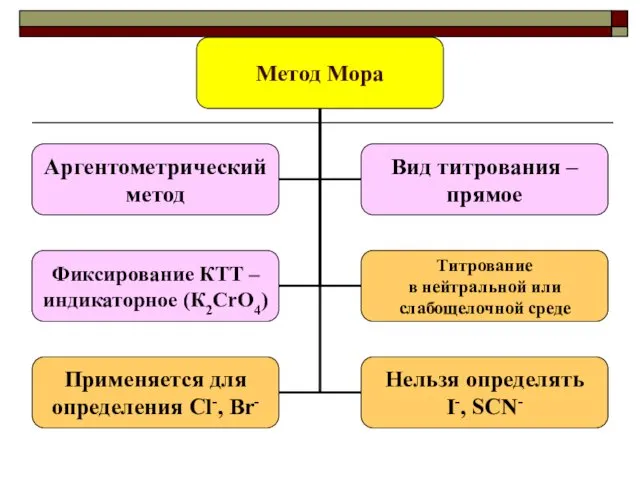
- 31. Метод Мора Условия титрования: Нейтральная, слабощелочная среда (рН 6,5-10,3) Отсутствие катионов, дающих цветные осадки с индикатором
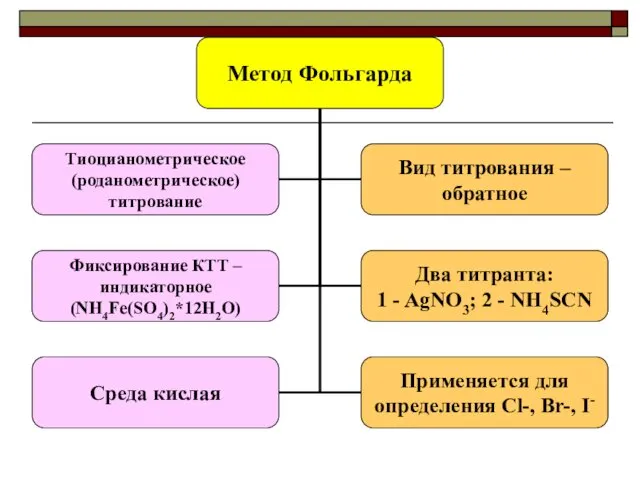
- 33. Метод Фольгарда Титрант метода - NH4SCN готовится как вторичный стандарт. Почему? Как? Точная его концентрация устанавливается
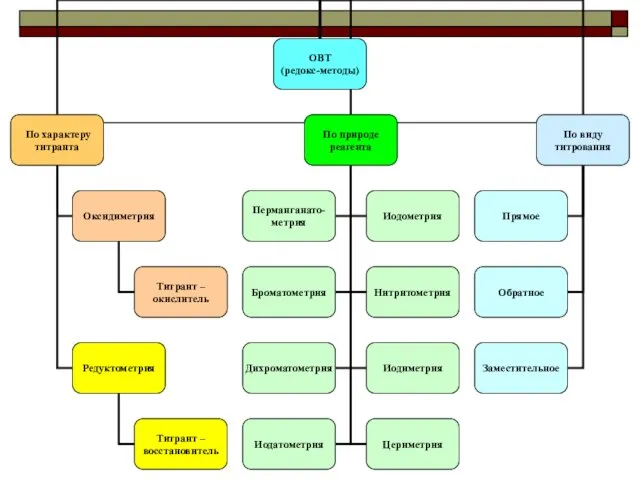
- 34. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ (ОВТ) В основе методов ОВТ лежат окислительно-восстановительные реакции. Что это за реакции?
- 35. Реакция, применяемая в методах ОВТ должна: Протекать строго по уравнению без побочных процессов Протекать практически до
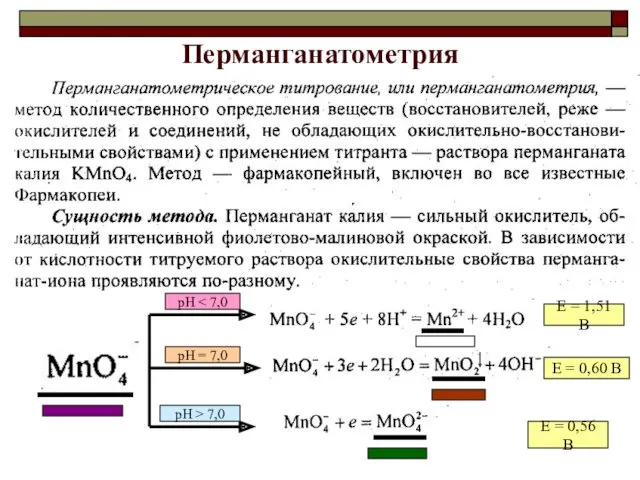
- 38. Перманганатометрия рН рН = 7,0 рН > 7,0 Е = 1,51 В Е = 0,60 В
- 39. рН
- 40. 4. Перманганатометрия – автокаталитическая реакция, катализатором которой является Mn2+ Каплю нужно вычитать?
- 41. KMnO4 готовится как вторичный стандарт (по какой навеске?) за 7-10 дней до начала работы с ним.
- 42. Обратное титрование Прямое титрование Реверсное титрование Косвенное титрование
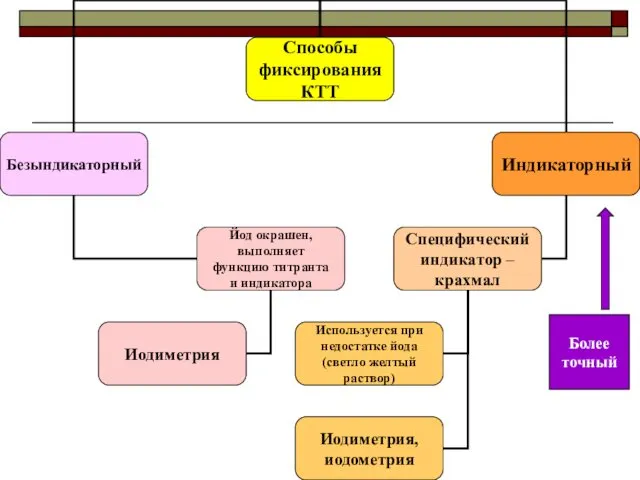
- 43. Иодометрия, иодиметрия I2 + 2e = 2I- Иодиметрия (прямое титрование) 2I- − 2e = I2↓ Иодометрия
- 44. Более точный
- 50. Скачать презентацию




























 Министерство Здравоохранения Российской Федерации
Министерство Здравоохранения Российской Федерации Жемчужное ожерелье Санкт-петербурга
Жемчужное ожерелье Санкт-петербурга Домашняя аптечка
Домашняя аптечка Современная деревянная архитектура и традиции
Современная деревянная архитектура и традиции Презентация к классному часу Чечня- от истоков до наших дней
Презентация к классному часу Чечня- от истоков до наших дней Транспорт полезного ископаемого в условиях проектируемого карьера
Транспорт полезного ископаемого в условиях проектируемого карьера Экологические зарисовки
Экологические зарисовки Несамоходные суда при буксировке и на стоянке
Несамоходные суда при буксировке и на стоянке Московское княжество в XV веке. Свержение ордынского ига. Образование нового единого русского государства
Московское княжество в XV веке. Свержение ордынского ига. Образование нового единого русского государства acidi
acidi Загальні поняття про радіоперешкоди. Огляд методів захисту від перешкод. (Тема 6.1)
Загальні поняття про радіоперешкоди. Огляд методів захисту від перешкод. (Тема 6.1) Пожарная безопасность - проверочные листы для СНТ
Пожарная безопасность - проверочные листы для СНТ Николай Рерих и наше время
Николай Рерих и наше время Горизонтальне і вертикальне планування вулиць і майданів
Горизонтальне і вертикальне планування вулиць і майданів Точки разрыва функции и их классификация
Точки разрыва функции и их классификация Презентация. Коррозия (9 класс)
Презентация. Коррозия (9 класс) Схема запуска дизеля тепловоза 2М62
Схема запуска дизеля тепловоза 2М62 Устройство компьютера. Системный блок
Устройство компьютера. Системный блок Cement production process
Cement production process Аминокислоты
Аминокислоты Нормативно-правовое обеспечение разработки программы развития образовательной организации
Нормативно-правовое обеспечение разработки программы развития образовательной организации Мусульманство в России
Мусульманство в России День матери
День матери Презентация родительского собрания Семья -это радость
Презентация родительского собрания Семья -это радость Создание цветников в регулярном стиле на территории Сочинского института (филиала) РУДН
Создание цветников в регулярном стиле на территории Сочинского института (филиала) РУДН Операционные усилители
Операционные усилители Педагогика танца в становлении растущей личности: история и современность
Педагогика танца в становлении растущей личности: история и современность Способы активизации познавательной деятельности учащихся на уроках черчения
Способы активизации познавательной деятельности учащихся на уроках черчения