Содержание
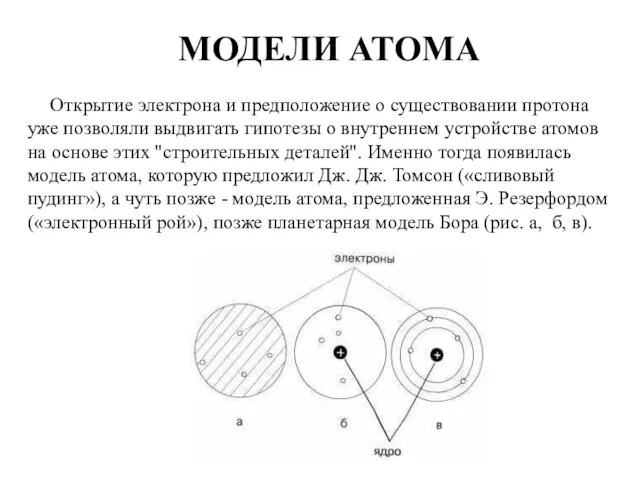
- 2. МОДЕЛИ АТОМА Открытие электрона и предположение о существовании протона уже позволяли выдвигать гипотезы о внутреннем устройстве
- 3. Модель Томсона «Пудинг с изюмом», «сливовый пудинг» В 1904 году Томсон представил свою модель атома. Она
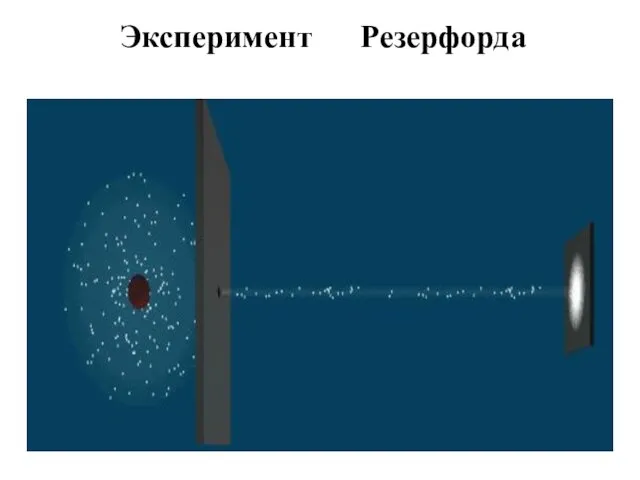
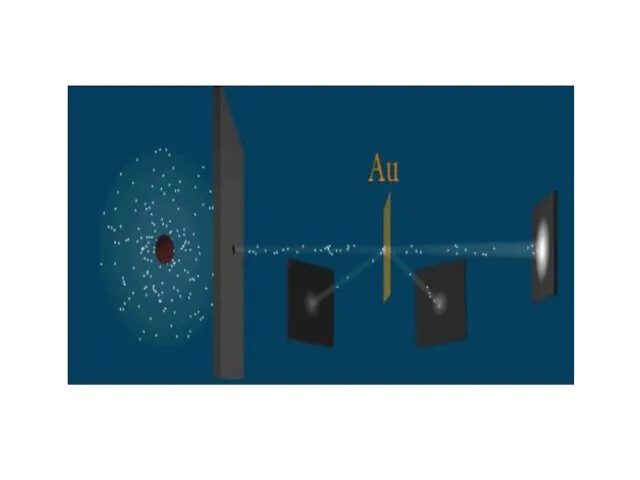
- 4. Схема опыта Резерфорда
- 5. Эксперимент Резерфорда
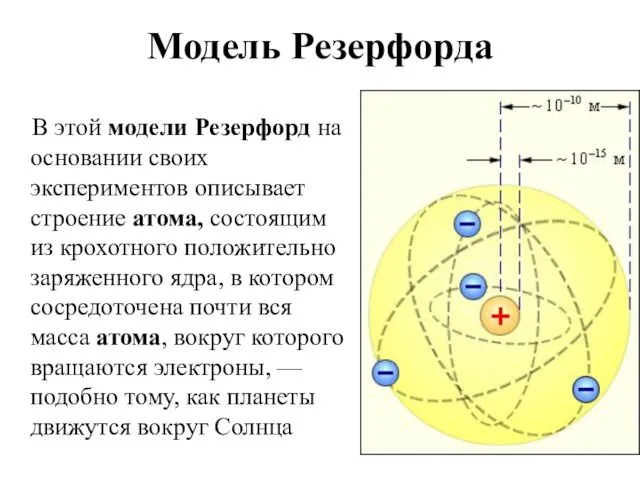
- 7. Модель Резерфорда В этой модели Резерфорд на основании своих экспериментов описывает строение атома, состоящим из крохотного
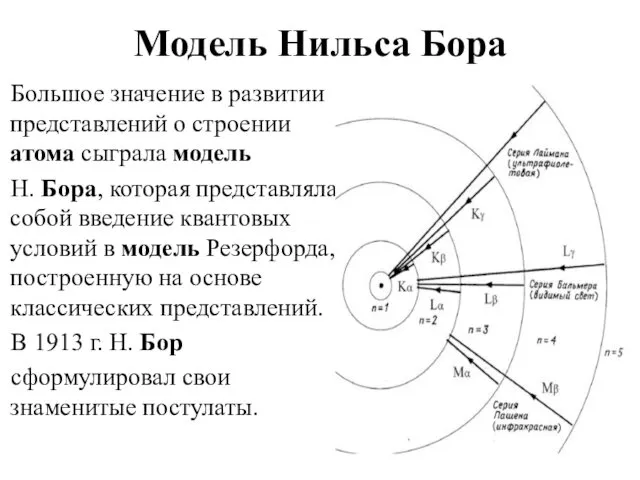
- 8. Модель Нильса Бора Большое значение в развитии представлений о строении атома сыграла модель Н. Бора, которая
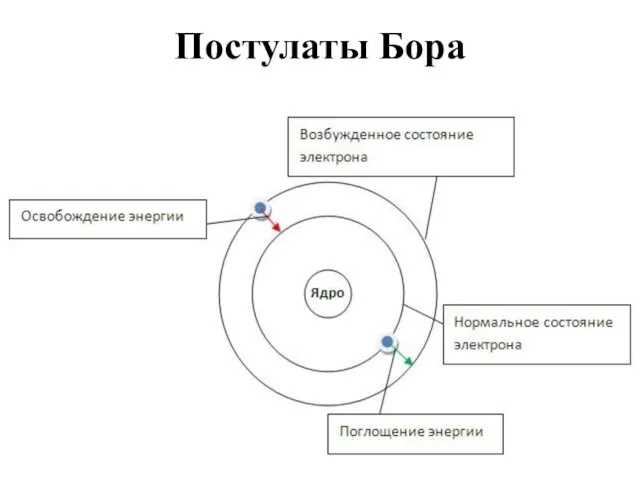
- 9. Постулаты Бора Атом и атомные системы могут длительно пребывать только в особенных стационарных или квантовых состояниях,
- 10. Постулаты Бора
- 11. Недостатки модели Бора Эта модель не позволяет объяснить некоторые особенности в спектрах более тяжелых элементов, чем
- 12. Волновая модель атома де Бройля
- 13. Де Бройль первым понял, что если волны могут вести себя как частицы, то и частицы могут
- 14. Двойственная природа электрона Его движение не может быть описано определенной траекторией, траектория размывается, появляется «полоса неопределенности»,
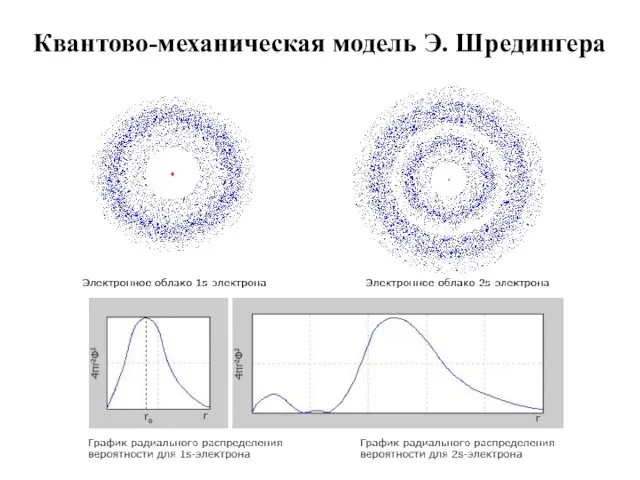
- 15. Квантово-механическая модель Э. Шредингера
- 16. В 1926 г. Э. Шредингер предложил для описания движения электрона в атоме волновое уравнение, получившее название
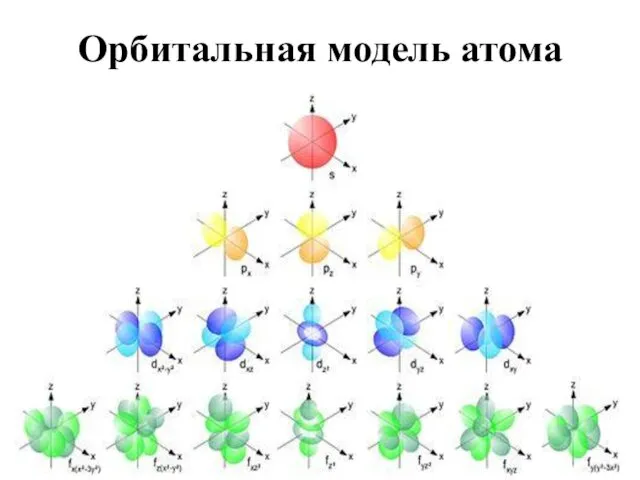
- 17. Орбитальная модель атома
- 18. Орбитали s - подоболочка названа по «резкой» s - линии – sharp; p - по «главной»
- 19. Кольцегранная модель атома Снельсена В кольцегранных моделях пары электронов с различными знаками спин обозначаются парами колец,
- 20. ХАРАКТЕРИСТИКИ ЭЛЕКТРОНА В 1897 г. Джозеф Джон Томсон (1856 – 1940) определил заряд и массу отдельного
- 22. Скачать презентацию











 Технология производства помадных конфет
Технология производства помадных конфет Нормативное регулирование учета денежных средств
Нормативное регулирование учета денежных средств Активность личности студента. Потребности в мотивации личности студента
Активность личности студента. Потребности в мотивации личности студента Презентация Обеспечение развития личности, мотивации и способностей детей в различных видах деятельности в соответствии с целевыми ориентирами ФГОС ДО
Презентация Обеспечение развития личности, мотивации и способностей детей в различных видах деятельности в соответствии с целевыми ориентирами ФГОС ДО Позитивные установки на труд и социально-экономические показатели эффективности организации. Методы изменения установок
Позитивные установки на труд и социально-экономические показатели эффективности организации. Методы изменения установок Атрезия пищевода
Атрезия пищевода Все о мыльной пене. Знакомство младших дошкольников со свойствами мыльной пены.
Все о мыльной пене. Знакомство младших дошкольников со свойствами мыльной пены. Транспортные операции
Транспортные операции Система авторизации WI-FI
Система авторизации WI-FI Организация предметно – пространственной развивающей среды в группе
Организация предметно – пространственной развивающей среды в группе Простое слово - извините
Простое слово - извините Блог как форма личного и корпоративного Интернет - представительства
Блог как форма личного и корпоративного Интернет - представительства Обследование детей с дизартрией
Обследование детей с дизартрией Правила поведения на природе. Исследовательская работа учащихся
Правила поведения на природе. Исследовательская работа учащихся Физиологические роды. Ведение родов
Физиологические роды. Ведение родов День народного единства
День народного единства Общие сведения о транспорте
Общие сведения о транспорте Презентация Веселые песчинки
Презентация Веселые песчинки Асқазан ішек жолдарының моторикасын босаңсытатын заттар:спазмолитикалық заттар. Жіктелуі. Әсер ету механизімі. Қолданылуы
Асқазан ішек жолдарының моторикасын босаңсытатын заттар:спазмолитикалық заттар. Жіктелуі. Әсер ету механизімі. Қолданылуы Практическая работа по теме Вашингтон
Практическая работа по теме Вашингтон Презентация (продолжение) к уроку:Степень.Квадрат и куб числа
Презентация (продолжение) к уроку:Степень.Квадрат и куб числа Народы Байкала
Народы Байкала Теория трансакционных издержек. Введение
Теория трансакционных издержек. Введение Шанхайская организация сотрудничества
Шанхайская организация сотрудничества Составляющие и функции операционной системы Linux
Составляющие и функции операционной системы Linux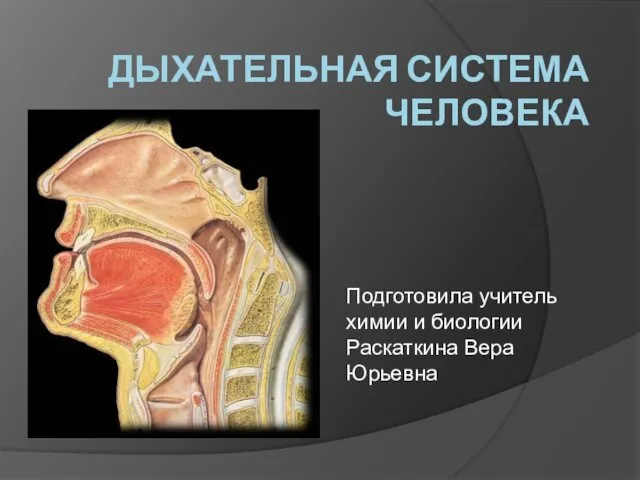 Дыхательная система человека. Эволюция органов дыхания
Дыхательная система человека. Эволюция органов дыхания Культура Ярославского края в 19 веке. 4 класс
Культура Ярославского края в 19 веке. 4 класс Организация и проведение мероприятий по воспроизводству лесов и лесоразведению
Организация и проведение мероприятий по воспроизводству лесов и лесоразведению