Содержание
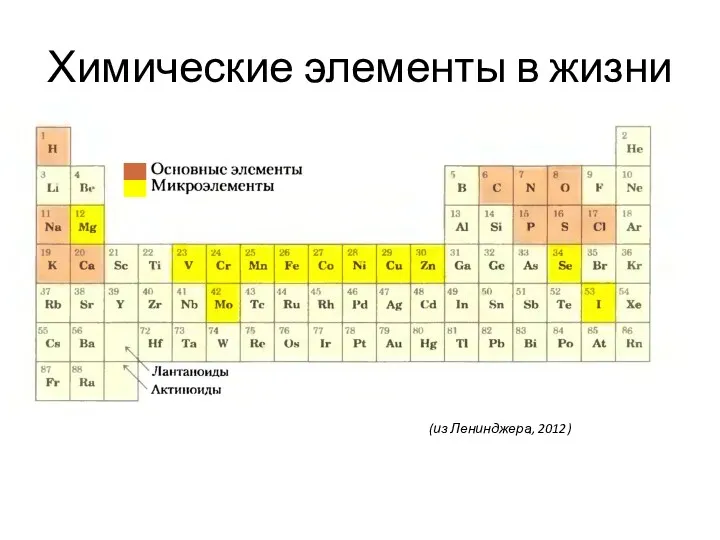
- 2. Химические элементы в жизни (из Ленинджера, 2012)
- 3. Законы термодинамики Первый: Энергия не берется из ниоткуда и никуда не исчезает «Вы не можете выиграть»
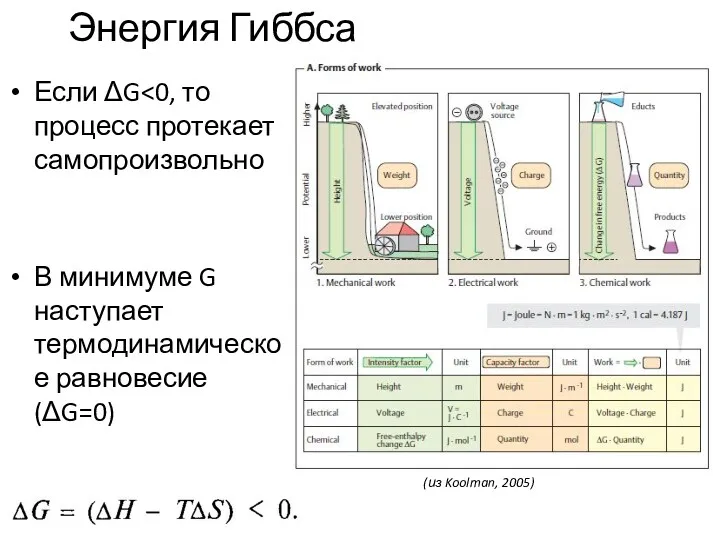
- 4. Энергия Гиббса Если ΔG В минимуме G наступает термодинамическое равновесие (ΔG=0) (из Koolman, 2005)
- 5. Равновесие Принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то в результате протекающих
- 6. Атом Атом состоит из ядра и электронов Ядро состоит из протонов и нейтронов Атомы различных элементов
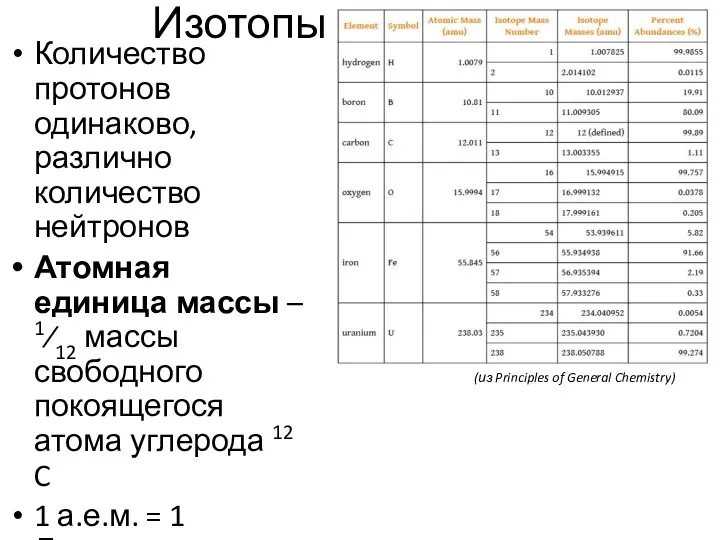
- 7. Изотопы Количество протонов одинаково, различно количество нейтронов Атомная единица массы – 1⁄12 массы свободного покоящегося атома
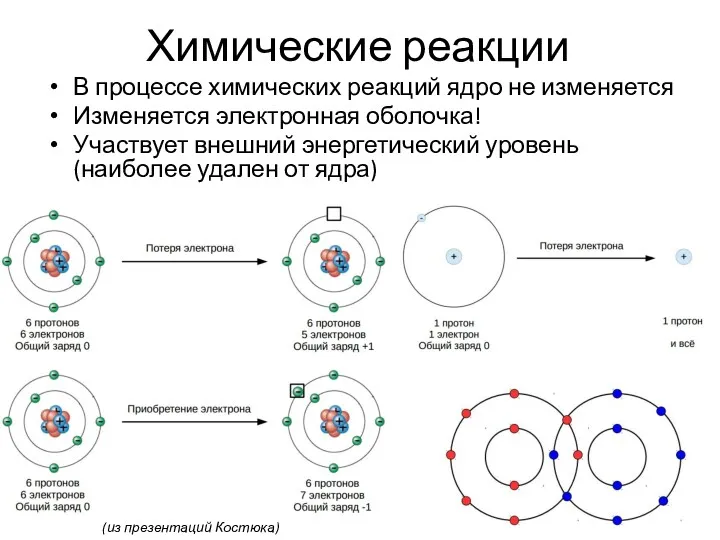
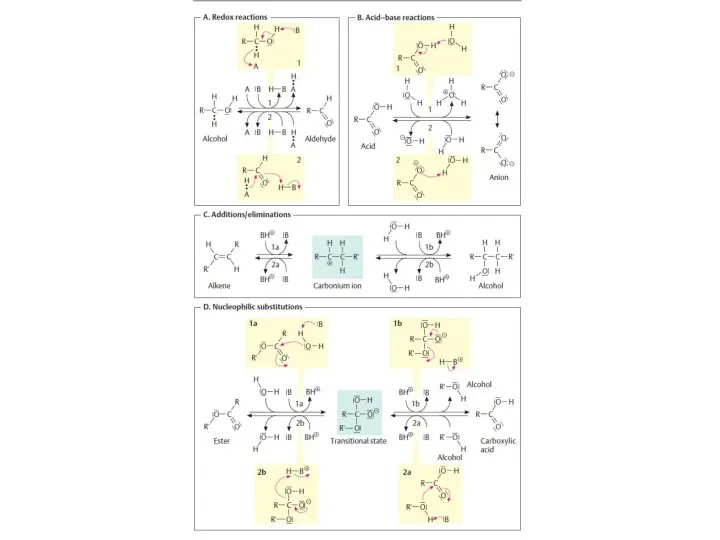
- 8. Химические реакции В процессе химических реакций ядро не изменяется Изменяется электронная оболочка! Участвует внешний энергетический уровень
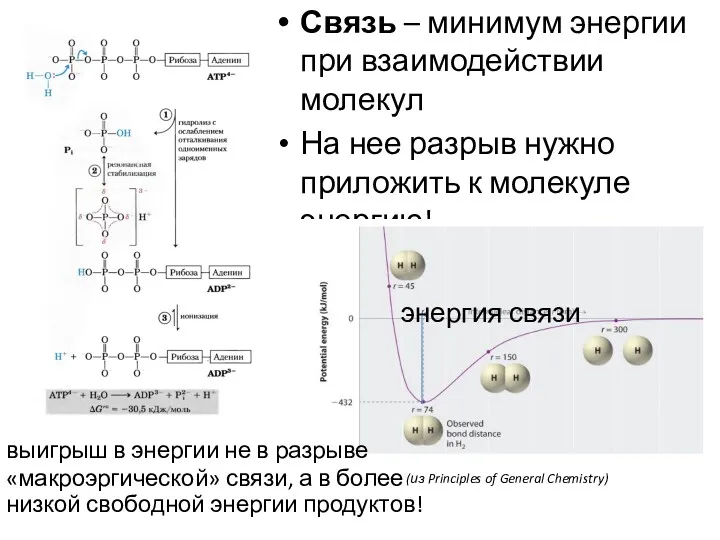
- 9. Связь – минимум энергии при взаимодействии молекул На нее разрыв нужно приложить к молекуле энергию! энергия
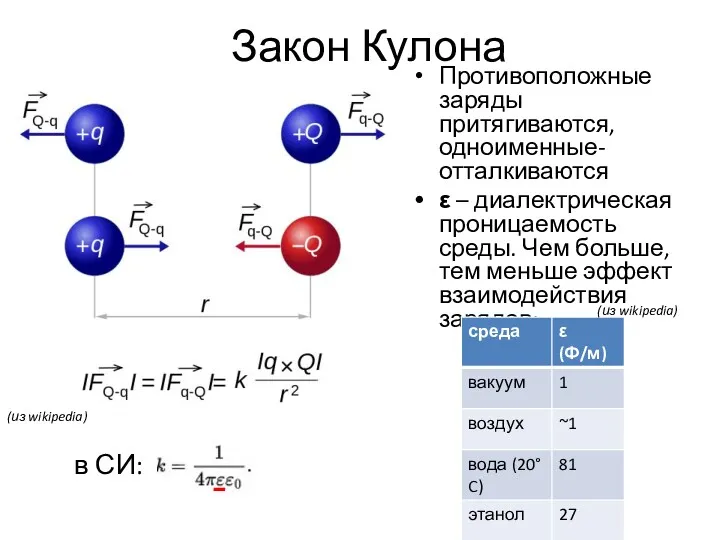
- 10. Закон Кулона Противоположные заряды притягиваются, одноименные- отталкиваются ε – диалектрическая проницаемость среды. Чем больше, тем меньше
- 11. Ионная связь – электроотрицательный атом забирает электрон Элекростатические взаимодействия (из презентаций Костюка) (из Principles of General
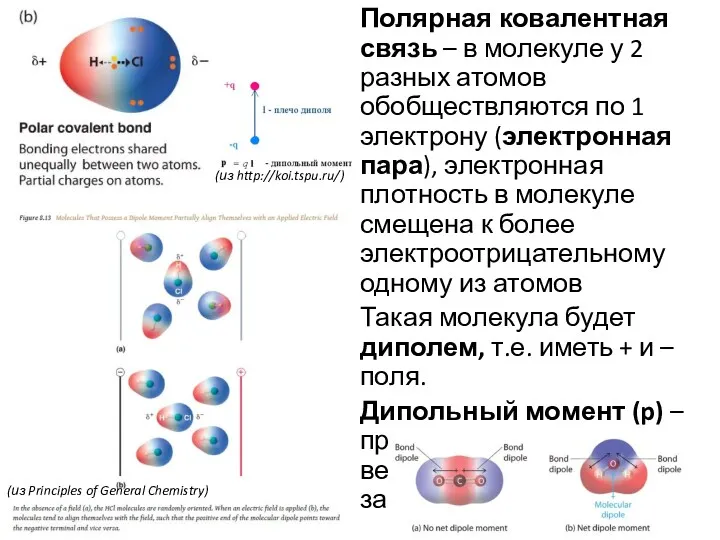
- 12. Полярная ковалентная связь – в молекуле у 2 разных атомов обобществляются по 1 электрону (электронная пара),
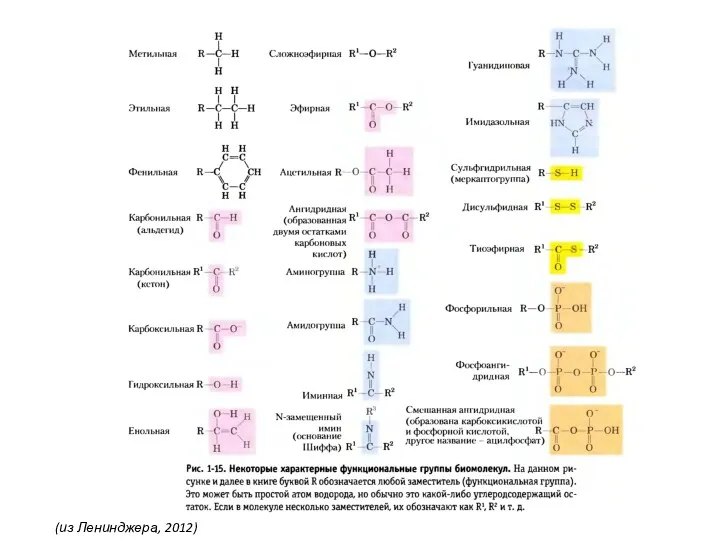
- 13. (из Ленинджера, 2012)
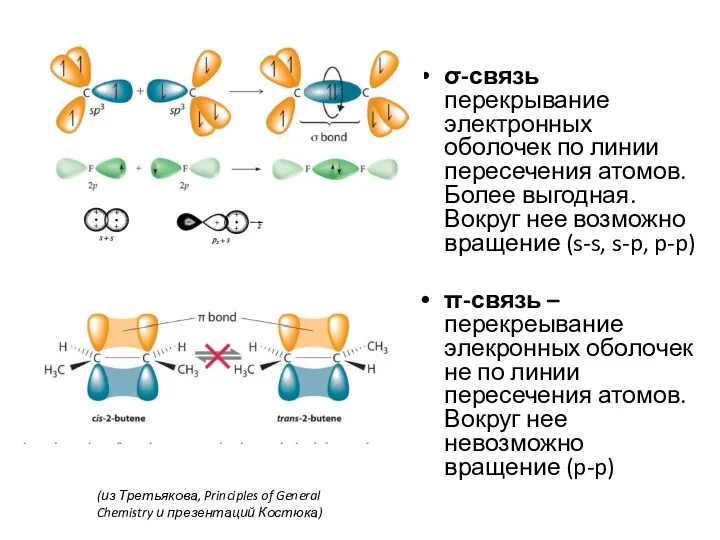
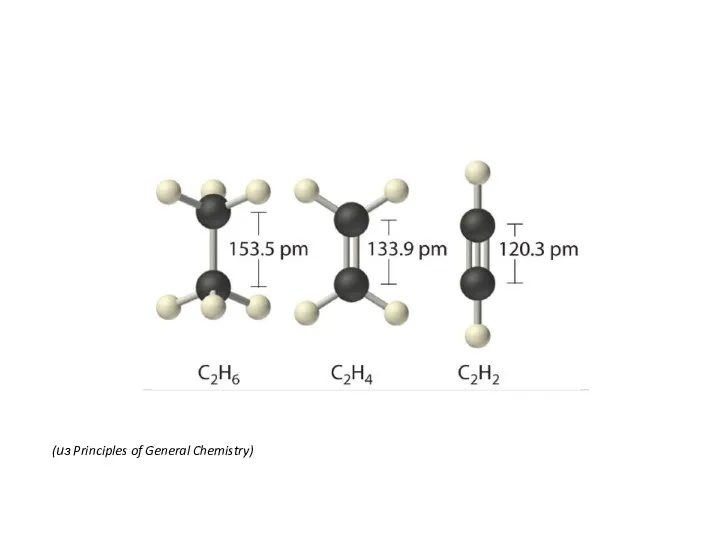
- 14. σ-связь перекрывание электронных оболочек по линии пересечения атомов. Более выгодная. Вокруг нее возможно вращение (s-s, s-p,
- 15. (из Principles of General Chemistry)
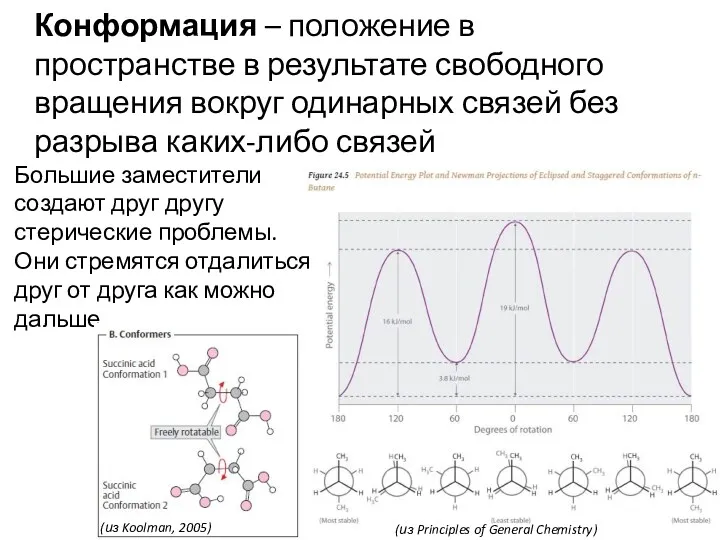
- 16. Конформация – положение в пространстве в результате свободного вращения вокруг одинарных связей без разрыва каких-либо связей
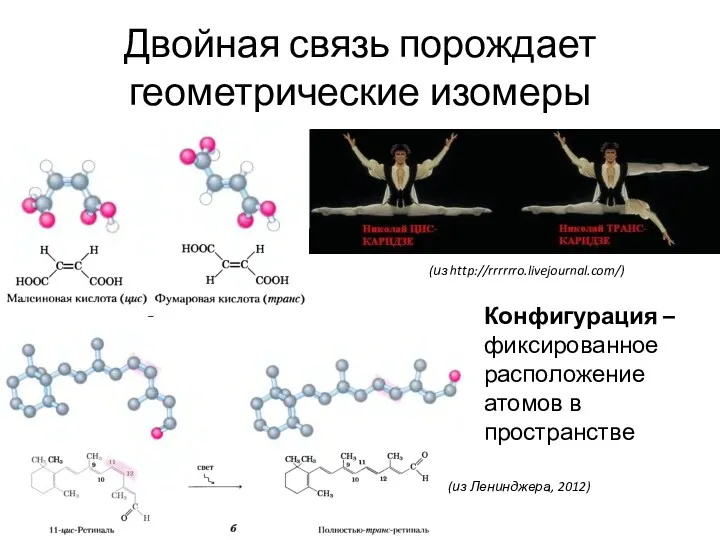
- 17. Двойная связь порождает геометрические изомеры (из http://rrrrrro.livejournal.com/) Конфигурация – фиксированное расположение атомов в пространстве (из Ленинджера,
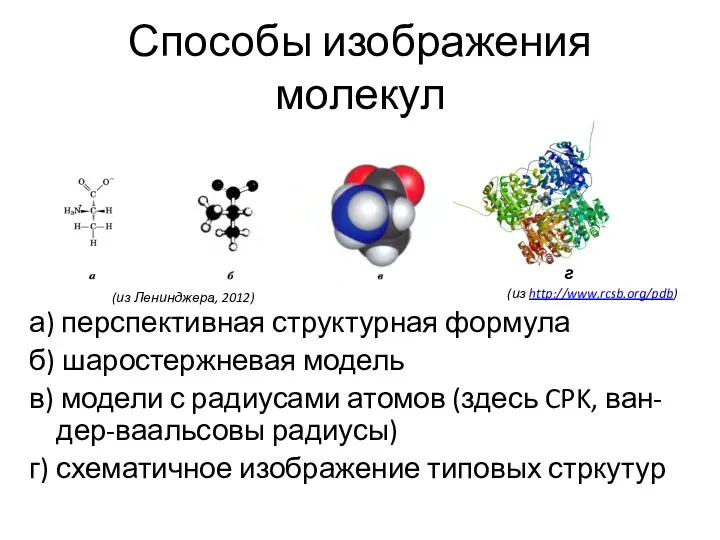
- 18. Способы изображения молекул а) перспективная структурная формула б) шаростержневая модель в) модели с радиусами атомов (здесь
- 19. (из Ленинджера, 2012)
- 20. М
- 22. Разнообразие биологических молекул белки липиды углеводы нуклеиновые кислоты … витамины разные низкомолекулярные соединения
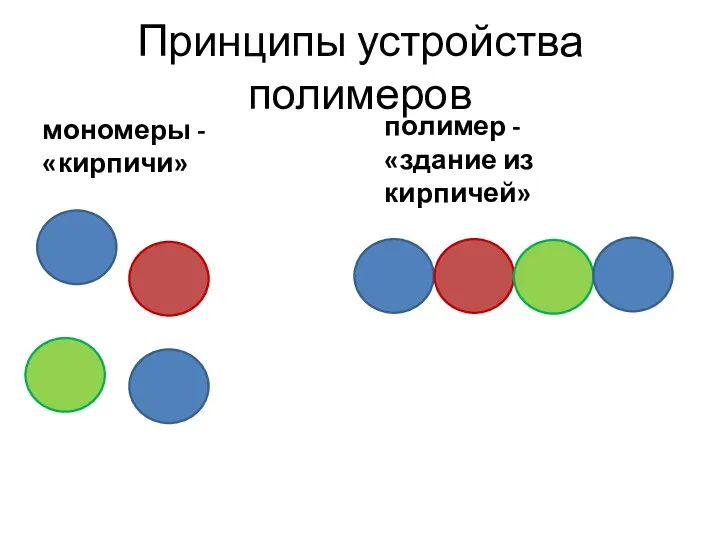
- 23. Принципы устройства полимеров мономеры - «кирпичи» полимер - «здание из кирпичей»
- 24. Электростатические (ван-дер-ваальсовы) взаимодействия – взаимодействие диполей а) диполь-дипольное: между двумя постоянным диполями, E ~ 1/r3 б)
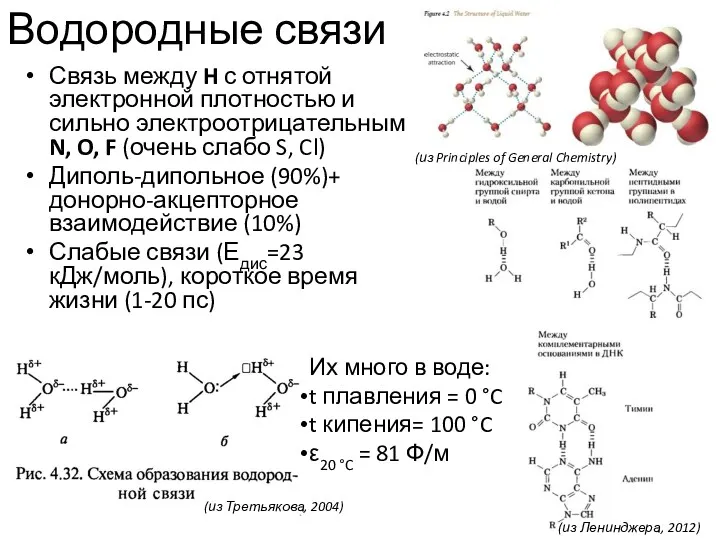
- 25. Водородные связи Связь между H с отнятой электронной плотностью и сильно электроотрицательным N, O, F (очень
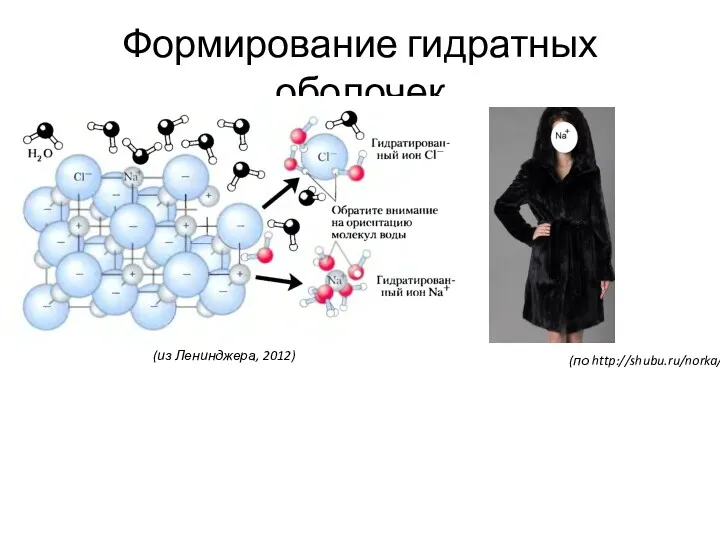
- 26. Формирование гидратных оболочек (по http://shubu.ru/norka/) (из Ленинджера, 2012)
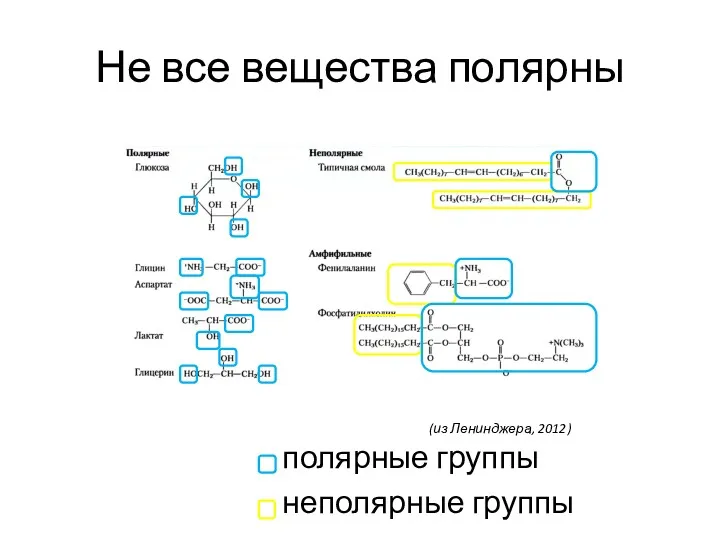
- 27. Не все вещества полярны полярные группы неполярные группы (из Ленинджера, 2012)
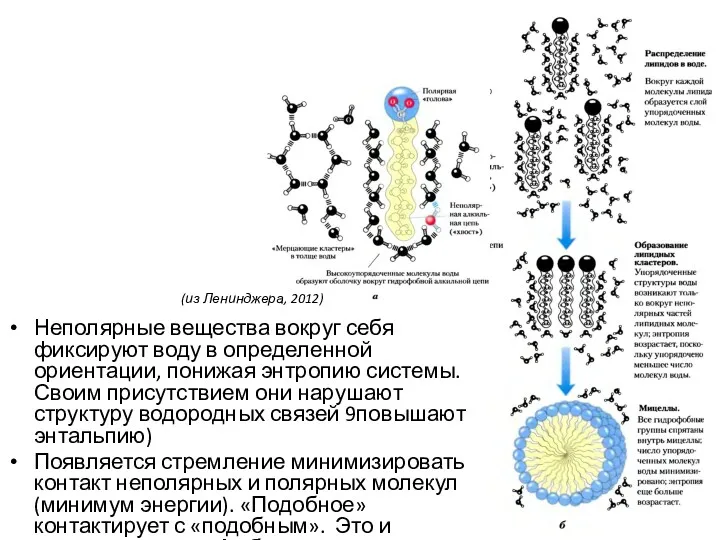
- 28. Неполярные вещества вокруг себя фиксируют воду в определенной ориентации, понижая энтропию системы. Своим присутствием они нарушают
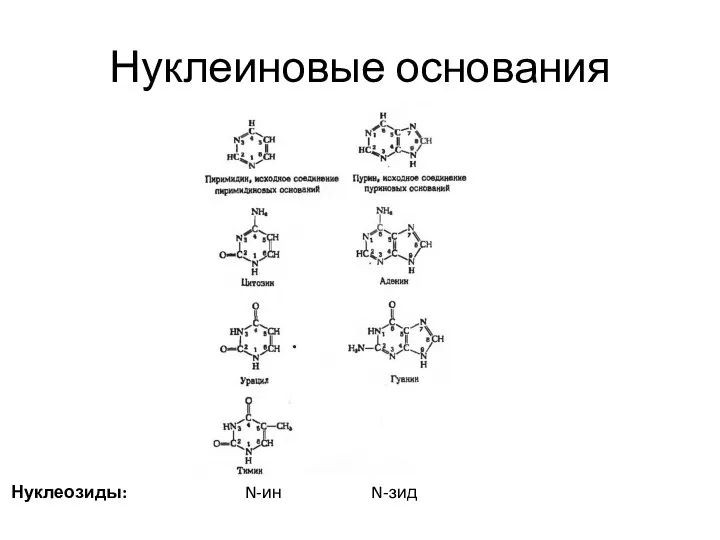
- 29. Нуклеиновые основания Нуклеозиды: N-ин N-зид
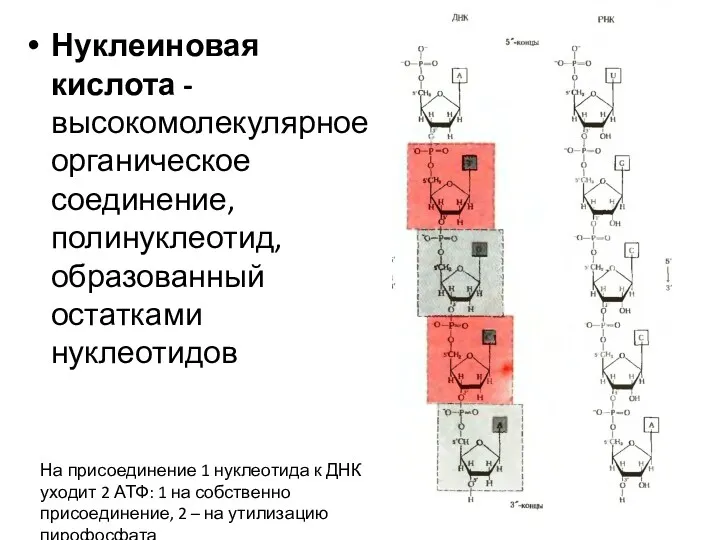
- 30. Нуклеиновая кислота - высокомолекулярное органическое соединение, полинуклеотид, образованный остатками нуклеотидов На присоединение 1 нуклеотида к ДНК
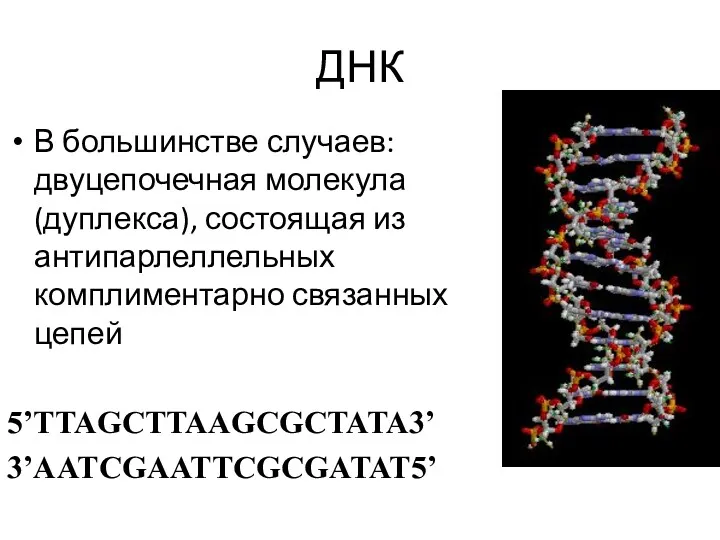
- 31. ДНК В большинстве случаев: двуцепочечная молекула (дуплекса), состоящая из антипарлеллельных комплиментарно связанных цепей 5’TTAGCTTAAGCGCTATA3’ 3’AATCGAATTCGCGATAT5’
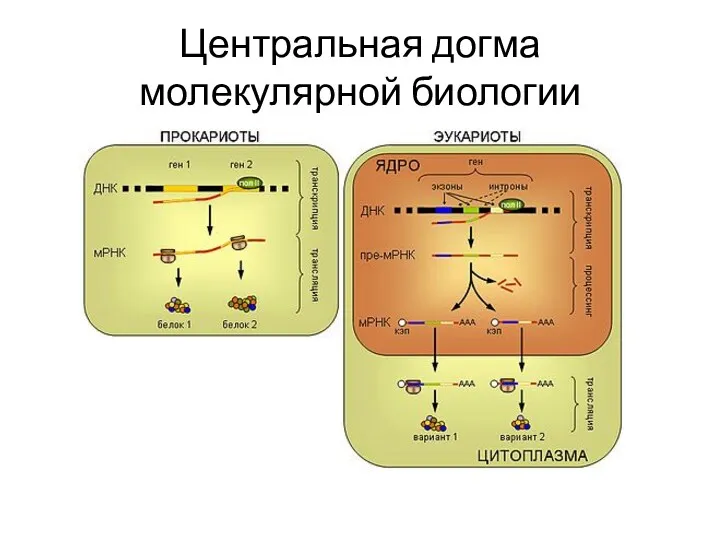
- 32. Центральная догма молекулярной биологии
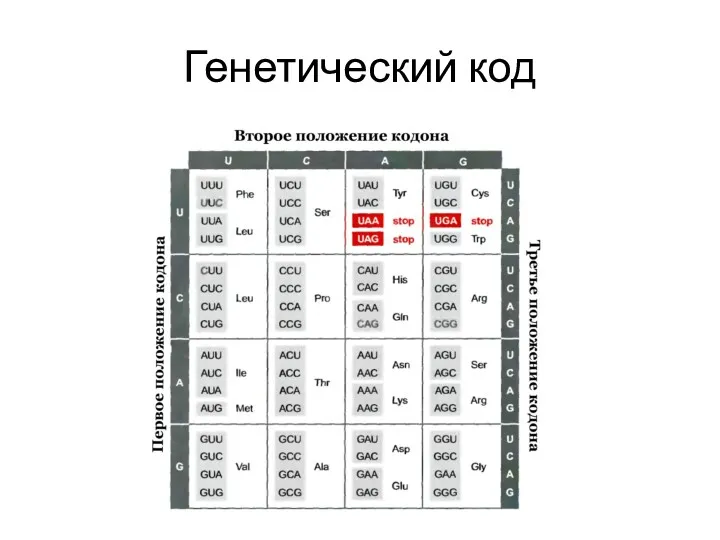
- 33. Генетический код
- 34. (из Ленинджера, 2012)
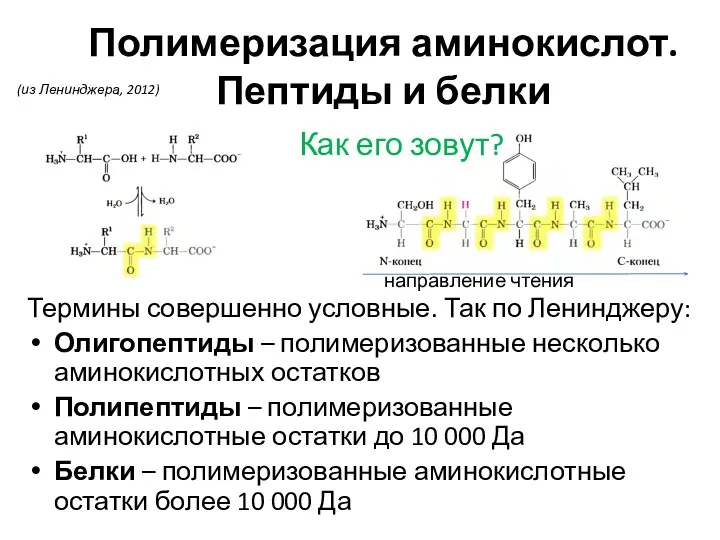
- 35. Полимеризация аминокислот. Пептиды и белки Термины совершенно условные. Так по Ленинджеру: Олигопептиды – полимеризованные несколько аминокислотных
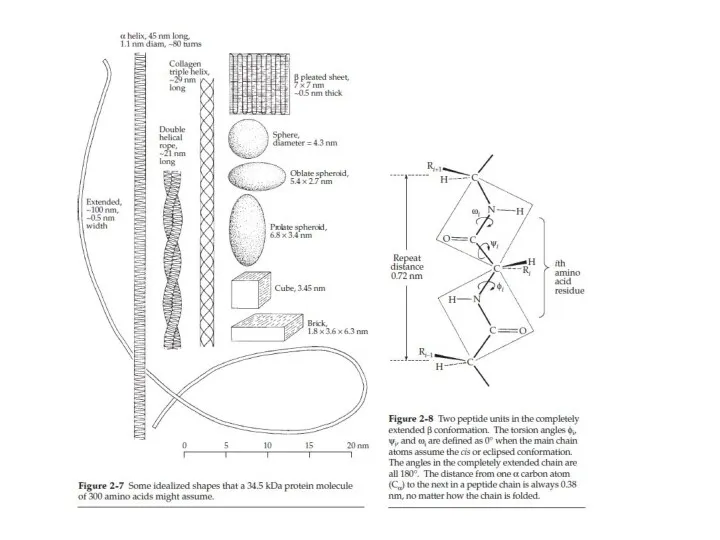
- 36. Структура белка Первичная: аминокислотная последовательность Вторичная: способы укладки аминокислотной последовательности Третичная: все аспекты пространственной организации беелка
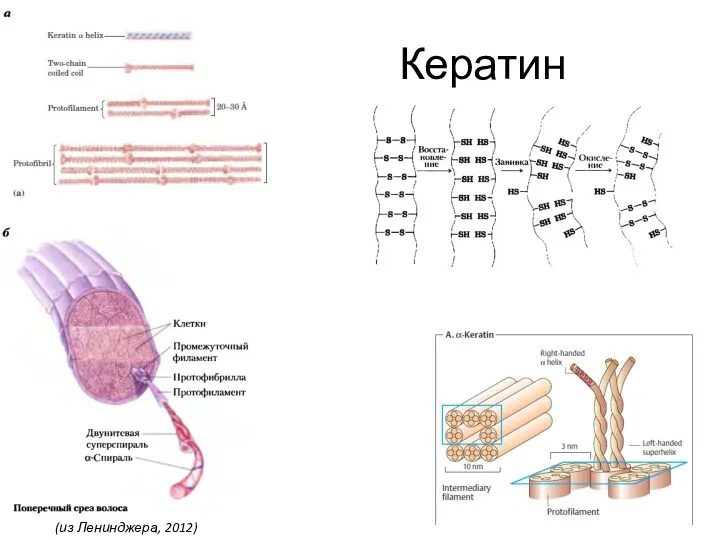
- 38. Кератин (из Ленинджера, 2012)
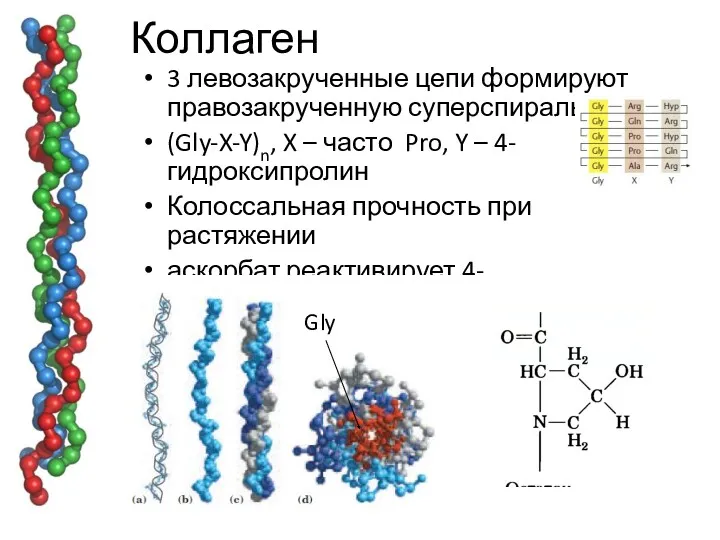
- 39. Коллаген 3 левозакрученные цепи формируют правозакрученную суперспираль (Gly-X-Y)n, X – часто Pro, Y – 4-гидроксипролин Колоссальная
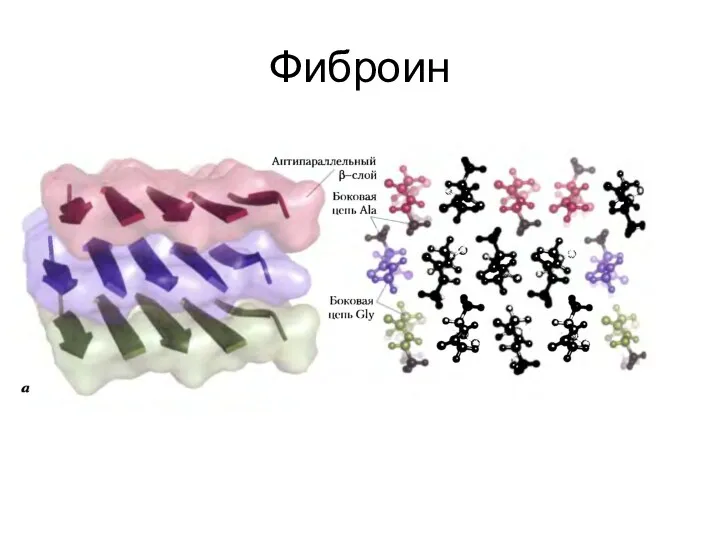
- 40. Фиброин
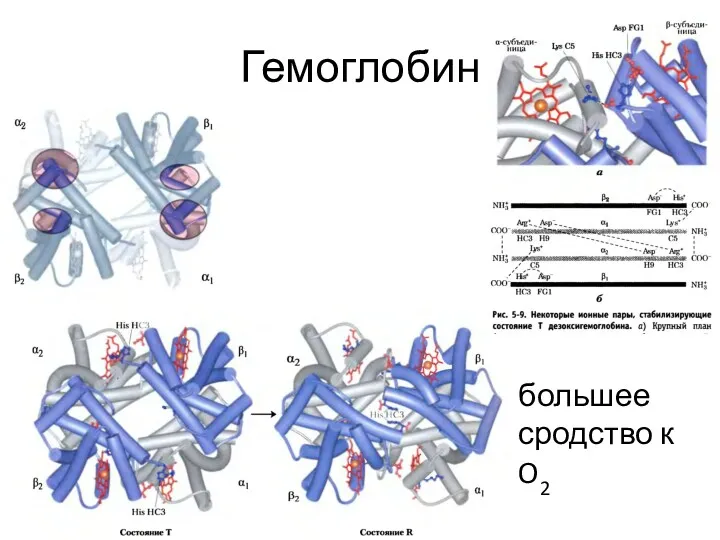
- 41. Гемоглобин большее сродство к O2
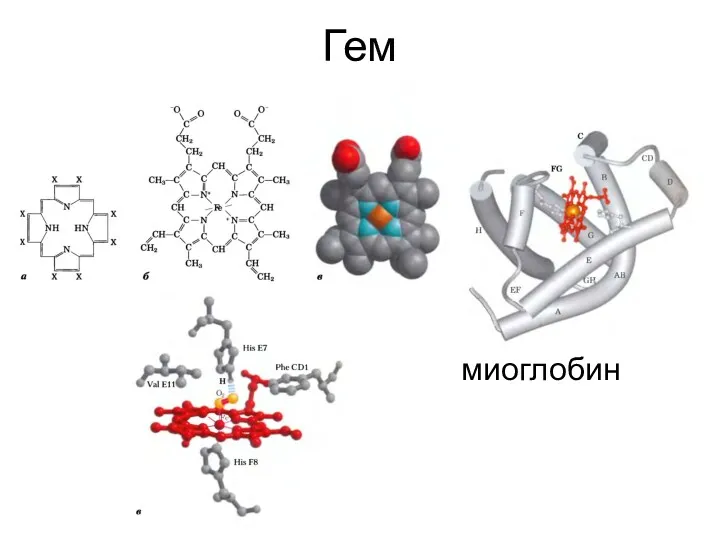
- 42. Гем миоглобин
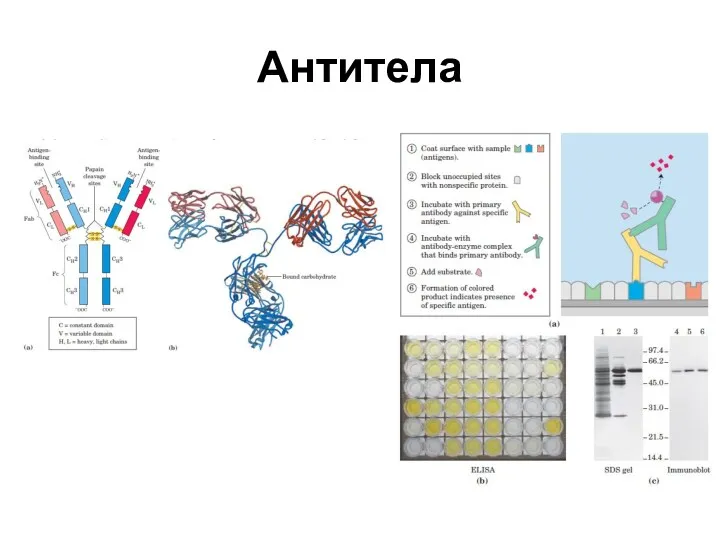
- 43. Антитела
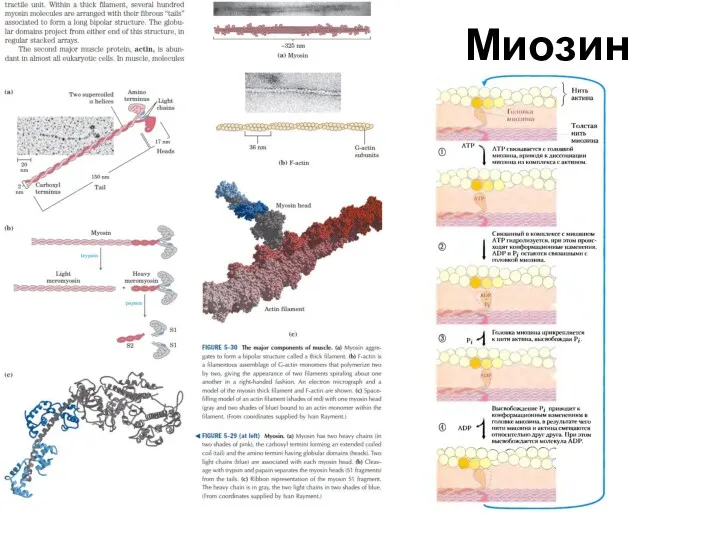
- 44. Миозин
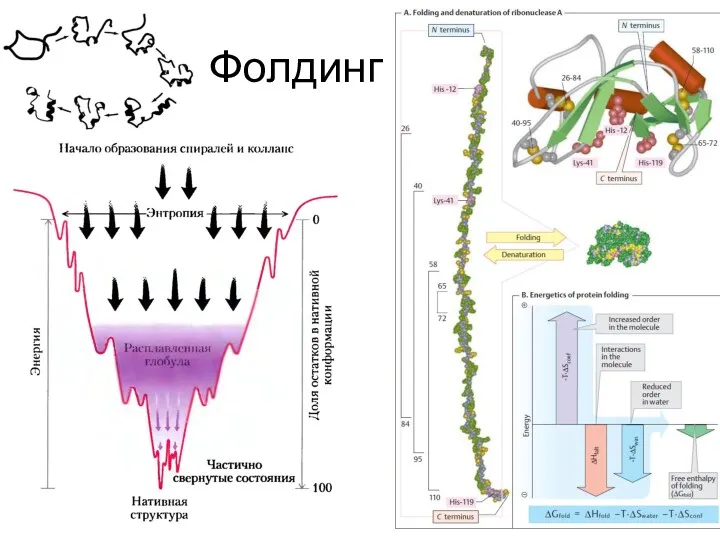
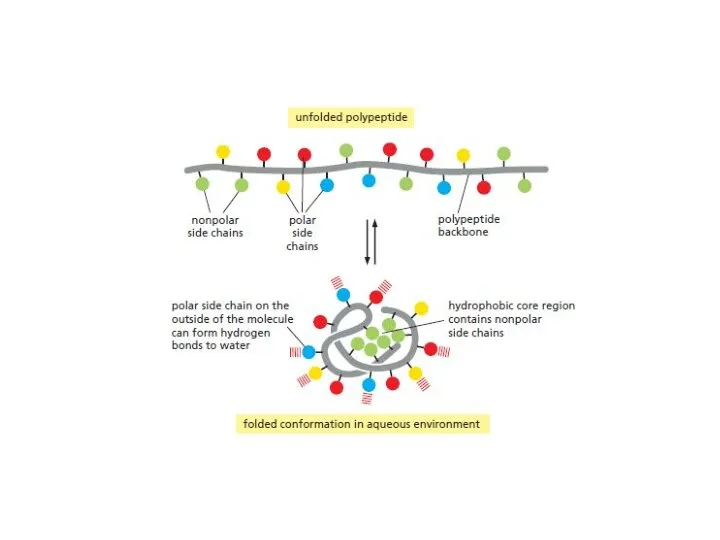
- 45. Фолдинг белка
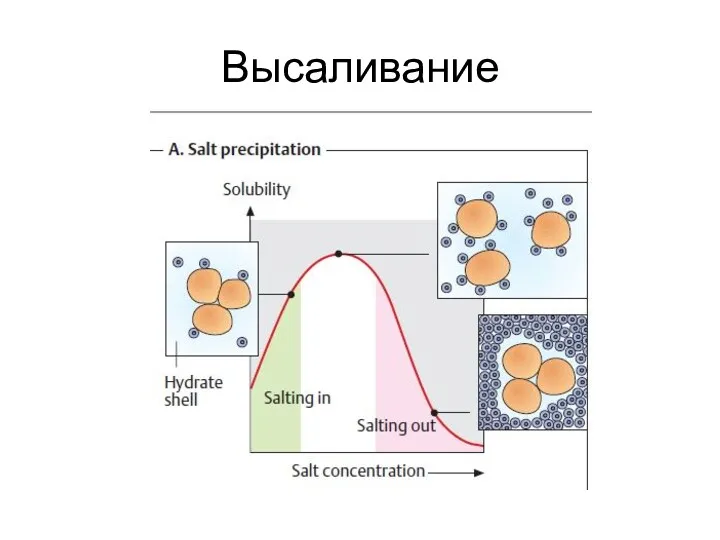
- 47. Высаливание
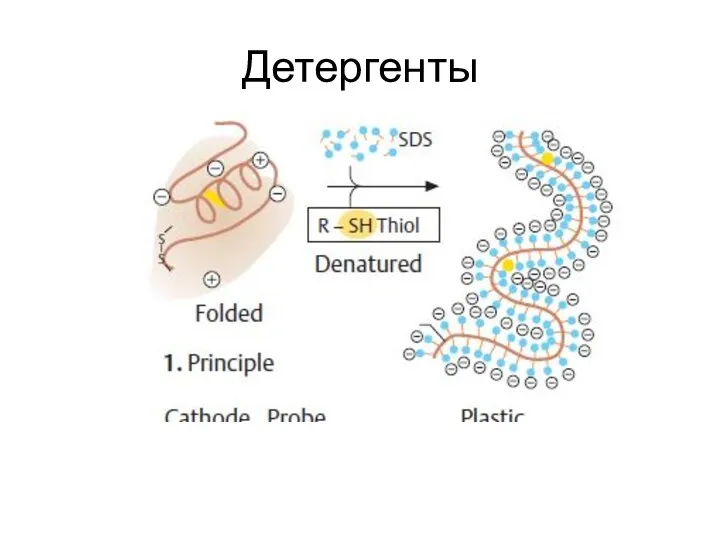
- 48. Детергенты
- 49. Л
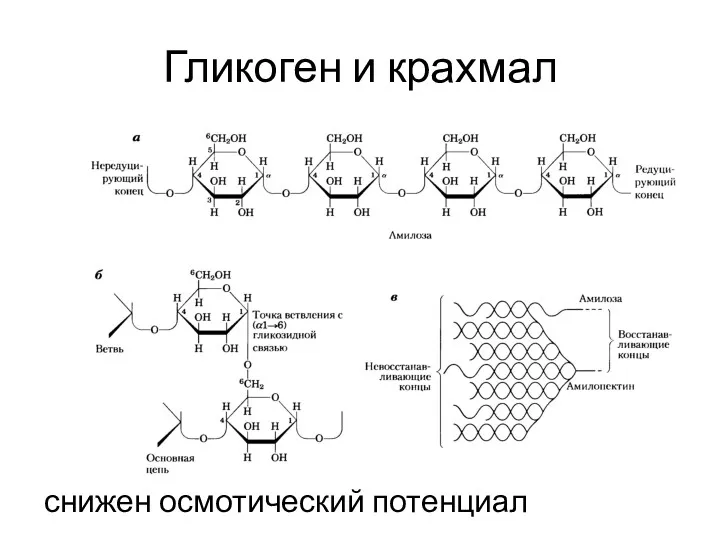
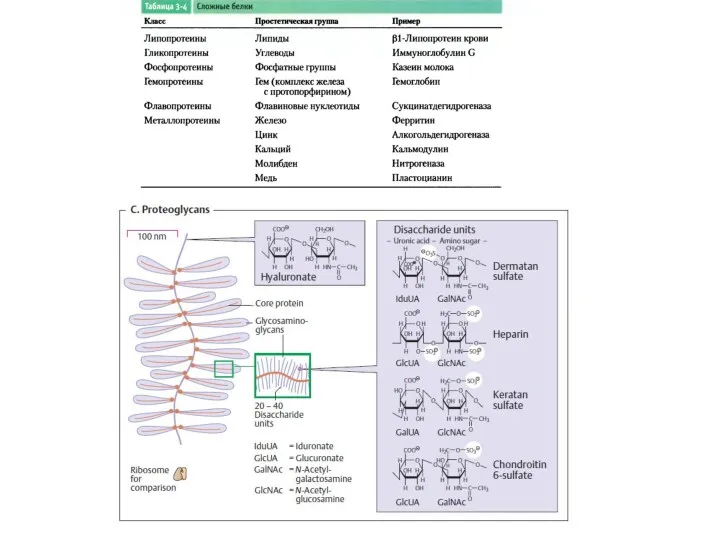
- 50. Гликоген и крахмал снижен осмотический потенциал
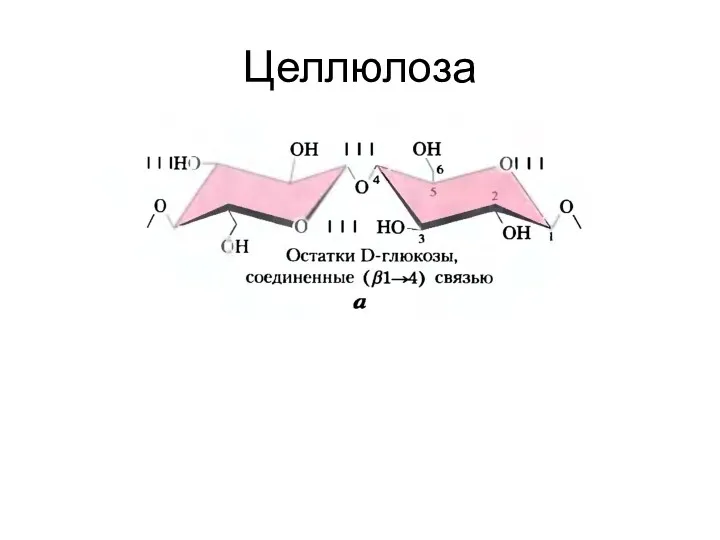
- 51. Целлюлоза
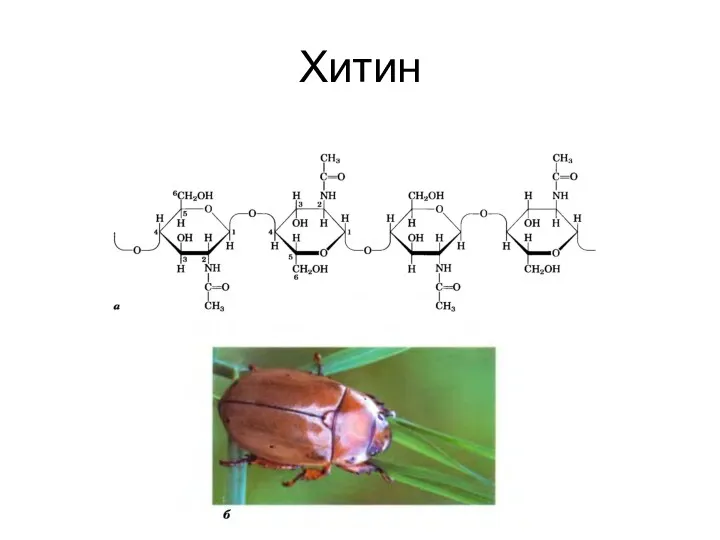
- 52. Хитин
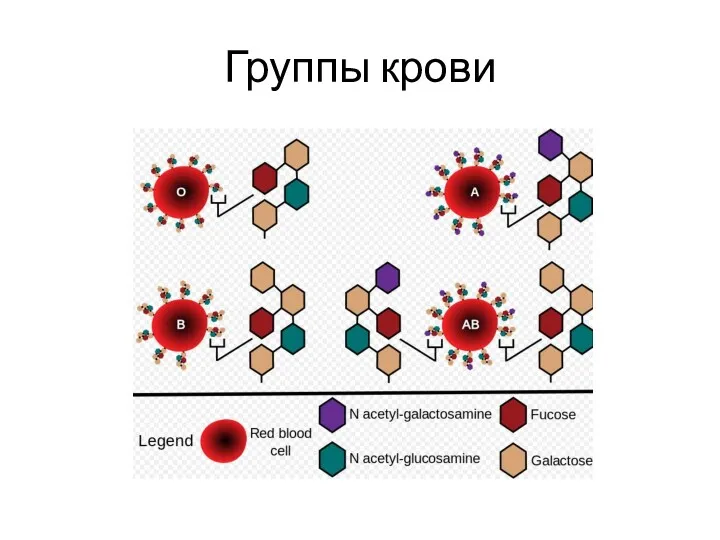
- 54. Группы крови
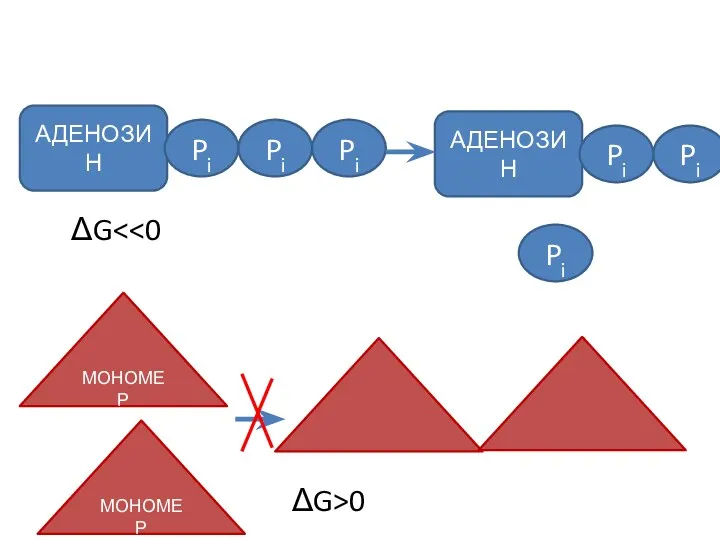
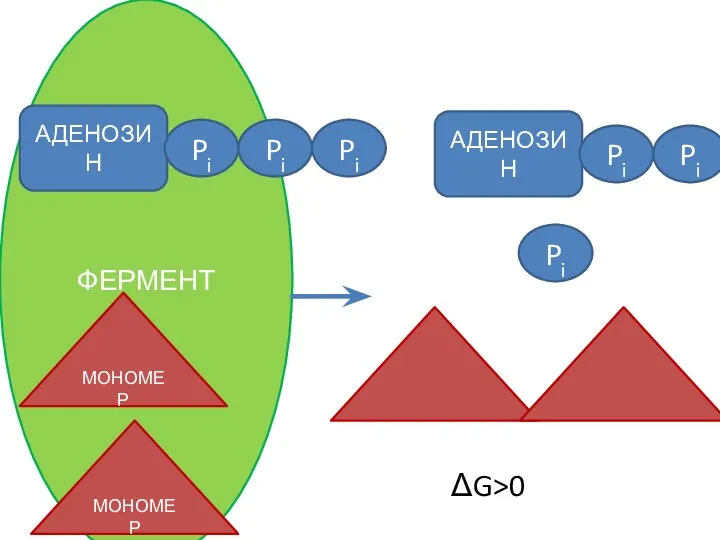
- 55. ΔG АДЕНОЗИН Pi Pi Pi АДЕНОЗИН Pi Pi Pi МОНОМЕР МОНОМЕР ΔG>0
- 56. ФЕРМЕНТ АДЕНОЗИН Pi Pi Pi АДЕНОЗИН Pi Pi Pi МОНОМЕР МОНОМЕР ΔG>0
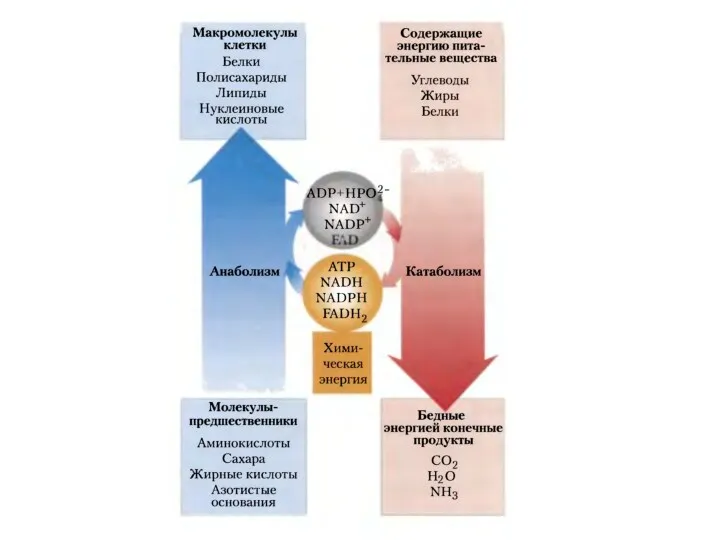
- 58. Откуда взять энергию?
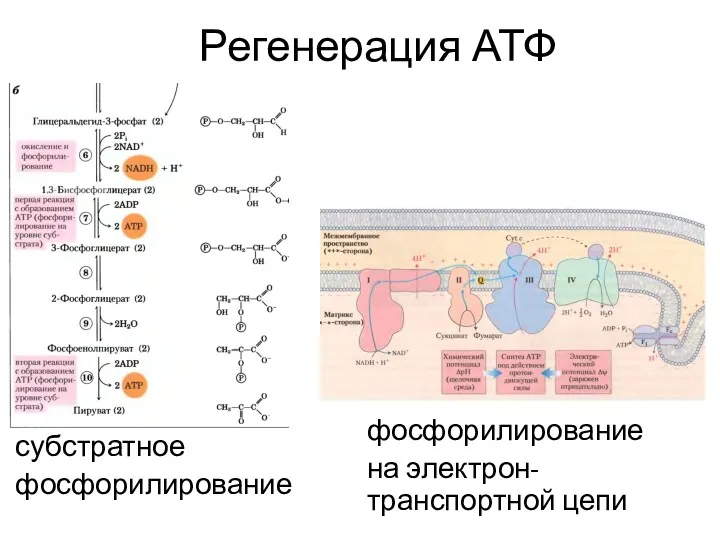
- 59. Регенерация АТФ субстратное фосфорилирование фосфорилирование на электрон-транспортной цепи
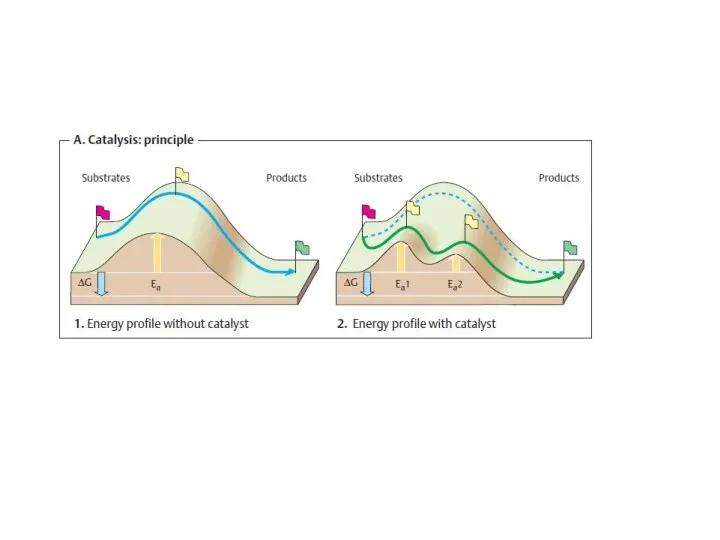
- 60. Катализатор – вещество, ускоряющее протекание химической реакции. Катализатор не смещает химическое равновесие. Ферменты – белки или
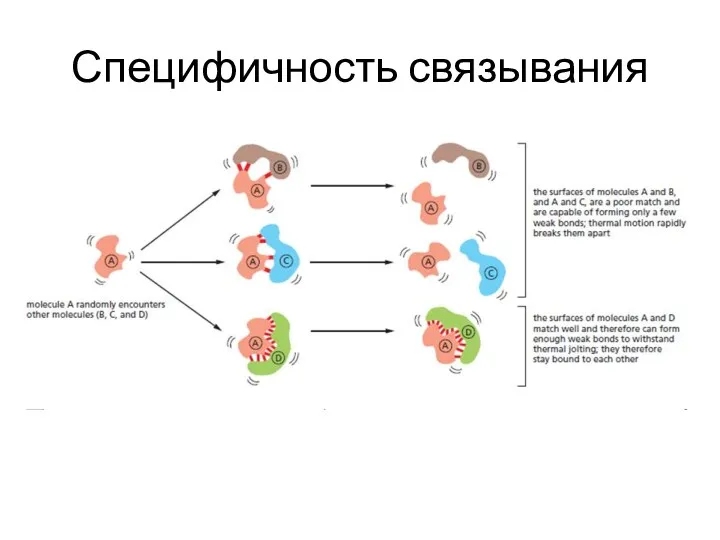
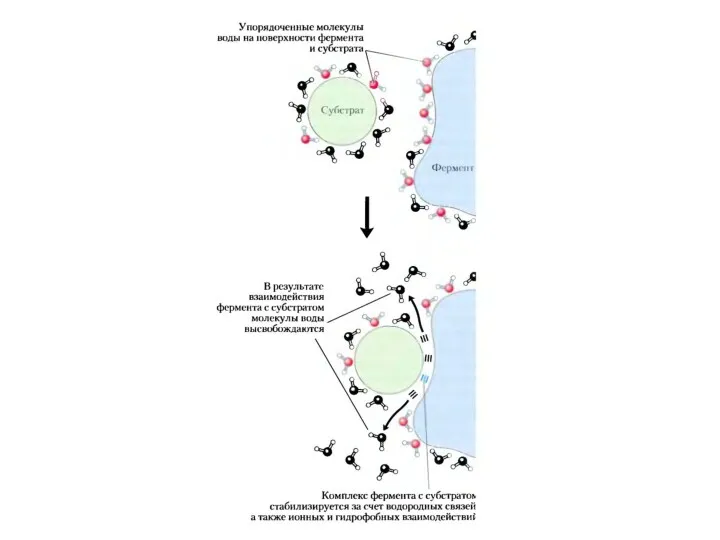
- 61. Специфичность связывания
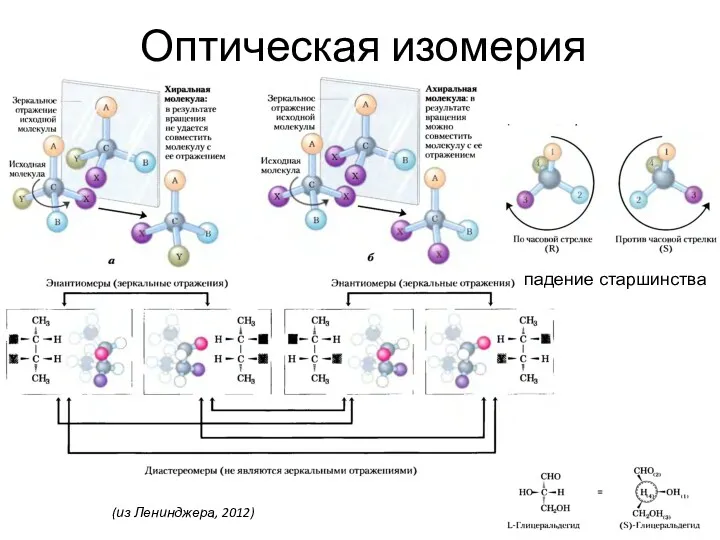
- 62. Оптическая изомерия падение старшинства (из Ленинджера, 2012)
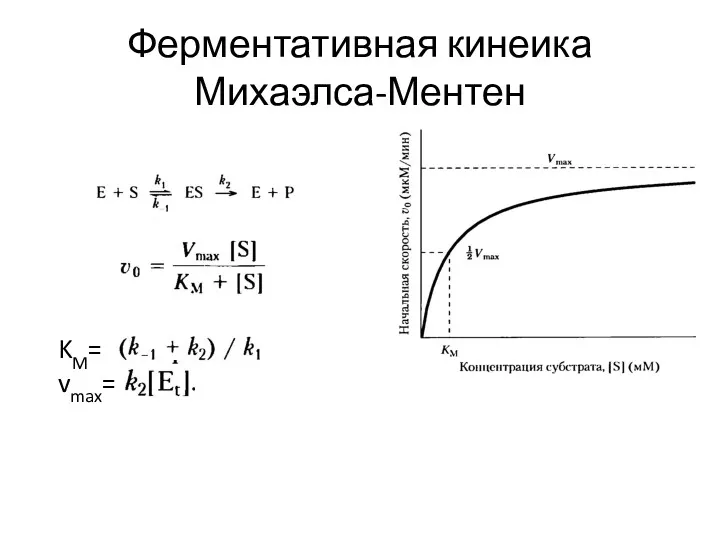
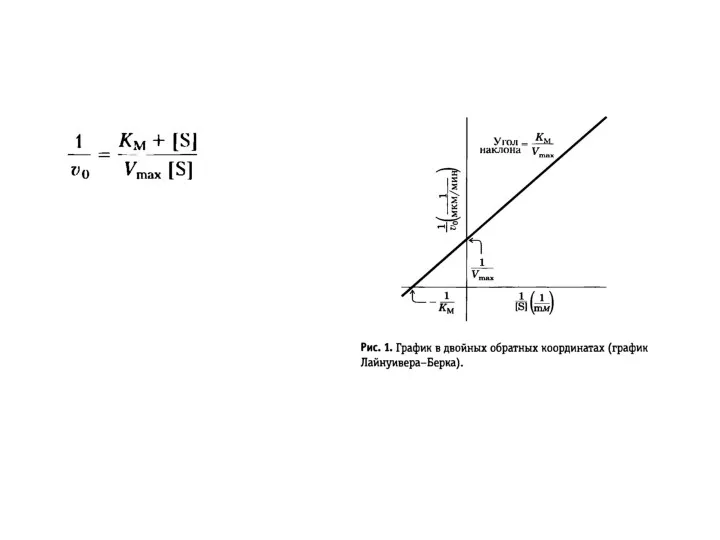
- 65. Ферментативная кинеика Михаэлса-Ментен KM= vmax=
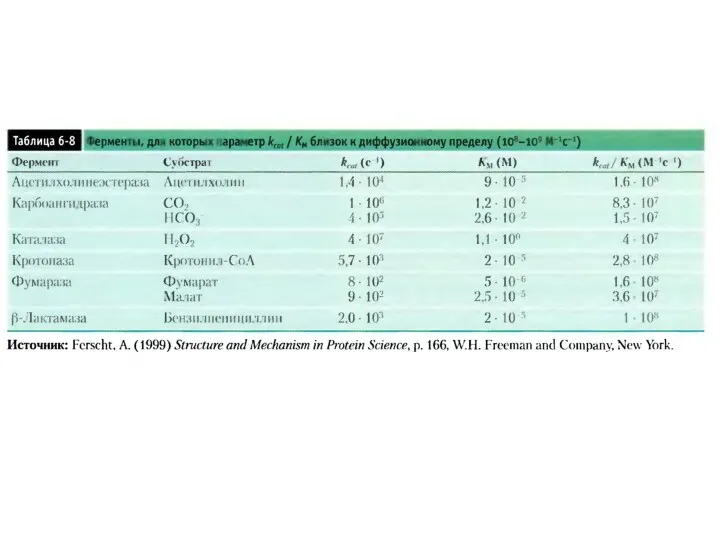
- 67. Неидеальный случай kcat – число оборотов Оценка специфичности фермента: коэффициент специфичности:
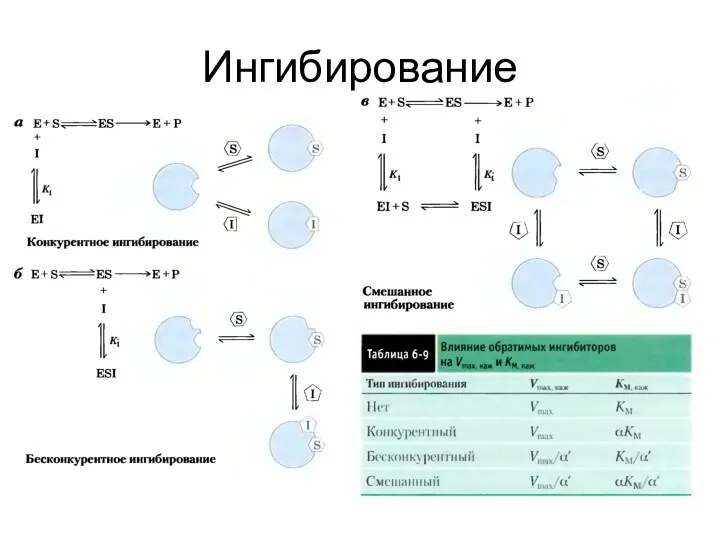
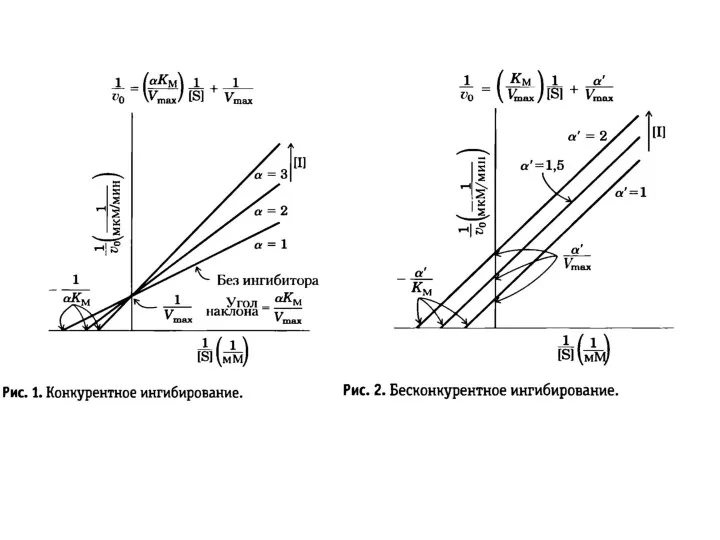
- 69. Ингибирование
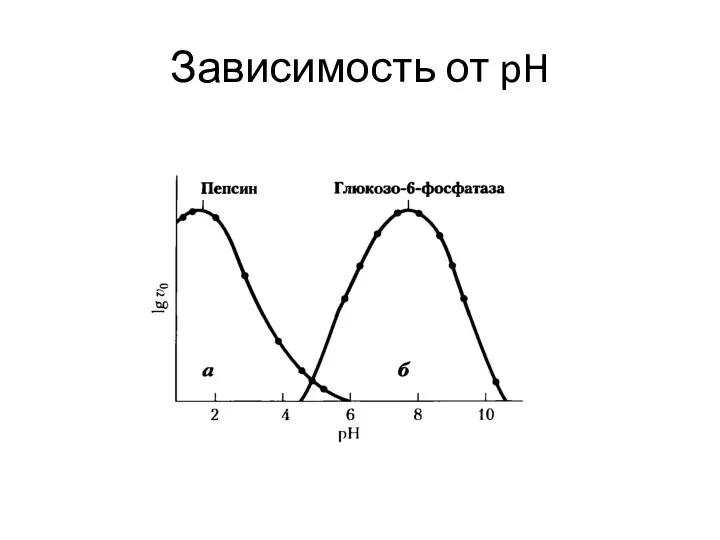
- 71. Зависимость от pH
- 78. Скачать презентацию


















 Изготовление бахил
Изготовление бахил ЕГЭ по химии, решение заданий части 3
ЕГЭ по химии, решение заданий части 3 Растворы ВМС. Коллоидные растворы (фармацевтика)
Растворы ВМС. Коллоидные растворы (фармацевтика) Цифровая обработка сигналов и изображений
Цифровая обработка сигналов и изображений Правописание приставок ПРИ-, ПРЕ-.
Правописание приставок ПРИ-, ПРЕ-. Оздоровительная физическая культура и ее формы. Влияние оздоровительной физической культуры на организм человека
Оздоровительная физическая культура и ее формы. Влияние оздоровительной физической культуры на организм человека Картотека сюжетно-ролевых игр для дошкольников
Картотека сюжетно-ролевых игр для дошкольников Группы детей с комплексными нарушениями развития
Группы детей с комплексными нарушениями развития Обучение дошкольников рассказыванию
Обучение дошкольников рассказыванию Реализация научно-исторического подхода при изучении темы. Северный морской путь: с позиции ФГОС
Реализация научно-исторического подхода при изучении темы. Северный морской путь: с позиции ФГОС Ишемическая болезнь кишечника
Ишемическая болезнь кишечника Конспект занятия по обучению детей правилам дорожного движения на тему: Знакомство со светофором во второй младшей группе.
Конспект занятия по обучению детей правилам дорожного движения на тему: Знакомство со светофором во второй младшей группе. Каразін В.Н
Каразін В.Н Русско-ордынские отношения
Русско-ордынские отношения Жак Луи Давид
Жак Луи Давид Стратиграфия. Теоретическая основа стратиграфии
Стратиграфия. Теоретическая основа стратиграфии Кубанское - значит качественное.
Кубанское - значит качественное. Цифровая фотография и видео
Цифровая фотография и видео Основні положення ЗУ Про акредитацію органів з оцінки відповідності
Основні положення ЗУ Про акредитацію органів з оцінки відповідності Презентация Подарок маме от первоклассников
Презентация Подарок маме от первоклассников Решение задач по теме Четырехугольники
Решение задач по теме Четырехугольники The solution for Cement Grinding
The solution for Cement Grinding Осень, осень в гости просим. Онлайн-викторина
Осень, осень в гости просим. Онлайн-викторина Рабочая программа Здоровячок по внеурочной деятельности 1-4 класс в соответствии с ФГОС
Рабочая программа Здоровячок по внеурочной деятельности 1-4 класс в соответствии с ФГОС Знаменитые места Тульского края
Знаменитые места Тульского края Противодействие коррупции на государственном и муниципальном уровнях
Противодействие коррупции на государственном и муниципальном уровнях Дидактическая игра-паззл Узнай героя
Дидактическая игра-паззл Узнай героя Жизненный цикл ПО
Жизненный цикл ПО