Содержание
- 2. План лекции
- 3. Методы исследований макроскопических процессов Введение Макроскопические процессы – это процессы, происходящие с веществом (жидким, газообразным), в
- 4. Раздел 1. Основные положения молекулярной физики
- 5. 1.1 Статистичность (законы больших чисел) 1. Основные положения молекулярной физики Все вещества состоят из отдельных частиц:
- 6. 1.2 Модель идеального газа 1. Основные положения молекулярной физики Гипотеза: поведение частиц (молекул, атомов) в веществе
- 7. 1.3 Размеры частиц (молекул, атомов) 1. Основные положения молекулярной физики Следует различать: реальный размер частицы (d)
- 8. Раздел 2. Эмпирические законы молекулярной физики
- 9. 2.1 Законы Бойля-Мариотта и Гей-Люссака для идеального газа 2. Эмпирические законы молекулярной физики Экспериментально было установлено,
- 10. 2.2 Уравнение Клапейрона 2. Эмпирические законы молекулярной физики В результате обобщения частных эмпирических законов Бойля-Мариотта и
- 11. 2.2 Уравнение Клапейрона-Менделеева 2. Эмпирические законы молекулярной физики Окончательная форма уравнения состояния идеального газа была установлена
- 12. 2.2 Расчёт количества вещества 2. Эмпирические законы молекулярной физики Определение: Полезные расчётные формулы: Vm = 22,4
- 13. Раздел 3. Основное уравнение молекулярно-кинетической теории идеального газа
- 14. 3.1 Собственно основное уравнение 3. Основное уравнение молекулярно- кинетической теории (МКТ) идеального газа p – давление
- 15. 3.2 Связь основного уравнения МКТ с уравнением Клапейрона- Менделеева 3. Основное уравнение молекулярно- кинетической теории (МКТ)
- 16. 3.2 Связь основного уравнения МКТ с уравнением Клапейрона- Менделеева (окончание) 3. Основное уравнение молекулярно- кинетической теории
- 17. 3.3 Вывод основного уравнения МКТ (факультативно) 3. Основное уравнение молекулярно- кинетической теории (МКТ) идеального газа Необходимо
- 18. Раздел 4. Идеальный газ в поле тяготения Земли
- 19. 4.1 Физическая модель 4. Идеальный газ в поле тяготения Земли Молекулы газа: совершают хаотическое тепловое движение
- 20. 4.2 Барометрическая формула 4. Идеальный газ в поле тяготения Земли Исходное уравнение (предыд.слайд) p – (p
- 21. 4.3 Распределение Больцмана 4. Идеальный газ в поле тяготения Земли Исходное уравнение (распределение Больцмана): (1) Из
- 22. Вопросы в экзаменационных билетах 1. Основные положения молекулярной физики 2. Эмпирические законы молекулярной физики 3. Основное
- 24. Скачать презентацию





















 Автоматты қайта қосылу
Автоматты қайта қосылу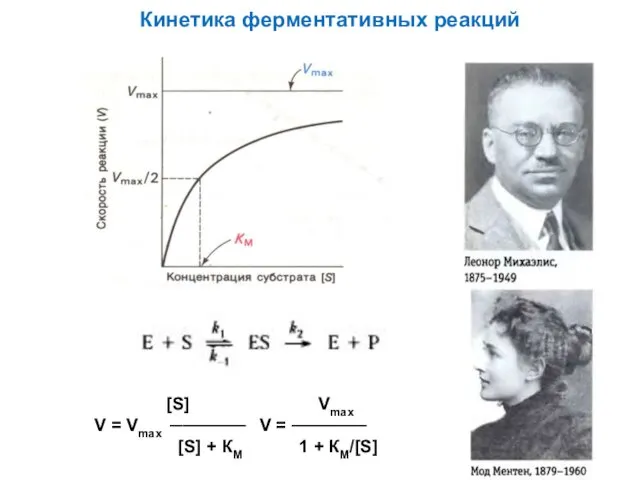 Кинетика ферментативных реакций
Кинетика ферментативных реакций Процессоры
Процессоры Андрій Чебикін
Андрій Чебикін Архитектура компьютера. Основные характеристики
Архитектура компьютера. Основные характеристики Правописание гласных -о- и -а- в корнях с чередованием
Правописание гласных -о- и -а- в корнях с чередованием Николай Николаевич Носов Приключения Незнайки и его друзей
Николай Николаевич Носов Приключения Незнайки и его друзей Особенности остеопатического сопровождения детей с головной болью в препубертатном периоде
Особенности остеопатического сопровождения детей с головной болью в препубертатном периоде Лес – это наше богатство
Лес – это наше богатство Информационная культура в непрерывном образовании личности. Комфортная информационная среда. (Тема 1)
Информационная культура в непрерывном образовании личности. Комфортная информационная среда. (Тема 1) Конституционное право России
Конституционное право России ТСТК Физические явления, рентген
ТСТК Физические явления, рентген Ассиро-финикийские корабли
Ассиро-финикийские корабли Презентация Папины профессии.
Презентация Папины профессии. Современные методы ортопедического лечения больных с дефектами твердых тканей с применением вкладок
Современные методы ортопедического лечения больных с дефектами твердых тканей с применением вкладок Шитикова В.А
Шитикова В.А Теорема Эйлера и правильные многогранники. 10 класс
Теорема Эйлера и правильные многогранники. 10 класс Washington is the capital of the United States of America
Washington is the capital of the United States of America Нейропсихологический механизм алалии как сложного речевого нарушения
Нейропсихологический механизм алалии как сложного речевого нарушения Методическая разработка Последнее письмо
Методическая разработка Последнее письмо Особенности установки различных операционных систем. Занятие 12
Особенности установки различных операционных систем. Занятие 12 Объединение компьютеров в локальную сеть
Объединение компьютеров в локальную сеть Конструкция насоса и типы ступеней
Конструкция насоса и типы ступеней Валова Софья 4 В класс - Гимназия 34 - Деревянное кружево УО
Валова Софья 4 В класс - Гимназия 34 - Деревянное кружево УО Ты и моё здоровье
Ты и моё здоровье Псориаз. Красный плоский лишай
Псориаз. Красный плоский лишай Презентация для игры к 23 февраля - 1 класс
Презентация для игры к 23 февраля - 1 класс Готовимся к ЕГЭ. Тест. Правописание приставок
Готовимся к ЕГЭ. Тест. Правописание приставок