Содержание
- 2. Рак группа заболеваний, характеризующая ненормальным и неконтролируемым ростом клеток; возникает в результате потери контроля над нормальным
- 3. Рак группа, состоящая из больше чем 100 различных особых заболеваний; процессы происходящие в различных типах опухолей
- 4. Рак – заболевание генома наличие в опухолевых тканях большого числа хромосомных перестроек, как численных изменений числа
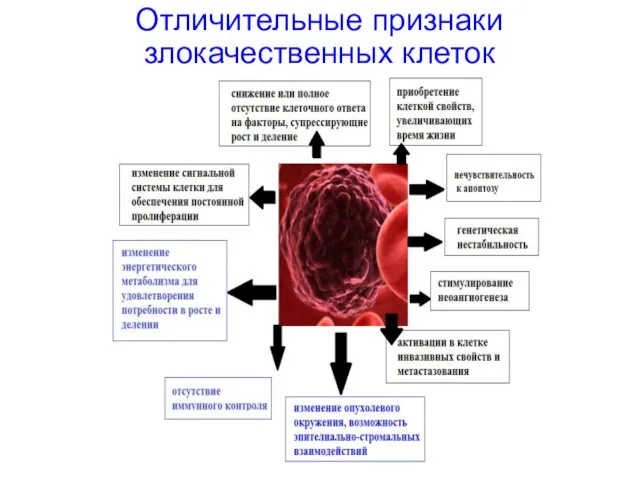
- 5. Отличительные признаки злокачественных клеток
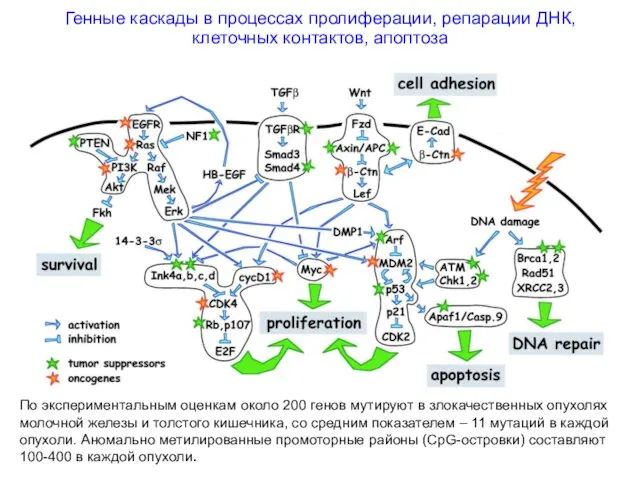
- 6. Генные каскады в процессах пролиферации, репарации ДНК, клеточных контактов, апоптоза По экспериментальным оценкам около 200 генов
- 7. Нестабильность генома – общее фундаментальное свойство опухолевых клеток Генетическая нестабильность: наличие изменений в хромосомах, как числа
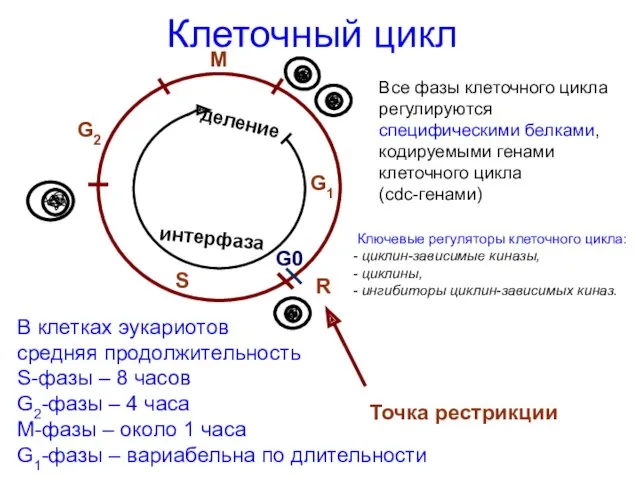
- 8. Клеточный цикл В клетках эукариотов средняя продолжительность S-фазы – 8 часов G2-фазы – 4 часа М-фазы
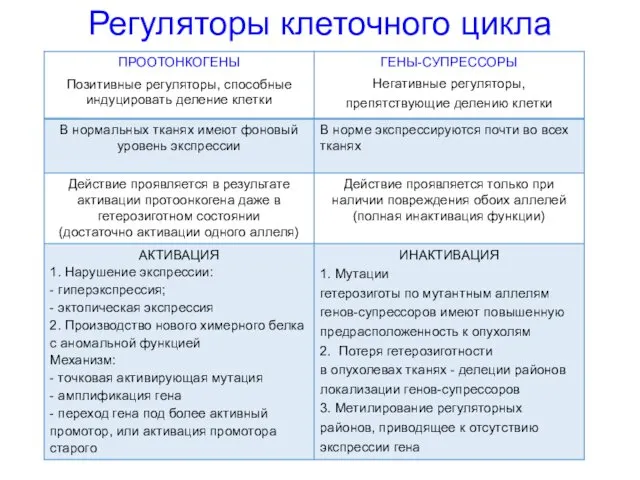
- 9. Регуляторы клеточного цикла
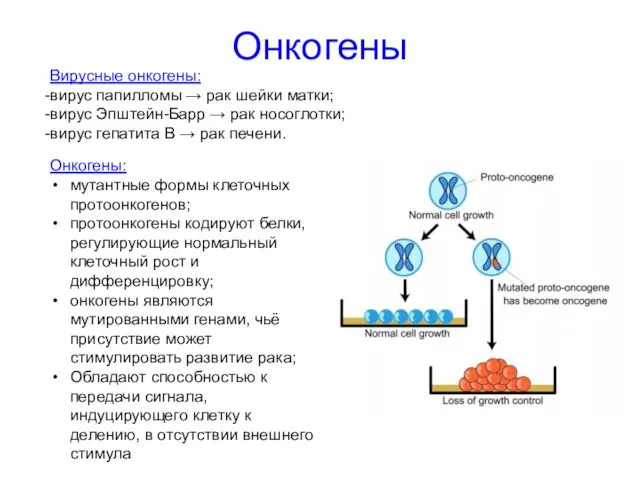
- 10. Онкогены Вирусные онкогены: вирус папилломы → рак шейки матки; вирус Эпштейн-Барр → рак носоглотки; вирус гепатита
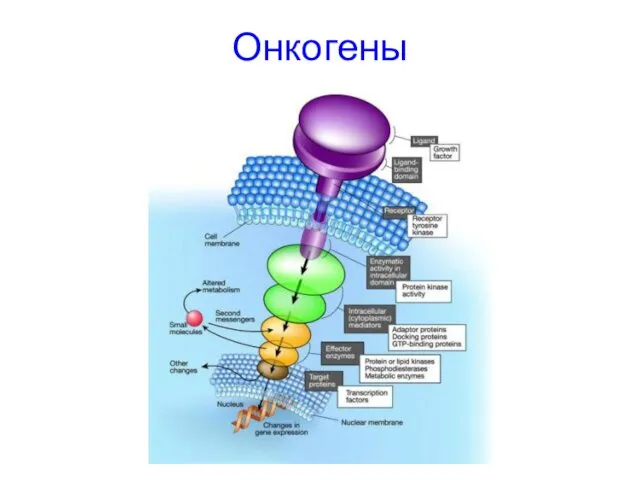
- 11. Онкогены Клеточные онкогены(протоонкогены): Факторы роста Тирозинкиназы Некиназные рецепторы G-белки ассоциированные с мембраной Цитоплазматические регуляторы Факторы транскрипции
- 12. Некоторые важные онкогены HER-2/neu кодирует клеточный рецептор, стимулирующий клеточное деление; амплифицирован в 30% случаев рака груди;
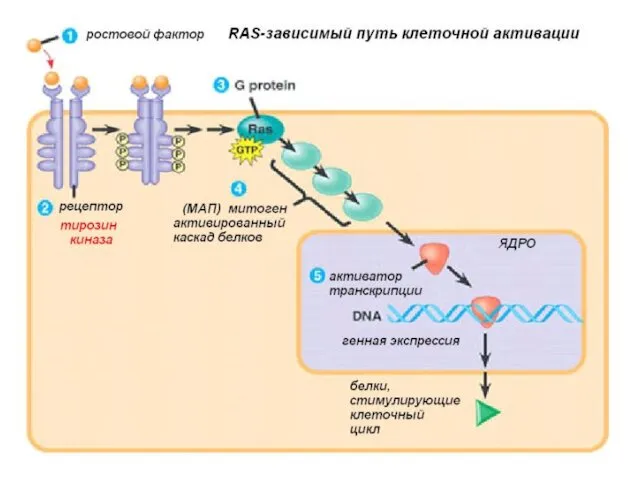
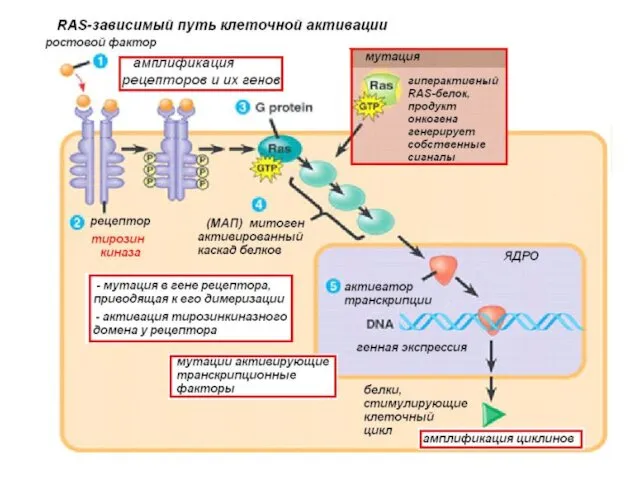
- 13. Онкогены
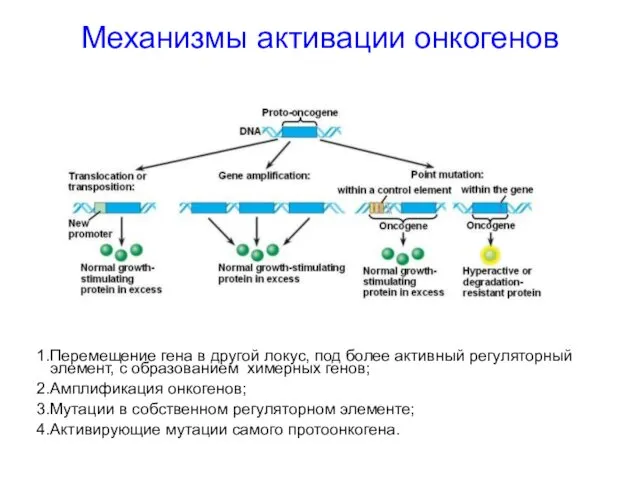
- 16. Механизмы активации онкогенов Перемещение гена в другой локус, под более активный регуляторный элемент, с образованием химерных
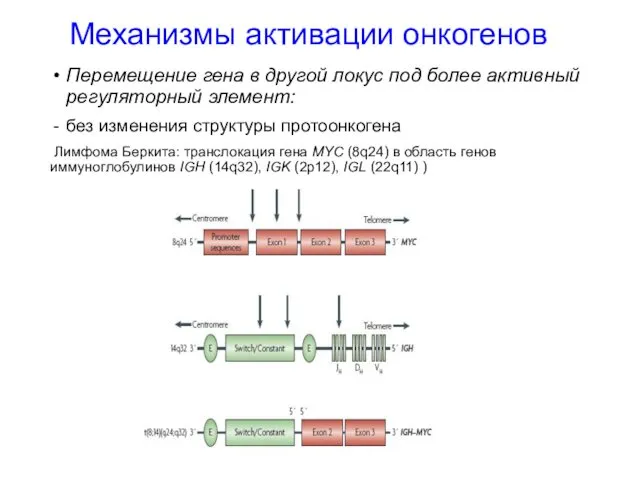
- 17. Механизмы активации онкогенов Перемещение гена в другой локус под более активный регуляторный элемент: без изменения структуры
- 18. Механизмы активации онкогенов Перемещение гена в другой локус под более активный регуляторный элемент: с образованием химерных
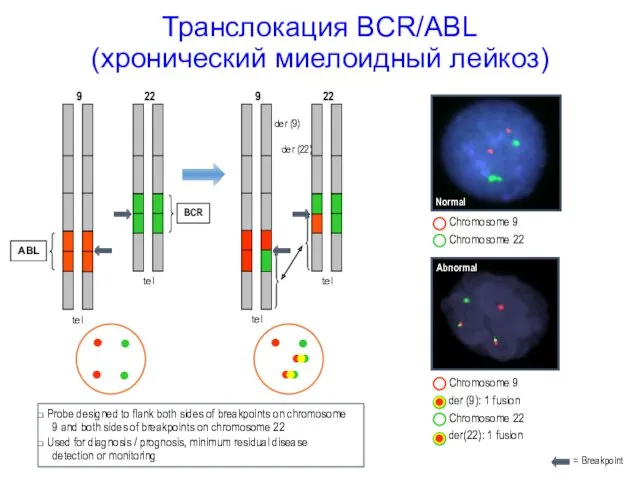
- 19. Транслокация BCR/ABL (хронический миелоидный лейкоз) ABL 9 22 BCR tel tel 9 22 tel tel der
- 20. Химерные онкогены Многие из перестроек характерны только для определенного типа заболевания: саркома Юинга (FLI1-EWSR1); неходжкинская лимфома
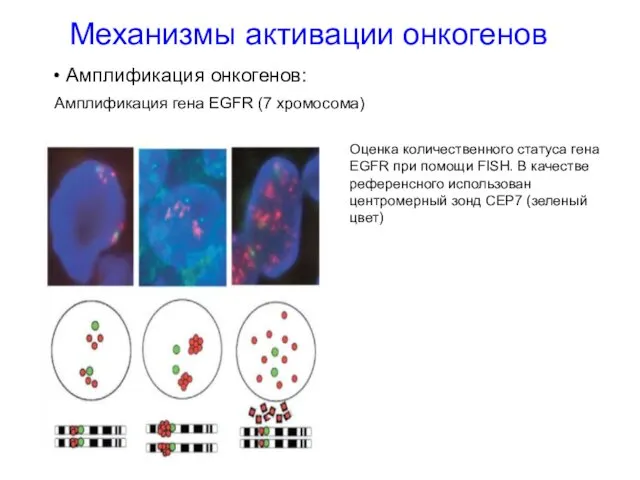
- 21. Механизмы активации онкогенов Амплификация онкогенов: Амплификация гена EGFR (7 хромосома) Оценка количественного статуса гена EGFR при
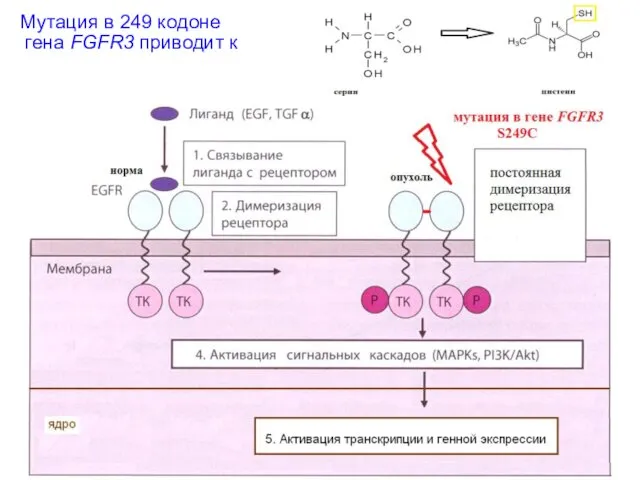
- 22. Механизмы активации онкогенов Мутации в собственном регуляторном элементе Активирующие мутации самого протоонкогена
- 23. Мутация в 249 кодоне гена FGFR3 приводит к
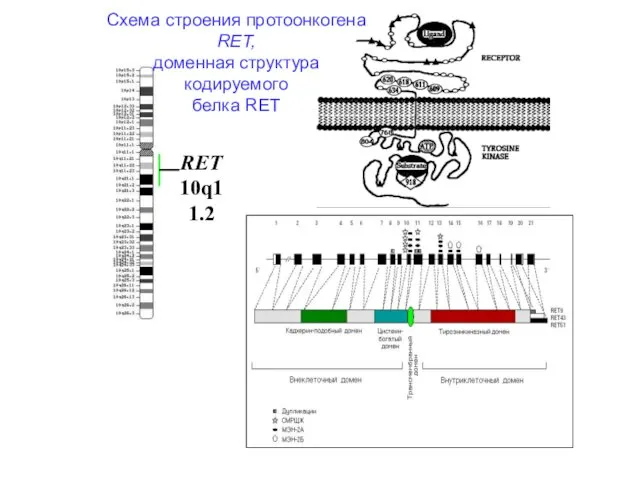
- 24. Ген RET кодирует рецепторную тирозинкиназу; экспрессия обнаруживается в тканях – производных нервного гребня, включая симпатические ганглии,
- 26. Схема строения протоонкогена RET, доменная структура кодируемого белка RET
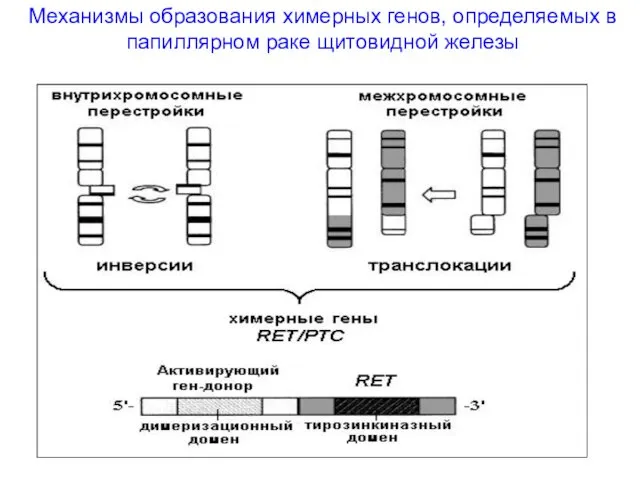
- 27. Механизмы образования химерных генов, определяемых в папиллярном раке щитовидной железы
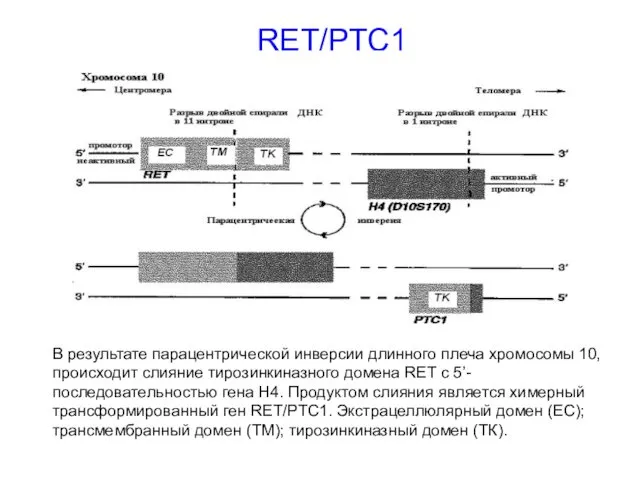
- 28. RET/PTC1 В результате парацентрической инверсии длинного плеча хромосомы 10, происходит слияние тирозинкиназного домена RET с 5’-последовательностью
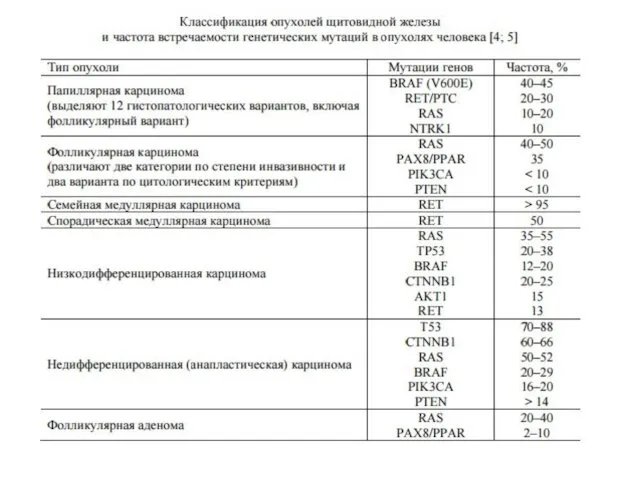
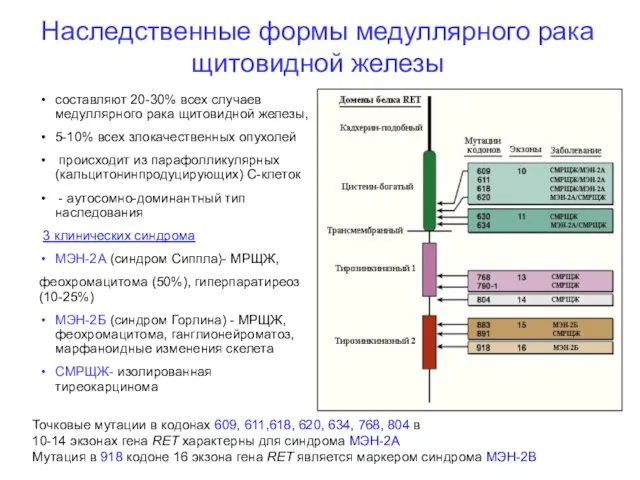
- 29. составляют 20-30% всех случаев медуллярного рака щитовидной железы, 5-10% всех злокачественных опухолей происходит из парафолликулярных (кальцитонинпродуцирующих)
- 30. МЭН-2А ( Синдром Сиппла) Синдром характеризуется наличием медуллярной карциномы щитовидной железы, феохромоцитомы (единичной, билатеральной или множественной)
- 31. При синдроме МЭН - 2Б, наряду с медуллярной карциномой щитовидной железы и феохромоцитомой наблюдаются множественные ганлионейромы
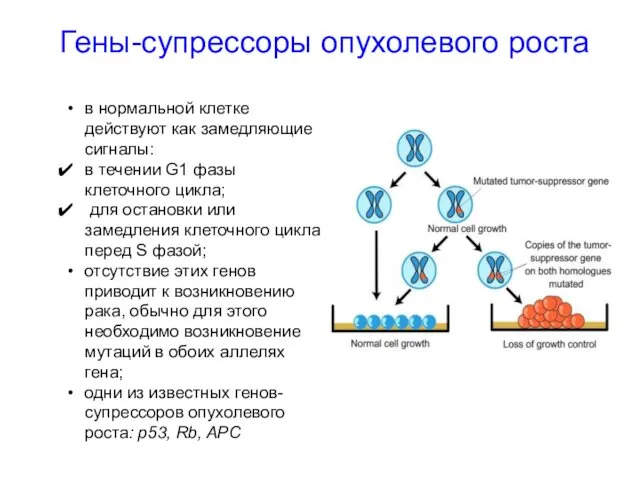
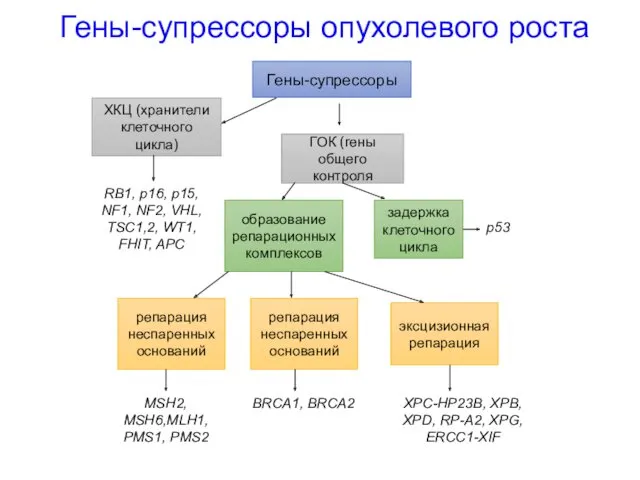
- 32. Гены-супрессоры опухолевого роста в нормальной клетке действуют как замедляющие сигналы: в течении G1 фазы клеточного цикла;
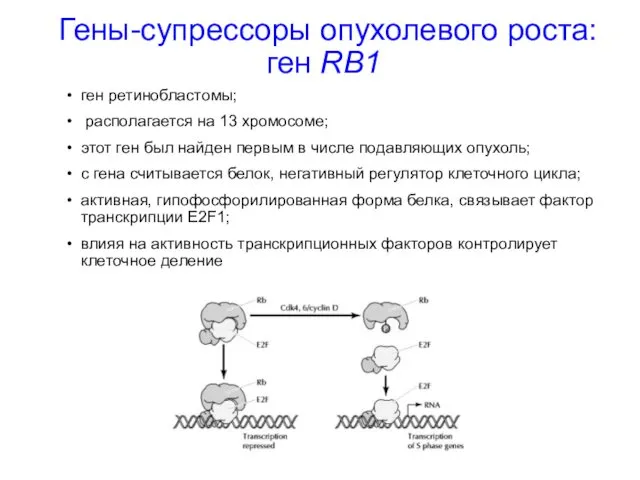
- 33. Гены-супрессоры опухолевого роста: ген RB1 ген ретинобластомы; располагается на 13 хромосоме; этот ген был найден первым
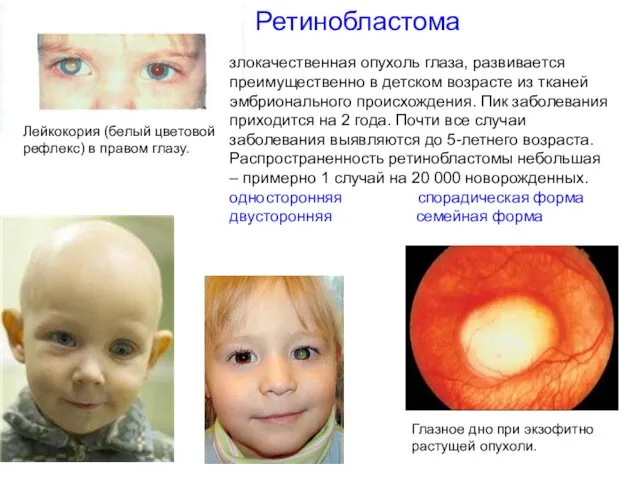
- 34. Ретинобластома Глазное дно при экзофитно растущей опухоли. Лейкокория (белый цветовой рефлекс) в правом глазу. злокачественная опухоль
- 35. Наследственная форма РБ: (10%)– мультифокальная опухоль; (2/3 случаев билатеральная), ранняя манифестация (до 1 года) Спорадическая форма
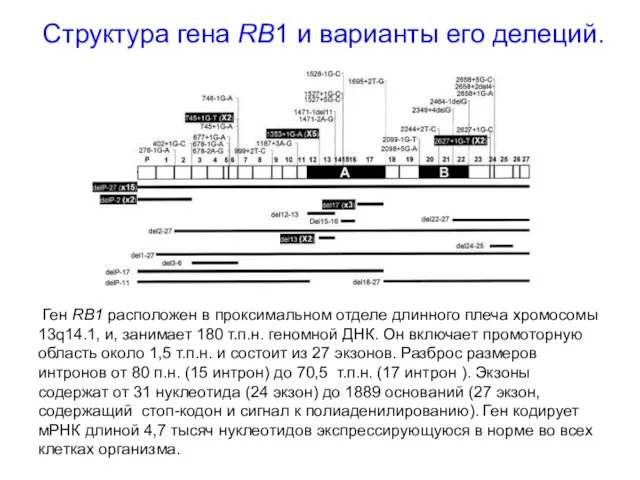
- 36. Структура гена RB1 и варианты его делеций. Ген RB1 расположен в проксимальном отделе длинного плеча хромосомы
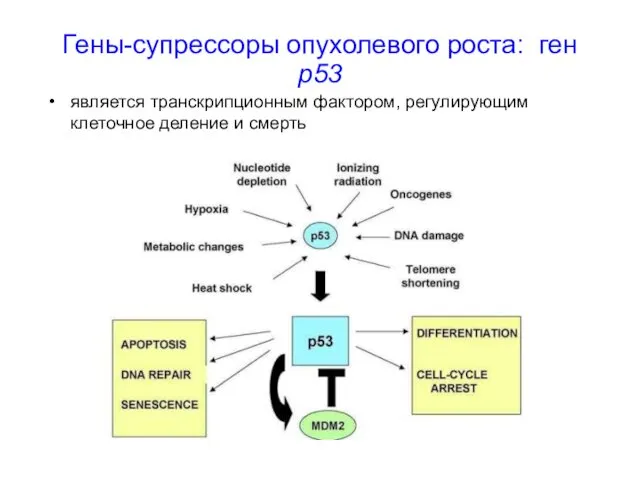
- 37. Гены-супрессоры опухолевого роста: ген р53 является транскрипционным фактором, регулирующим клеточное деление и смерть
- 38. Гены репарации ДНК эти гены обеспечивают аккуратное копирование каждой цепи ДНК во время деления клетки; мутации
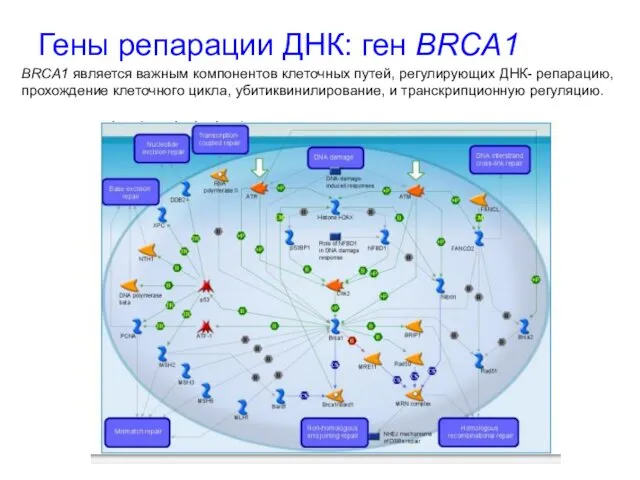
- 39. Гены репарации ДНК: ген BRCA1 BRCA1 является важным компонентов клеточных путей, регулирующих ДНК- репарацию, прохождение клеточного
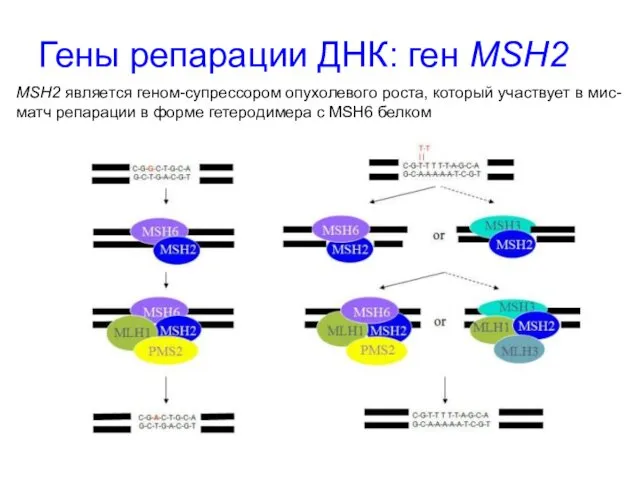
- 40. Гены репарации ДНК: ген MSH2 MSH2 является геном-супрессором опухолевого роста, который участвует в мис-матч репарации в
- 41. Гены-супрессоры опухолевого роста
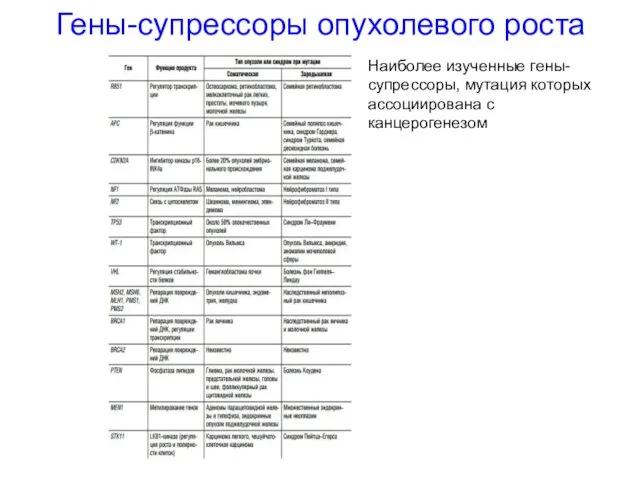
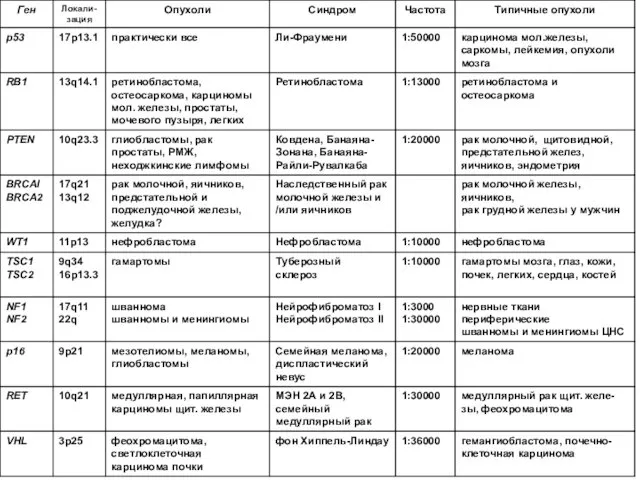
- 42. Гены-супрессоры опухолевого роста Наиболее изученные гены-супрессоры, мутация которых ассоциирована с канцерогенезом
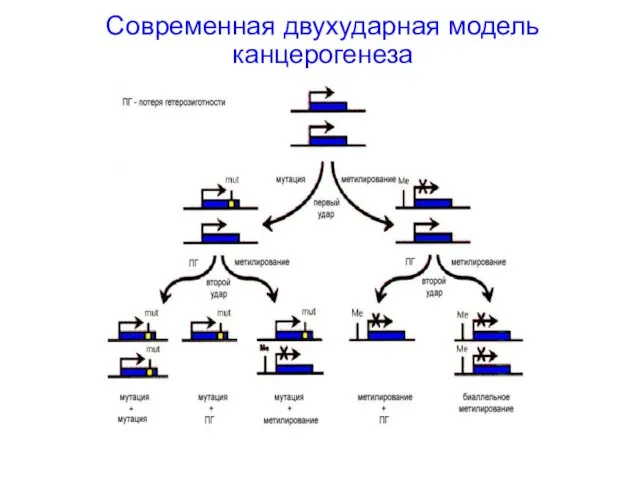
- 43. Современная двухударная модель канцерогенеза
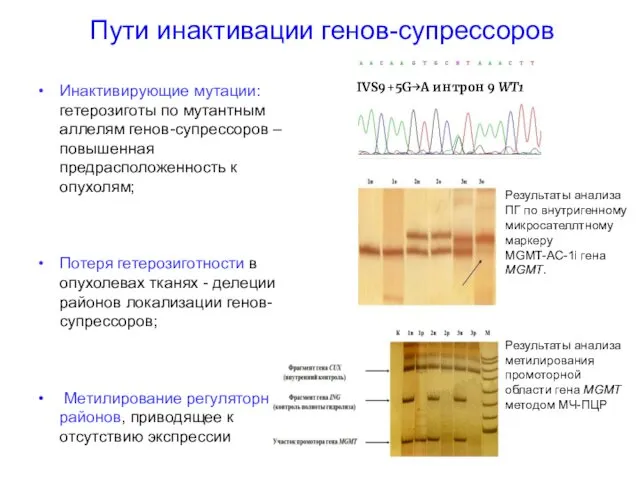
- 44. Пути инактивации генов-супрессоров Инактивирующие мутации: гетерозиготы по мутантным аллелям генов-супрессоров – повышенная предрасположенность к опухолям; Потеря
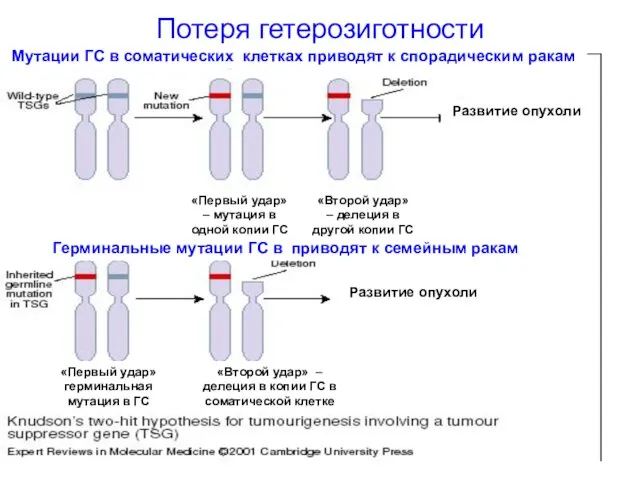
- 45. Потеря гетерозиготности Развитие опухоли Развитие опухоли Мутации ГС в соматических клетках приводят к спорадическим ракам Герминальные
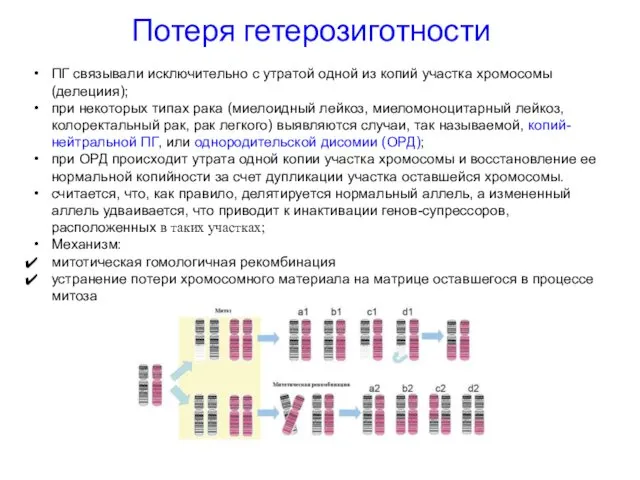
- 46. Потеря гетерозиготности ПГ связывали исключительно с утратой одной из копий участка хромосомы (делециия); при некоторых типах
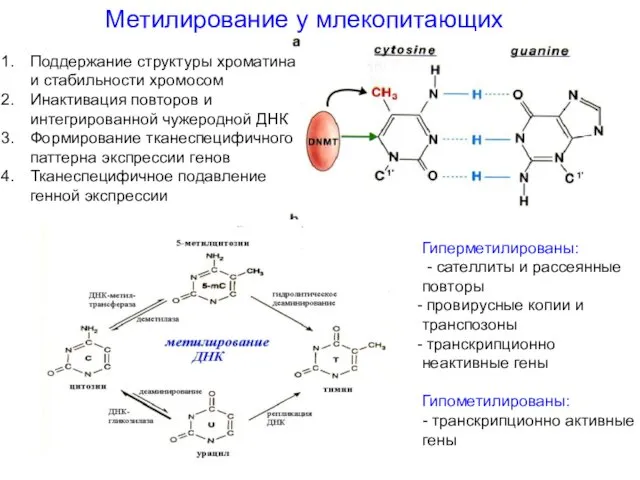
- 47. Метилирование у млекопитающих Поддержание структуры хроматина и стабильности хромосом Инактивация повторов и интегрированной чужеродной ДНК Формирование
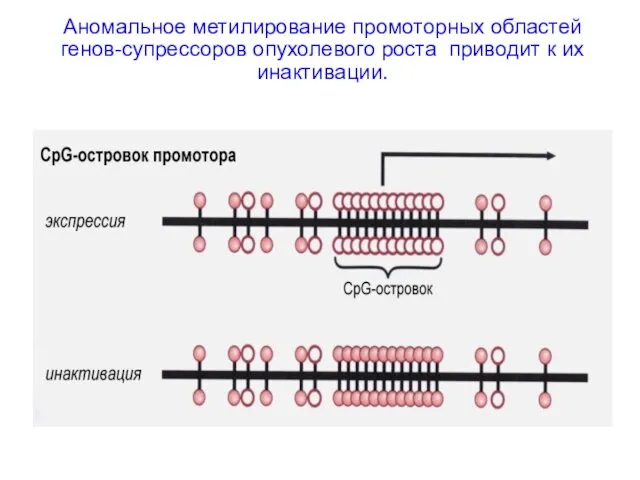
- 48. Аномальное метилирование промоторных областей генов-супрессоров опухолевого роста приводит к их инактивации.
- 49. Механизмы инактивации гена в результате метилирования промоторной области 1. Метильные группы нарушают ДНК-белковые взаимодействия, выступая в
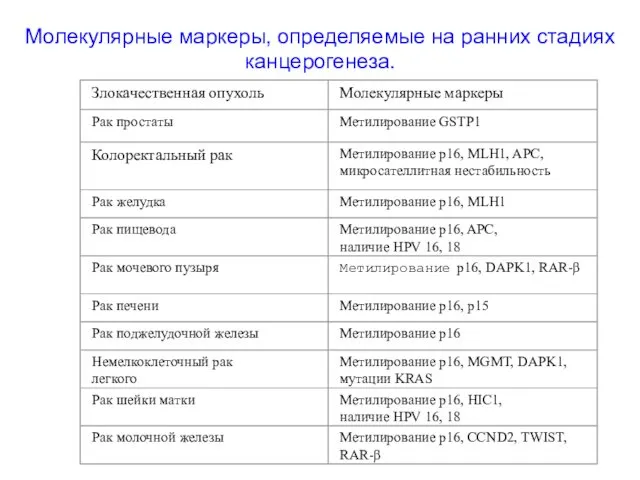
- 50. Молекулярные маркеры, определяемые на ранних стадиях канцерогенеза.
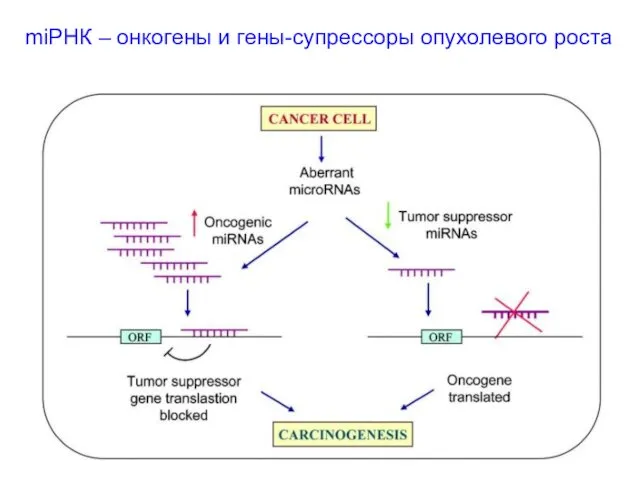
- 51. miРНК – онкогены и гены-супрессоры опухолевого роста
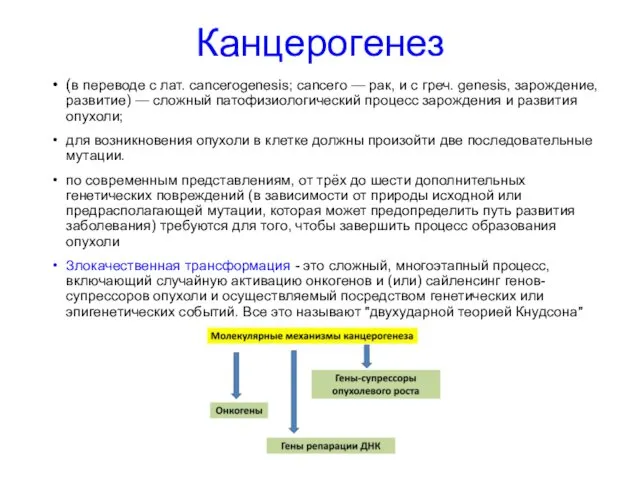
- 52. Канцерогенез (в переводе с лат. cancerogenesis; cancero — рак, и с греч. genesis, зарождение, развитие) —
- 53. Раковые клетки Мутации в генах, участвующих в канцерогенезе; Изменение экспрессии генов; Изменение эпигенетического профиля генома
- 54. Стволовые клетки рака (СКР) Джон Дик (Dick J. E., 1997) и его группа из университета Торонто
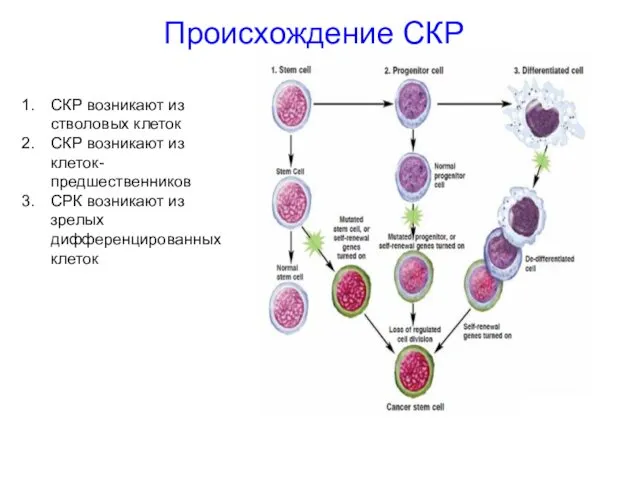
- 55. Происхождение СКР СКР возникают из стволовых клеток СКР возникают из клеток-предшественников СРК возникают из зрелых дифференцированных
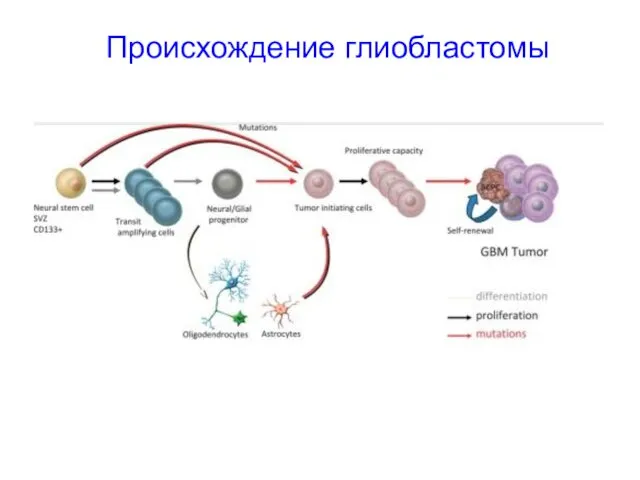
- 56. Происхождение глиобластомы
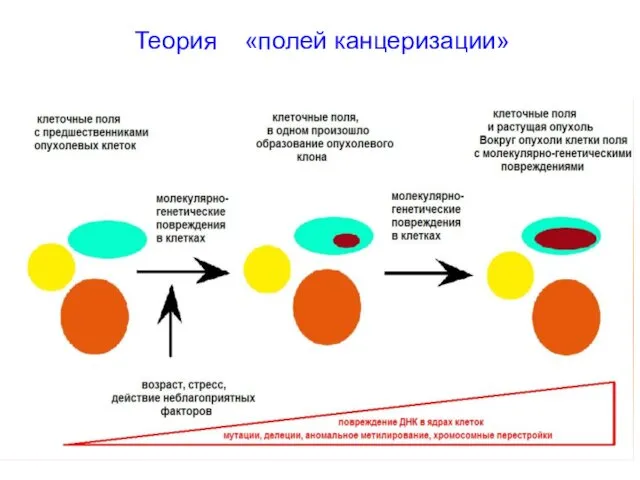
- 57. Теория «полей канцеризации»
- 59. Наследственные опухолевые синдромы – группа заболеваний, проявление которых заключается в передаче из поколения в поколение предрасположенности
- 61. Спасибо за внимание!
- 63. Скачать презентацию




















 Ұрықтың құрсақ ішілік дамуының тежелуі және жүктілікті жүргізу ерекшеліктері
Ұрықтың құрсақ ішілік дамуының тежелуі және жүктілікті жүргізу ерекшеліктері Творческий проект Приключения у новогодней елки
Творческий проект Приключения у новогодней елки Сенім дегеніміз не? Евр 11:1-2
Сенім дегеніміз не? Евр 11:1-2 мама
мама Профилактика виктимного поведения у обучающихся группы риска
Профилактика виктимного поведения у обучающихся группы риска Принципы построения отказоустойчивых информационных систем (ИС)
Принципы построения отказоустойчивых информационных систем (ИС) Циклические алгоритмы
Циклические алгоритмы Шаблон СГУ
Шаблон СГУ Библейские сказания. История Древнего мира
Библейские сказания. История Древнего мира Основы физиологии труда и комфортные условия жизнедеятельности
Основы физиологии труда и комфортные условия жизнедеятельности Новая линейка продуктов Micellife
Новая линейка продуктов Micellife Вода на земле
Вода на земле Внеурочная деятельность в 1 классе. Урок здоровья. Тема Наше здоровье
Внеурочная деятельность в 1 классе. Урок здоровья. Тема Наше здоровье A l’école
A l’école Акустика. Защита от шума. Акустическая перегородка. Материал на основе стеклянного штапельного волокна для звукоизоляции
Акустика. Защита от шума. Акустическая перегородка. Материал на основе стеклянного штапельного волокна для звукоизоляции Повышение эффективности работы компрессорной станции Еты - Пуровского месторождения
Повышение эффективности работы компрессорной станции Еты - Пуровского месторождения Люби и знай свой край родной
Люби и знай свой край родной Урок, география 6 класс Озера (ФГОС)
Урок, география 6 класс Озера (ФГОС) Презентация Мы - за здоровый образ жизни для проведения игры Поле чудес на внеурочной деятельности Здоровей-ка
Презентация Мы - за здоровый образ жизни для проведения игры Поле чудес на внеурочной деятельности Здоровей-ка Графические диктанты (Рисование по клеточкам) детям от 5 – 10 лет
Графические диктанты (Рисование по клеточкам) детям от 5 – 10 лет Беременность и роды при резус-несовместимости крови матери и плода
Беременность и роды при резус-несовместимости крови матери и плода Сервисный тренинг EXD06 Телефонный пакет rSAP Phaeton Телефонный пакет Touaregl
Сервисный тренинг EXD06 Телефонный пакет rSAP Phaeton Телефонный пакет Touaregl Изготовление ватных игрушек
Изготовление ватных игрушек Разработка рекомендаций по использованию солнечных батарей в условиях Республики Марий Эл
Разработка рекомендаций по использованию солнечных батарей в условиях Республики Марий Эл Общие сведения о полупроводниковых диодах (ППД)
Общие сведения о полупроводниковых диодах (ППД) Профилактика суицидальных тенденций среди несовершеннолетних в условиях урочной и внеурочной деятельности
Профилактика суицидальных тенденций среди несовершеннолетних в условиях урочной и внеурочной деятельности С Юбилеем, Любимый муж и папа!!!
С Юбилеем, Любимый муж и папа!!! Обобщающий урок по теме Африка. География. 7 класс
Обобщающий урок по теме Африка. География. 7 класс