Содержание
- 2. Обратимые и необратимые реакции. Обратимые химические реакции – это реакции, одновременно протекающие в прямом и обратном
- 3. Признаки необратимости. CuCl2 + 2KOH=Cu(OH)2↓ +2KOH – выпал осадок Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
- 4. Химическое равновесие. H2 + I2 ↔ 2HI Вернемся к обратимой реакции водорода с парами йода. В
- 5. Константа химического равновесия. H2 + I2 ↔ 2HI Состояние химического равновесия характеризуется особой величиной – константой
- 6. Величина константы равновесия характеризует полноту протекания обратимой реакции. Если Кравн >1, исходных реагентов в равновесной системе
- 7. Факторы, вызывающие смещение химического равновесия. Состояние химического равновесия может сохраняться долго при неизменных внешних условиях: температуры,
- 8. Историческая справка. Французский ученый- химик, занимался исследованиями процессов протекания химических реакций. Принцип смещения равновесий- самое известное,
- 9. Принцип Ле Шателье. Известен всюду на Земле Анри Луи Де Шателье. Он не был королем и
- 10. Изменение концентрации: 3H2 + N2 ↔ 2NH3 А) если увеличиваем концентрацию конечных продуктов, рав- новесие смещается
- 11. Изменение давления А) при увеличения давления равновесие смещается в сторону той реакции, при которой объем образовавшихся
- 12. Изменение температуры А) при повышении температуры химическое равновесие смещается в сторону эндотермической реакции. Б) при понижении
- 13. ВОПРОС 1. При повышении температуры равновесие системы смещается 2SO3 2SO2 + O2 - Q (в сторону
- 14. ВОПРОС 2. Каким образом можно сместить равновесие реакции в сторону исходных веществ (все в-ва – газы):
- 15. ВОПРОС 3. При повышении давления равновесие реакции смещается 2SO3 2SO2 + O2 - Q (в сторону
- 16. ВОПРОС 4. Каким образом можно сместить равновесие в сторону продуктов реакции SO2 + 2H2S 3S +
- 17. ВОПРОС 5. При уменьшении концентрации SO2 равновесие реакции смещается H2SO3 SO2 + H2O -Q (в сторону
- 18. ВОПРОС 6. При повышении температуры равновесие реакции сместится 2ZnS + O2 2ZnO + H2O + Q
- 19. Задача 4. Как сместиться химическое равновесие реакции 2СО + О2 ↔ 2СО2 + Q при а)
- 20. Задания 1. Условие необратимости химического превращения. а) образование слабого электролита б) поглощение большого количества теплоты в)
- 22. Скачать презентацию
 Системно-деятельностный подход в развитии связной речи у детей с тяжелым нарушением речи
Системно-деятельностный подход в развитии связной речи у детей с тяжелым нарушением речи Методы увеличения производительности скважин. Управление продуктивностью скважин. Лекция № 1
Методы увеличения производительности скважин. Управление продуктивностью скважин. Лекция № 1 Непрерывность функции. Метод интервалов
Непрерывность функции. Метод интервалов Микрогосударства Западной Европы
Микрогосударства Западной Европы Человек, общество, природа
Человек, общество, природа Зародження описового мовознавства
Зародження описового мовознавства ИОННОЕ АЗОТИРОВАНИЕ
ИОННОЕ АЗОТИРОВАНИЕ Большие планеты Солнечной системы
Большие планеты Солнечной системы Рождество Христово. 7 Января
Рождество Христово. 7 Января Эксплуатация баллонов, предназначенных для сжатых, сжиженных и растворенных под давлением газов
Эксплуатация баллонов, предназначенных для сжатых, сжиженных и растворенных под давлением газов Виды и типы портрета
Виды и типы портрета Острое токсико-инфекционное заболевание - ботулизм
Острое токсико-инфекционное заболевание - ботулизм Управление проектами. Инвестиционная фаза
Управление проектами. Инвестиционная фаза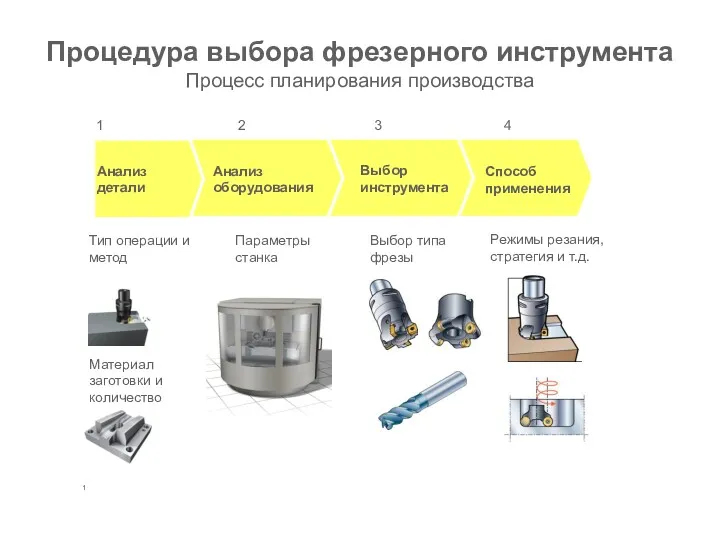 Фрезерование. Выбор фрезерного инструмента
Фрезерование. Выбор фрезерного инструмента Физкультминутка к уроку татарского языка Диск
Физкультминутка к уроку татарского языка Диск Телефон доверия для детей и подростков, и их родителей
Телефон доверия для детей и подростков, и их родителей Алғашқы көмек көрсету
Алғашқы көмек көрсету Медицинада қателіктердің таралуы.Қателіктердің себептері. Қолайсыз нәтиже: қайтымсыз, қайтымды
Медицинада қателіктердің таралуы.Қателіктердің себептері. Қолайсыз нәтиже: қайтымсыз, қайтымды Портфолио ученика Диск
Портфолио ученика Диск Шишкин И.И
Шишкин И.И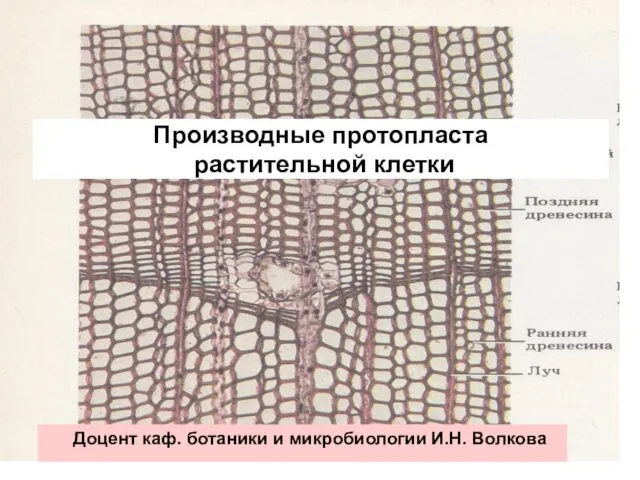 Производные протопласта растительной клетки
Производные протопласта растительной клетки Этапы урока. Методика преподавания иностранного языка
Этапы урока. Методика преподавания иностранного языка Кастрационно-рефрактерный рак предстательной железы
Кастрационно-рефрактерный рак предстательной железы Русская культура конца 20-го века
Русская культура конца 20-го века Внешнее и внутреннее устройство, архитектура и символика православного храма
Внешнее и внутреннее устройство, архитектура и символика православного храма Сатылым алып келетін видео
Сатылым алып келетін видео Влияние информации на психику детей и подростков
Влияние информации на психику детей и подростков Компьютерная презентация практических достижений профессиональной деятельности (методический семинар)
Компьютерная презентация практических достижений профессиональной деятельности (методический семинар)