Содержание
- 2. План Электролиты и неэлектролиты. Электролитическая диссоциация. Механизмы электролитической диссоциации для веществ с различными типами химической связи.
- 3. Решить задачу: В 215 г воды растворили 25 г соли. Вычислите массовую долю растворенного вещества. Дано:
- 4. Решение: m (соли) 25 г 25 1) Ѡ (соли) = ------------------------ = -------------- = --------- =
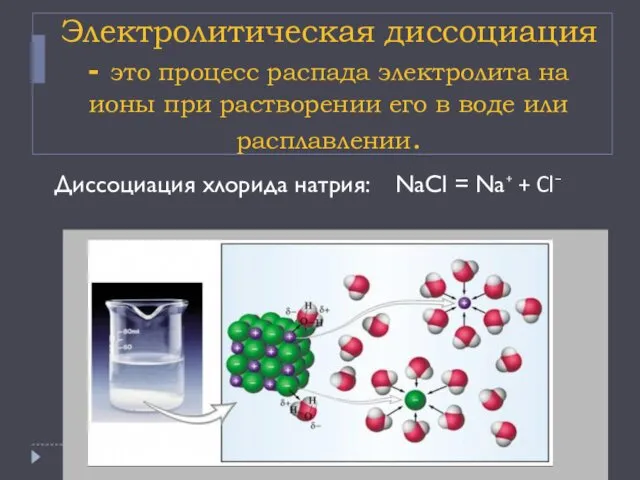
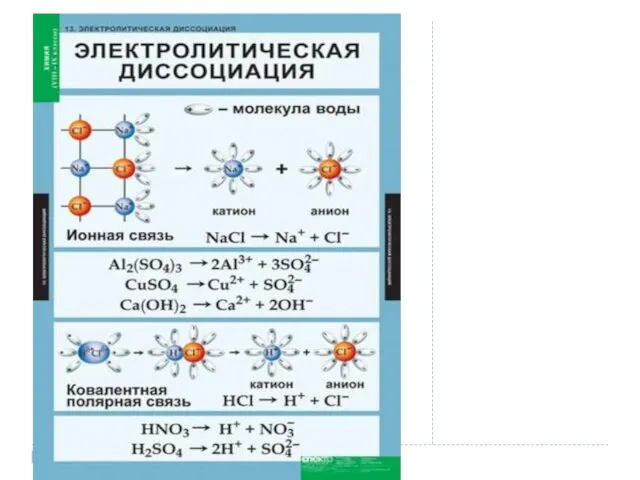
- 5. Электролитическая диссоциация - это процесс распада электролита на ионы при растворении его в воде или расплавлении.
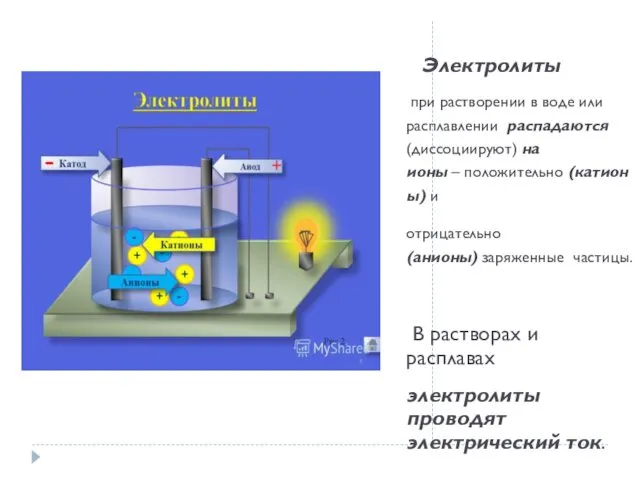
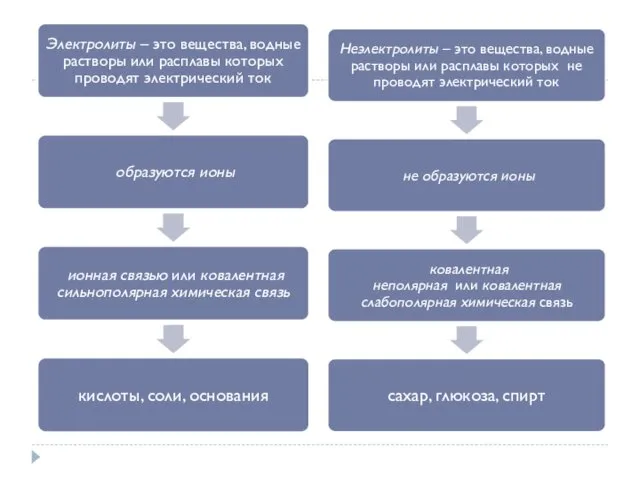
- 6. Электролиты при растворении в воде или расплавлении распадаются (диссоциируют) на ионы – положительно (катионы) и отрицательно
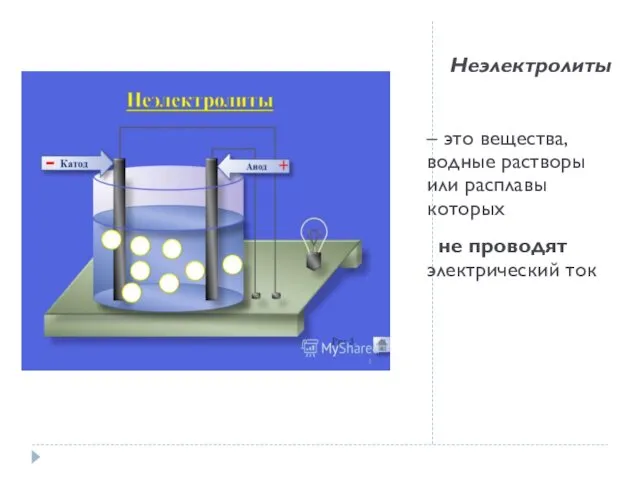
- 7. Неэлектролиты – это вещества, водные растворы или расплавы которых не проводят электрический ток
- 10. Диссоциация кислот Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода (H
- 11. Диссоциация оснований (щелочей) Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH
- 12. Диссоциация солей Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион аммония (NH+4)
- 13. ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ №1. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: HF,
- 14. ЗАДАНИЕ ДЛЯ ЗАКРЕПЛЕНИЯ №2. Используя таблицу растворимости солей, кислот, оснований напишите уравнения диссоциации следующих веществ: Ca(OH)2
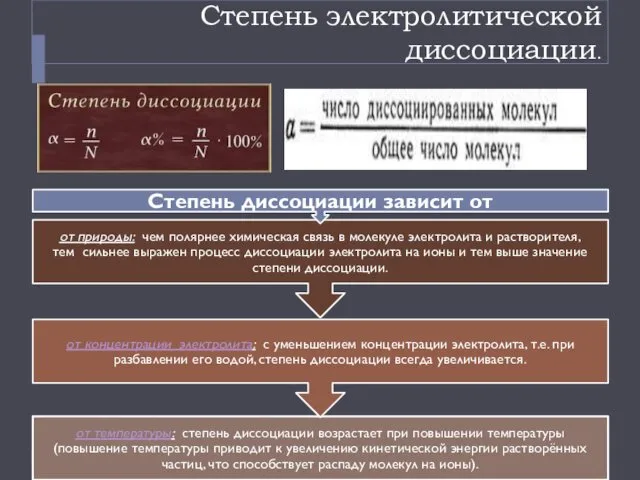
- 15. Степень электролитической диссоциации.
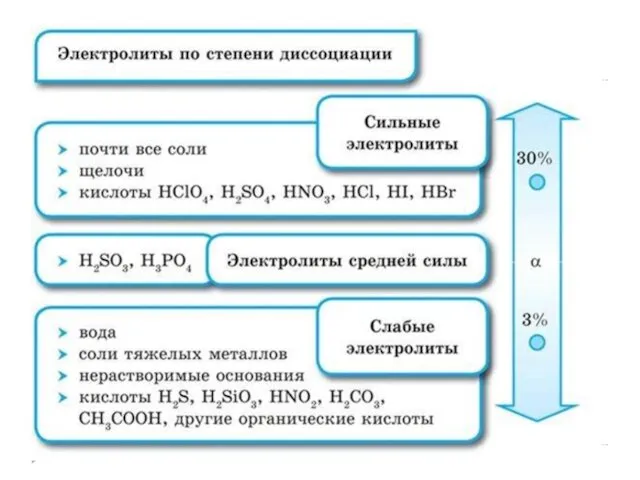
- 16. электролиты сильные слабые α>30% 1. Растворимые соли; 2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.));
- 19. Скачать презентацию









 Коррекционно-развивающие упражнения (конструктор для составления заданий).
Коррекционно-развивающие упражнения (конструктор для составления заданий). Презентация педагогического опыта
Презентация педагогического опыта Давайте познакомимся!
Давайте познакомимся! Технология WEB 1.0, WEB. 2.0, WEB 3.0
Технология WEB 1.0, WEB. 2.0, WEB 3.0 Свойства равнобедренного треугольника
Свойства равнобедренного треугольника Функциональная межполушарная асимметрия
Функциональная межполушарная асимметрия КОМИТЕТ-ОБРАЗОВАНИЯ-И-НАУКИ-КУРСКОЙ-ОБЛАСТИ
КОМИТЕТ-ОБРАЗОВАНИЯ-И-НАУКИ-КУРСКОЙ-ОБЛАСТИ : Новогодние игрушки – шарики, хлопушки!!!
: Новогодние игрушки – шарики, хлопушки!!! Отчет о летней оздоровительной работе. Гр.: Боровичок
Отчет о летней оздоровительной работе. Гр.: Боровичок Тепловая карта ОМП 01.2024
Тепловая карта ОМП 01.2024 URTA - traditional buryatskoe housing
URTA - traditional buryatskoe housing Крестовые походы и инквизиция
Крестовые походы и инквизиция Введение курс электроники
Введение курс электроники Проект Зоопарк
Проект Зоопарк Как стать личностью
Как стать личностью Поиск научной информации в интернете
Поиск научной информации в интернете логопедия
логопедия Тема Отечественной войны 1812 года в русской литературе начала XIX века
Тема Отечественной войны 1812 года в русской литературе начала XIX века Оксиды азота (II и IV). Азотная кислота. Строение молекулы
Оксиды азота (II и IV). Азотная кислота. Строение молекулы Лучевой дренаж
Лучевой дренаж Сүйек. Эктопиялық дамуы
Сүйек. Эктопиялық дамуы Простые эфиры. Сложные эфиры. Тема 8
Простые эфиры. Сложные эфиры. Тема 8 кружки
кружки Презентация к итоговому родительскому собранию. 2 класс
Презентация к итоговому родительскому собранию. 2 класс Лекция 1. Общая химия. Химическая термодинамика. Термохимия
Лекция 1. Общая химия. Химическая термодинамика. Термохимия Персонажи славянской мифологии, связанные с повседневной жизнью людей
Персонажи славянской мифологии, связанные с повседневной жизнью людей Аңыз әңгімелер
Аңыз әңгімелер Концепция и практический опыт построения цифровой энергетики в АО БЭСК
Концепция и практический опыт построения цифровой энергетики в АО БЭСК