Содержание
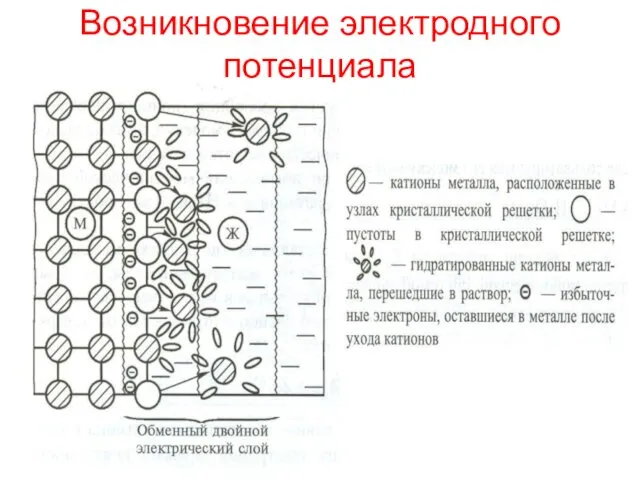
- 2. Возникновение электродного потенциала
- 3. Стандартный водородный электрод (р=1 атм) H2, Pt | H+ (a=1) 2H+ + 2e– → H2 ϕ0
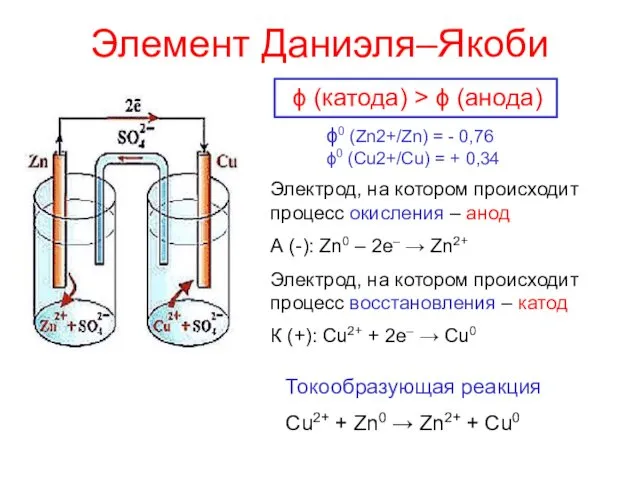
- 4. Элемент Даниэля–Якоби Электрод, на котором происходит процесс окисления – анод А (-): Zn0 – 2e– →
- 5. Электрохимическая цепь ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ – ЯКОБИ A(–) Zn | ZnSO4(C1) || KCl || CuSO4(C2) |
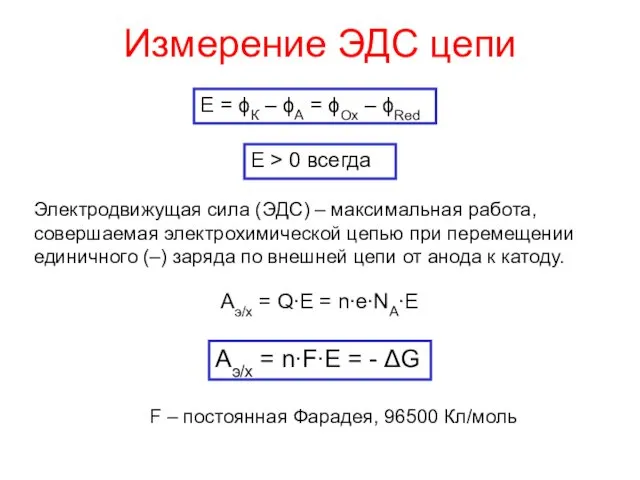
- 6. Измерение ЭДС цепи E = ϕК – ϕА = ϕOx – ϕRed Электродвижущая сила (ЭДС) –
- 7. Направление протекания ОВР ΔG = – Аэ/х = – n∙F∙E ∆G 0 самопроизвольная реакция ∆G >
- 8. Уравнение Нернста Ox + ne– → Red
- 9. Задачи 1) Вычислите ЭДС гальванического элемента: Cu | CuSO4 (1 M) || AgNO3 (0,1 M) |
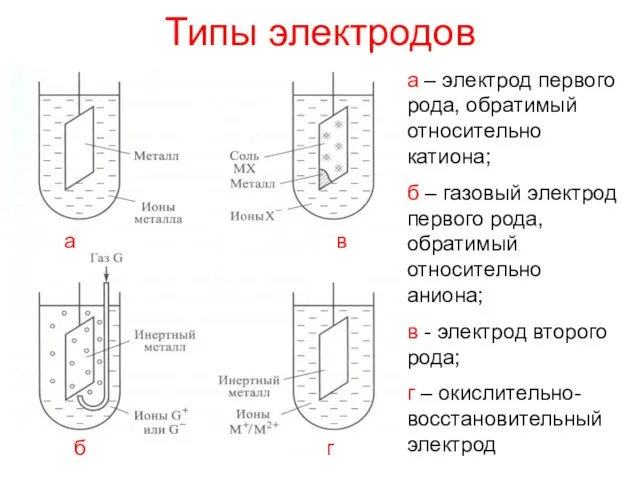
- 10. Типы электродов а – электрод первого рода, обратимый относительно катиона; б – газовый электрод первого рода,
- 11. Зависимость ЭДС от рН среды MnO4– + 5e– + 8H+ → Mn2+ + 4H2O Если а(MnO4–)
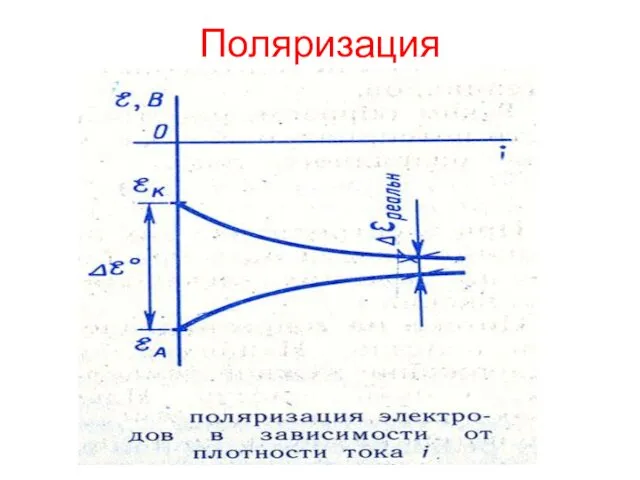
- 12. Поляризация
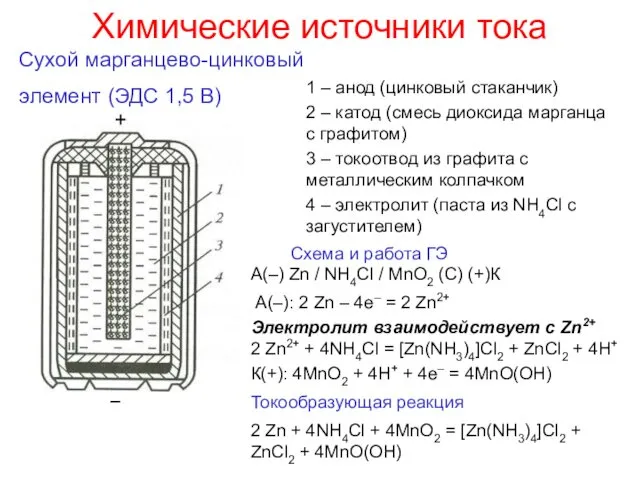
- 13. Химические источники тока Сухой марганцево-цинковый элемент (ЭДС 1,5 В) А(–) Zn / NH4Cl / MnO2 (C)
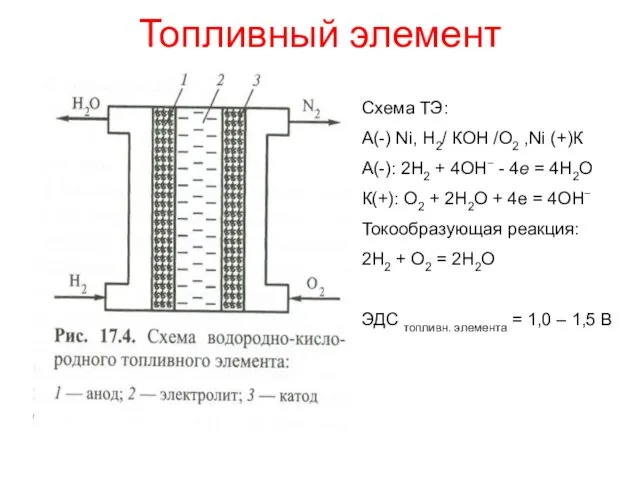
- 14. Топливный элемент Схема ТЭ: А(-) Ni, Н2/ КОН /О2 ,Ni (+)К А(-): 2Н2 + 4ОН− -
- 16. Скачать презентацию






 Охорона навколишнього середовища від забруднень під час переробки вуглеводневої сировини
Охорона навколишнього середовища від забруднень під час переробки вуглеводневої сировини Крем Cromakey-in
Крем Cromakey-in Перемешивание материалов
Перемешивание материалов Химия, химия, химия!
Химия, химия, химия! Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул
Галогенопохідні вуглеводнів. Ізомерія органічних сполук. Просторова будова молекул Поверхностные воды Беларуси. Реки и каналы
Поверхностные воды Беларуси. Реки и каналы Правовая ответственность в работе специалистов со средним профессиональным образованием
Правовая ответственность в работе специалистов со средним профессиональным образованием компетентность учителя
компетентность учителя N-арные деревья
N-арные деревья Презентация Сад-огород
Презентация Сад-огород Методы социологических исследований
Методы социологических исследований Химия как часть естествознания
Химия как часть естествознания Мы выступаем в районе
Мы выступаем в районе Звонкие и глухие двойняшки.
Звонкие и глухие двойняшки. Воспитание, как компонент целостного педагогического процесса
Воспитание, как компонент целостного педагогического процесса Белки, входящие в состав живых организмов
Белки, входящие в состав живых организмов Тренажёры для формирования навыков счета Диск Диск
Тренажёры для формирования навыков счета Диск Диск Исследовательская работа по теме Естественные методы защиты растений
Исследовательская работа по теме Естественные методы защиты растений Роль науки в современном мире. 5 класс
Роль науки в современном мире. 5 класс Інженерне обладнання міських вулиць і доріг
Інженерне обладнання міських вулиць і доріг Тест - презентация по теме ТЭД, 9 класс
Тест - презентация по теме ТЭД, 9 класс проблемное обучение
проблемное обучение Организация физминуток, как средство здоровьесбережения
Организация физминуток, как средство здоровьесбережения Решение задач по теме: Механическая работа и мощность
Решение задач по теме: Механическая работа и мощность Знакомство с персональным компьютером
Знакомство с персональным компьютером С днем смеха
С днем смеха Интеллектуальный марафон - 18 (2 класс)
Интеллектуальный марафон - 18 (2 класс) Relative pronouns & adverbs
Relative pronouns & adverbs