Содержание
- 2. Сероводород H2S Физические свойства: 1) газ без цвета, с характерным запахом гниющего белка, сладковатым вкусом; 2)немного
- 3. Сероводород H2S Получение: S + H2 = H2S FeS + 2HCl = FeCl2 + H2S↑ Химические
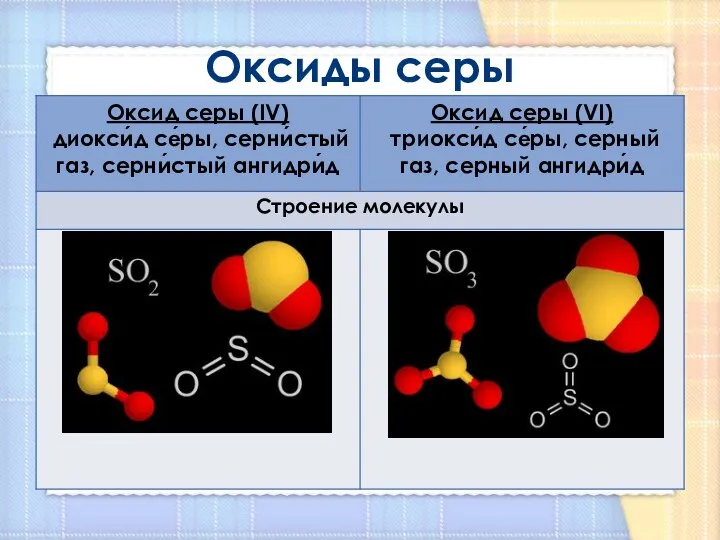
- 4. Оксиды серы
- 5. t t t
- 8. олеум
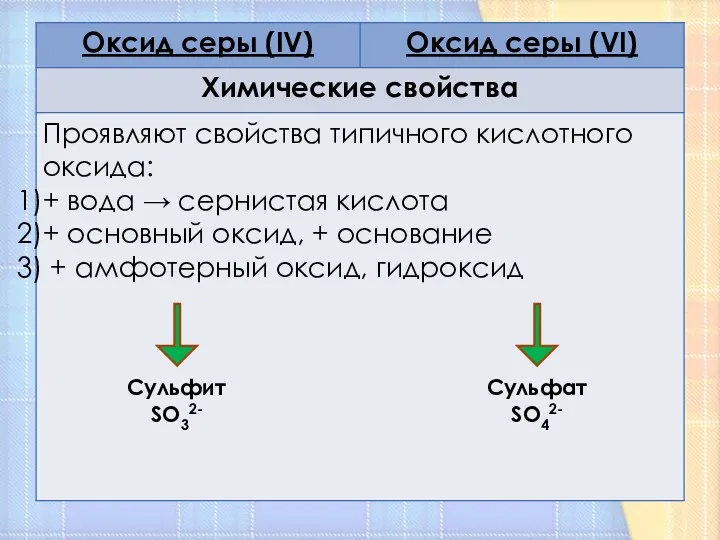
- 9. Сульфит SO32- Сульфат SO42-
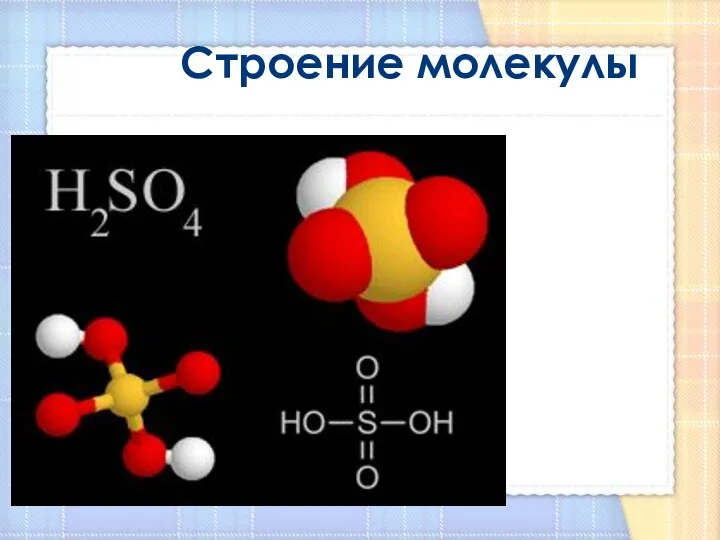
- 10. Строение молекулы
- 11. Химические свойства
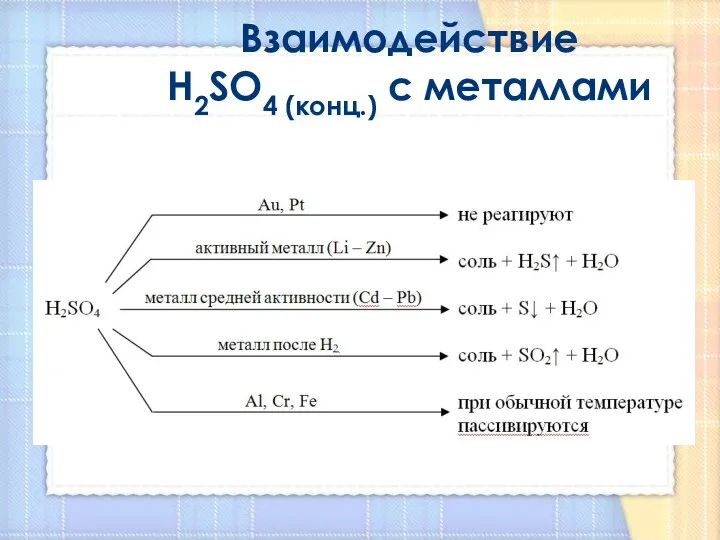
- 12. Взаимодействие H2SO4 (конц.) с металлами
- 14. Скачать презентацию







 Становление наук о человеке
Становление наук о человеке Античная философия
Античная философия Беременность и заболевания сердечно-сосудистой системы. Лекция 7
Беременность и заболевания сердечно-сосудистой системы. Лекция 7 Який сміх – така й людина!
Який сміх – така й людина! Звуковая презентация Узнай звук
Звуковая презентация Узнай звук Региональные экономические интеграционные группировки
Региональные экономические интеграционные группировки Водные виды адаптивной двигательной рекреации
Водные виды адаптивной двигательной рекреации Компьютер и здоровье школьника
Компьютер и здоровье школьника Презентация к внеклассному мероприятию Что значит быть хорошим сыном или дочерью.
Презентация к внеклассному мероприятию Что значит быть хорошим сыном или дочерью. Теория коллектива
Теория коллектива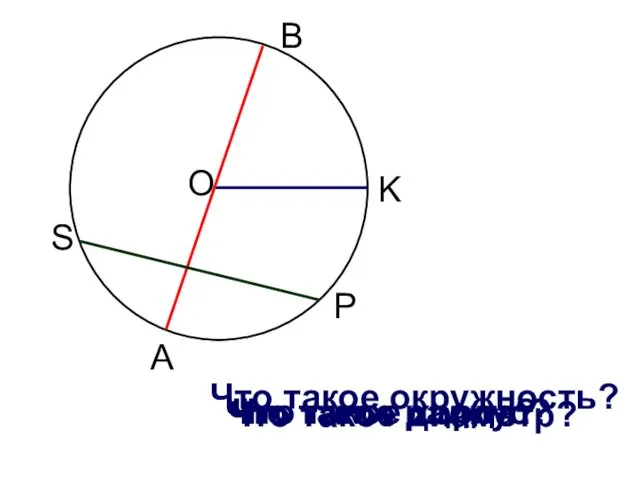 Взаимное расположение прямой и окружности
Взаимное расположение прямой и окружности Педагогика: анализ основных теоретических аспектов
Педагогика: анализ основных теоретических аспектов Потребности человека
Потребности человека Материки Южного полушария.
Материки Южного полушария. Рекламное агентство Wieden+Kennedy
Рекламное агентство Wieden+Kennedy The teacher of the year contest Master Class Roman Kovshik
The teacher of the year contest Master Class Roman Kovshik Применение неметаллических композиционных материалов (НМКМ) в твердотопливных ракетных двигателях (РДТТ)
Применение неметаллических композиционных материалов (НМКМ) в твердотопливных ракетных двигателях (РДТТ) Новый год в России
Новый год в России Поршневые насосы
Поршневые насосы Людям планеты-мир без тревог и слез
Людям планеты-мир без тревог и слез Викторина на знание вселенной Gachimuchi
Викторина на знание вселенной Gachimuchi Ветеринарно-санитарная оценка кормов для промышленного производства
Ветеринарно-санитарная оценка кормов для промышленного производства Знакомство с Интернетом. Браузеры. Безопасная работа в Интернете. 7 класс
Знакомство с Интернетом. Браузеры. Безопасная работа в Интернете. 7 класс Доклад о результатах служебной деятельности Управления по конвоированию за 1 полугодие 2017 год
Доклад о результатах служебной деятельности Управления по конвоированию за 1 полугодие 2017 год Прощальная беседа Иисуса Христа с учениками
Прощальная беседа Иисуса Христа с учениками Антарктида.2
Антарктида.2 Лассификация альтернативных топлив. Сжиженные и сжатые газы
Лассификация альтернативных топлив. Сжиженные и сжатые газы Презентация МАСТЕР – КЛАСС по пластичной замше
Презентация МАСТЕР – КЛАСС по пластичной замше