Содержание
- 2. Тема занятия. Микропараметры вещества Молекулярная физика Основы МКТ План занятия 2. Размеры молекул. 3. Число молекул.
- 3. «Кроме того, потому обратить тебе надо вниманье На суматоху в телах, мелькающих в Солнечном свете, Что
- 4. Что является первоосновой материи Аристотель (IV в. до н.э.) - земля, огонь, вода, воздух Фалес Милетский
- 5. СОЗДАТЕЛИ АТОМНОЙ ТЕОРИИ Джон Дмитрий Дальтон Менделеев Амедео Эрнест Авогадро Резерфорд
- 6. Микропараметры вещества характеризуют каждую частицу вещества в отдельности, в отличие от макропараметров, характеризующих вещество в целом.
- 7. Основные положения МКТ • Все тела состоят из малых частиц, между которыми есть промежутки. • Частицы
- 8. ПЕРВОЕ ПОЛОЖЕНИЕ 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц –
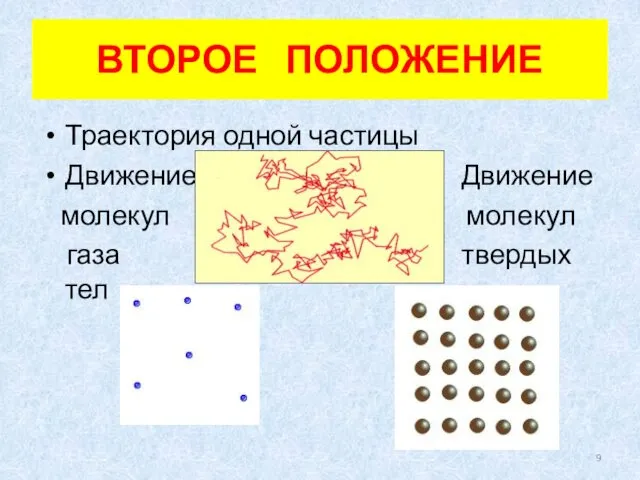
- 9. ВТОРОЕ ПОЛОЖЕНИЕ Траектория одной частицы Движение Движение молекул молекул газа твердых тел
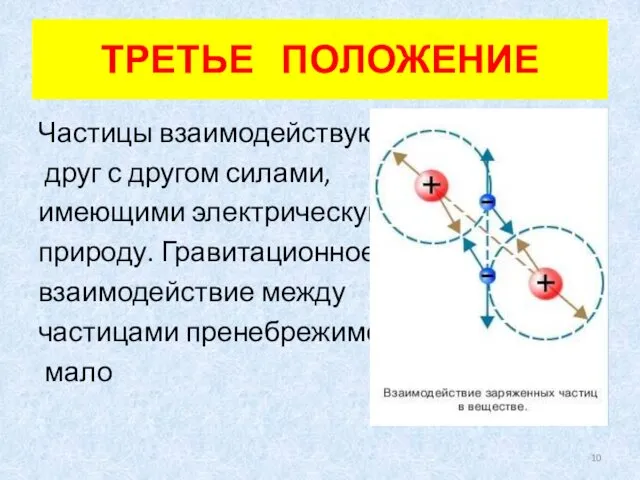
- 10. ТРЕТЬЕ ПОЛОЖЕНИЕ Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо
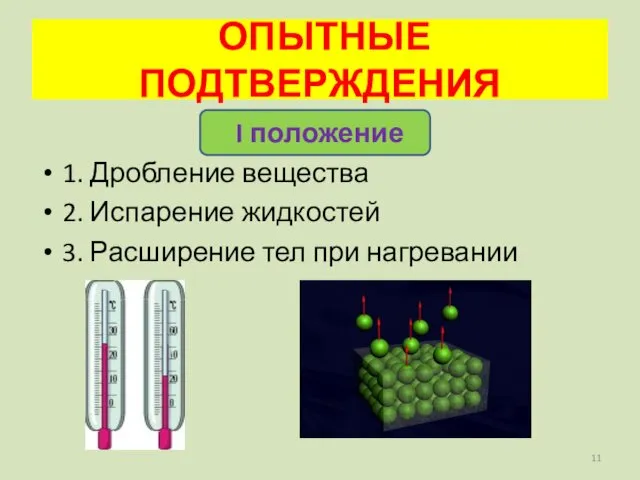
- 11. ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ I положение 1. Дробление вещества 2. Испарение жидкостей 3. Расширение тел при нагревании
- 12. II положение 1. Диффузия – перемешивание молекул разных веществ 2.Броуновское движение – движение взвешенных в жидкости
- 13. Через несколько дней нет четкой границы. В начале эксперимента граница четкая Выясним движутся ли молекулы? Рассмотрим
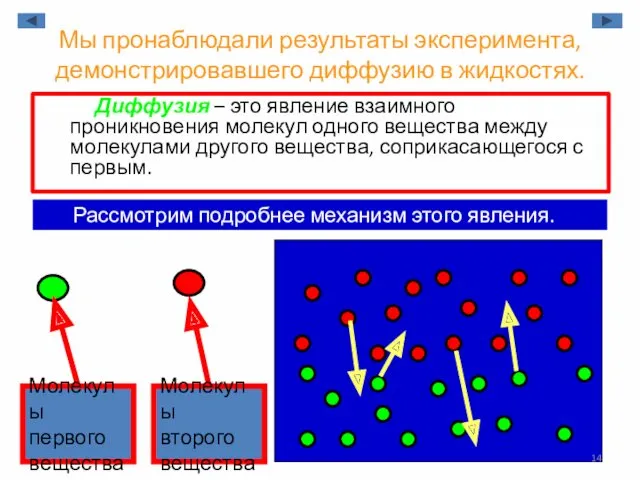
- 14. Мы пронаблюдали результаты эксперимента, демонстрировавшего диффузию в жидкостях. Диффузия – это явление взаимного проникновения молекул одного
- 15. III положение Силы упругости Прилипание свинцовых цилиндров Смачивание Поверхностное натяжение ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ
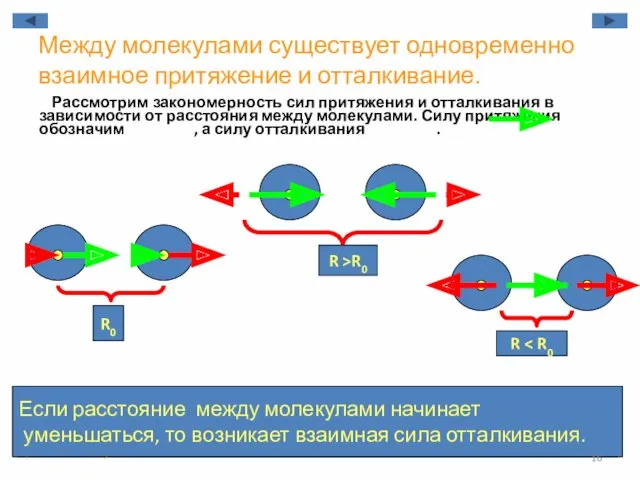
- 16. Между молекулами существует одновременно взаимное притяжение и отталкивание. Рассмотрим закономерность сил притяжения и отталкивания в зависимости
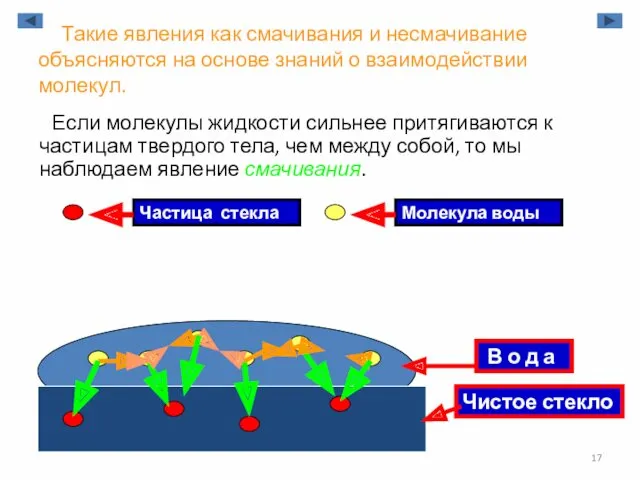
- 17. Такие явления как смачивания и несмачивание объясняются на основе знаний о взаимодействии молекул. Если молекулы жидкости
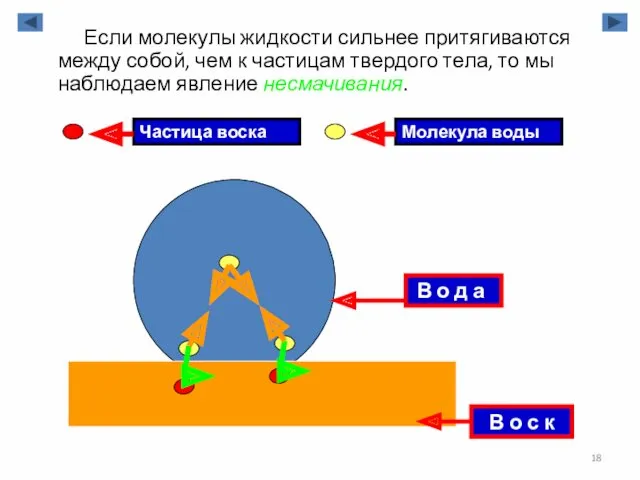
- 18. Если молекулы жидкости сильнее притягиваются между собой, чем к частицам твердого тела, то мы наблюдаем явление
- 19. Атом – (от греческого atomos – «неделимый») мельчайшая химически неделимая частица вещества Древнегреческий ученый Демокрит «Ничего
- 20. Самые распространенные атомы Во Вселенной: атомы водорода, атомы гелия (99%) В земной коре: атомы кислорода, атомы
- 21. Молекулы В 1647 году Пьер Гассенди (французский физик) ввел слово «молекула». Молекула – мельчайшая частица вещества,
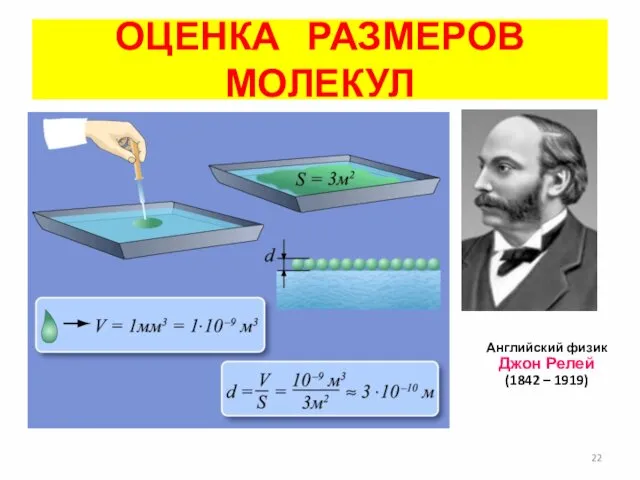
- 22. ОЦЕНКА РАЗМЕРОВ МОЛЕКУЛ Английский физик Джон Релей (1842 – 1919)
- 23. Количество вещества В единице массы, 1 килограмме вещества, находится разное количество структурных единиц – атомов, молекул.
- 24. КОЛИЧЕСТВО ВЕЩЕСТВА В молекулярно-кинетической теории количество вещества принято считать пропорциональным числу частиц. Единица количества вещества называется
- 25. ФОРМУЛЫ
- 26. В одном моле любого вещества содержится одно и то же число частиц (молекул). Это число называется
- 27. Закон Авогадро. На заре развития атомной теории (1811) А.Авогадро выдвинул гипотезу, согласно которой при одинаковых температуре
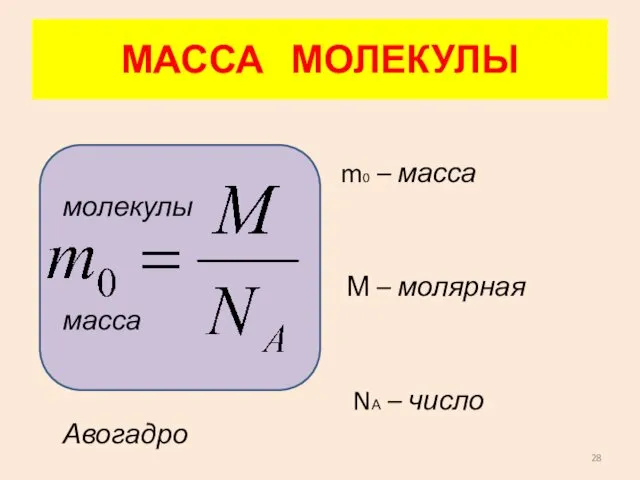
- 28. МАССА МОЛЕКУЛЫ m0 – масса молекулы М – молярная масса NА – число Авогадро
- 29. 1. Все вещества состоят из частиц. 2. Все частицы непрерывно и хаотично движутся. 3. Все частицы
- 30. ЗАДАЧИ 1. Рассчитать массу молекулы Н2SО4. М(Н2SО4) = 2·1 + 32 + 16·4 = 98 г/моль
- 33. Скачать презентацию




















 Осложнения повреждений опорно-двигательного аппарата
Осложнения повреждений опорно-двигательного аппарата Швеция и Финляндия
Швеция и Финляндия Региональный этап Всероссийского конкурса среди активистов школьных музеев - 2020
Региональный этап Всероссийского конкурса среди активистов школьных музеев - 2020 Месопотамия. Первая цивилизация
Месопотамия. Первая цивилизация Профессиональная роль акушерки при невынашивании беременности
Профессиональная роль акушерки при невынашивании беременности Западно-Сибирской экономический район
Западно-Сибирской экономический район Первая медицинская помощь при травмах опорно-двигательного аппарата
Первая медицинская помощь при травмах опорно-двигательного аппарата Электрмагнетизм. Явление электромагнитной индукции
Электрмагнетизм. Явление электромагнитной индукции Принципиальная технологическая схема воздушной компрессорной станции
Принципиальная технологическая схема воздушной компрессорной станции Предлоги как части речи
Предлоги как части речи Презентация.Здоровье не купишь, его разум дарит!
Презентация.Здоровье не купишь, его разум дарит! Берегите здоровье. 2 класс.
Берегите здоровье. 2 класс. АСК 3 урок Полезные ископаемые Смоленской области
АСК 3 урок Полезные ископаемые Смоленской области презентация на тему: История немцев села Константиновка.
презентация на тему: История немцев села Константиновка. Space exploration
Space exploration Административный центр обслуживания METRO
Административный центр обслуживания METRO Перегородки в квартире
Перегородки в квартире Викторина Мой любимый город
Викторина Мой любимый город Конкурс Снежный городок Эколят МОБУ СОШ д. Янтышево (дошкольная группа)
Конкурс Снежный городок Эколят МОБУ СОШ д. Янтышево (дошкольная группа) Портфолио педагога
Портфолио педагога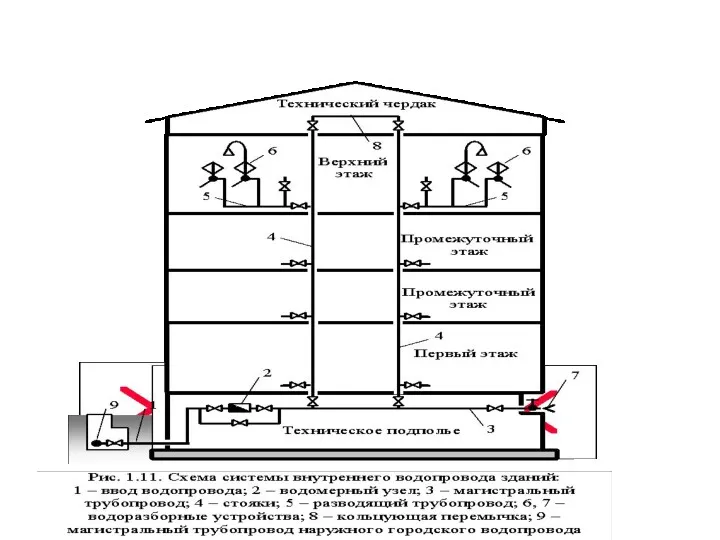 Система внутреннего водопровода здания
Система внутреннего водопровода здания Народный костюм своими руками
Народный костюм своими руками Презентация Предметно пространственная среда согласно ФГОС
Презентация Предметно пространственная среда согласно ФГОС Назначение судовой паротурбинной установки
Назначение судовой паротурбинной установки Пропедевтика внутренних болезней (ПВБ)
Пропедевтика внутренних болезней (ПВБ) Методы и методические приемы обучения биологии
Методы и методические приемы обучения биологии Зачем идти в интернет?
Зачем идти в интернет? Экологическое воспитание детей дошкольного возраста
Экологическое воспитание детей дошкольного возраста