Содержание
- 2. Основы кинетики гетерогенных процессов В гетерогенных реакциях химическое взаимодействие развивается на границах раздела фаз и суммарный
- 3. Основы кинетики гетерогенных процессов В гетерогенных реакциях взаимодействия развиваются на границе раздела фаз и включают следующие
- 4. Закономерности диффузии Скорость диффузии вещества в какой-то момент времени (диффузионный поток) νД равен количеству вещества, которое
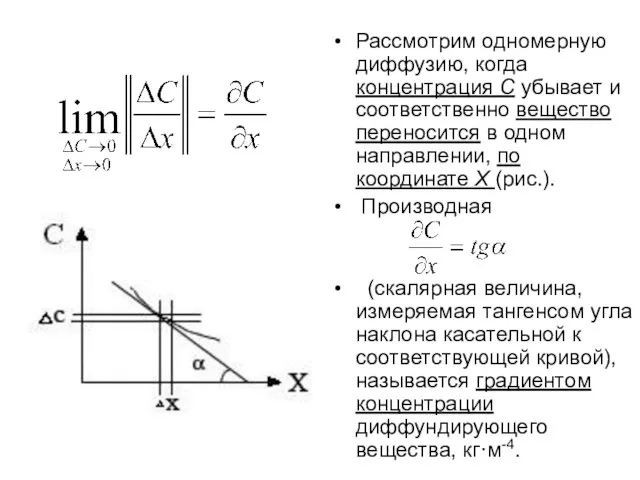
- 5. Рассмотрим одномерную диффузию, когда концентрация С убывает и соответственно вещество переносится в одном направлении, по координате
- 6. Эмпирические исследования диффузии привели к открытию соотношения между скоростью диффузии и концентрацией диффундирующего вещества, который называется
- 7. По первому закону Фика, скорость диффузии (внешней, внутренней) пропорциональна градиенту концентрации νД = где dG –
- 8. Законы Фика Первый закон диффузии описывает отношения между переменными неизменными во времени, второй закон диффузии -
- 9. Второй закон Фика Допустим в начале пути диффузии (при х = 0) концентрация диффундирующего вещества С1
- 10. Установившийся (стационарный) и неустановившийся (нестационарный) режим Если первый закон Фика описывает стационарный процесс диффузии, то есть
- 11. Виды диффузии По характеру переноса вещества различают два вида диффузии - молекулярную (микродиффузию) и конвективную (макродиффузию).
- 12. Ламинарный и турбулентный режим Скорость диффузии существенно зависит от характера движения жидкостей (газов), которое может быть
- 13. Концентрация вещества в объеме вследствие перемешивания сравнительно быстро выравнивается, но у твердой поверхности всегда имеется малоподвижный
- 14. Твердые тела обычно пористые. Их взаимодействие с газом развивается не только на внешней поверхности, но и
- 15. Скорость химической реакции
- 16. Наблюдаемая скорость реакции Любая реальная система, (живая, природная, технологическая) имеет тенденцию к самоорганизации. При этом достигаются
- 18. Скачать презентацию














 Развивай-ка
Развивай-ка Тоқыма өндірісі
Тоқыма өндірісі Статистическая радиотехника (основы теории случайных процессов)
Статистическая радиотехника (основы теории случайных процессов) Географическое положение Африки
Географическое положение Африки Анализ портфеля акций
Анализ портфеля акций презентация к уроку технология УМК Гармония 1 класс
презентация к уроку технология УМК Гармония 1 класс Экспресс-диагностика дошкольника.
Экспресс-диагностика дошкольника. Электроэнергетика и электротехника. Релейная защита и автоматизация электроэнергетических систем
Электроэнергетика и электротехника. Релейная защита и автоматизация электроэнергетических систем степень окисления
степень окисления Жылулық құбылыстар
Жылулық құбылыстар Северная война 1700 - 1721 гг
Северная война 1700 - 1721 гг Механическая желтуха
Механическая желтуха Гета Виктория 15 лет Подарок на праздник
Гета Виктория 15 лет Подарок на праздник Культура Древнего Рима
Культура Древнего Рима лист самооценки обучающегося
лист самооценки обучающегося 20231017_prezentatsiya_konstruirovanie
20231017_prezentatsiya_konstruirovanie Исследовательская технология
Исследовательская технология Основы военной службы обороны государства
Основы военной службы обороны государства Урок технологии. Изделие: сердечко
Урок технологии. Изделие: сердечко Химическая связь
Химическая связь Презентация творческой поделки из мультфильма Винни Пух и его друзья
Презентация творческой поделки из мультфильма Винни Пух и его друзья Наша достопримечательность: памятник-обелиск, погибшим землякам в поселке Харино
Наша достопримечательность: памятник-обелиск, погибшим землякам в поселке Харино Родной Пермский край – часть большой страны. 4 класс
Родной Пермский край – часть большой страны. 4 класс Программа развития для ДОУ
Программа развития для ДОУ Модуляция и виды модуляции
Модуляция и виды модуляции Омонимы разработка урока по татарскому языку.
Омонимы разработка урока по татарскому языку. Интернет зависимость среди молодежи
Интернет зависимость среди молодежи Теоретические и методические основы обучения (дидактика)
Теоретические и методические основы обучения (дидактика)