Содержание
- 2. H2
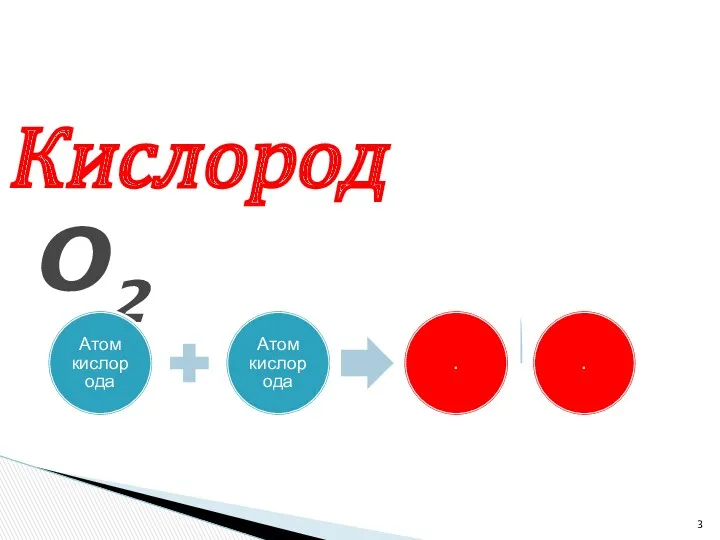
- 3. Кислород O2
- 4. Цель: сравнить физические и химические свойства двух газов, способы их собирания и распознавания; способы получения газов
- 5. Характеристика химических элементов Распространение в природе Получение кислорода и водорода Физические свойства Химические свойства Применение План
- 6. . Даны формулы : H, O2, O, H2. Что означают данные записи?
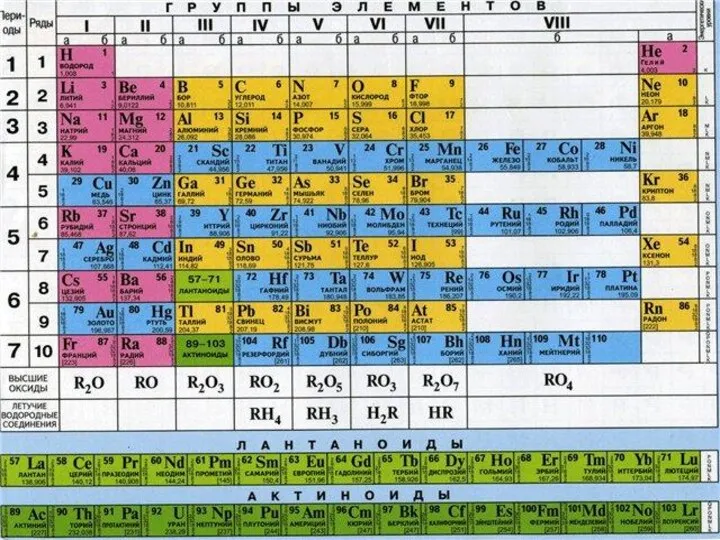
- 8. Группа I газа Н2 Группа II газа О2 Химический знак Ar( )= Валентность Самый распространенный элемент
- 9. КОДОВЫЙ ДИКТАНТ 1.Газ легче воздуха. 2.Малорастворимый газ в воде. 3.Этот газ хорошо поддерживает горение. 4.Выделяется в
- 10. 1774 г. – кислород открыт англ. химиком Джозефом Пристли путём разложения оксида ртути в герметично закрытом
- 11. 1766 г. – водород открыл Г. Кавендиш 1784 г. – А. Лавуазье назвал водород hydrogene (др.-греч.
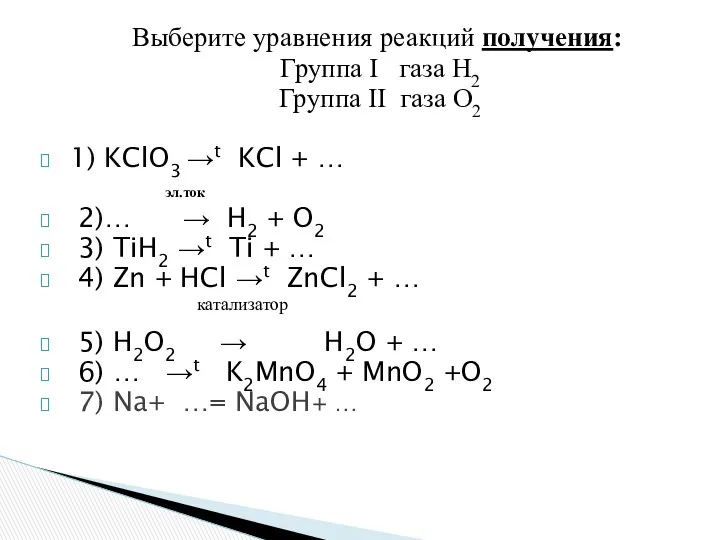
- 12. Выберите уравнения реакций получения: Группа I газа Н2 Группа II газа О2 1) KClO3 →t KCl
- 13. Получение водорода эл.ток 1)2H₂O → 2H2 ↑ + O2↑ 2) TiH2 →t Ti + H₂↑ 3)
- 14. Получение кислорода 1) 2KClO3 →t 2KCl + O2↑ эл. ток 2)2H₂O → 2H2 ↑ + O2↑
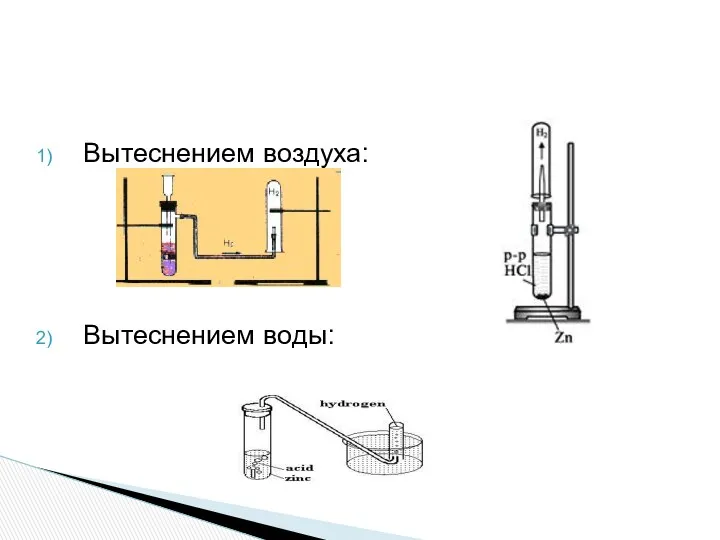
- 16. Вытеснением воздуха: Вытеснением воды:
- 17. Химические свойства кислорода Запишите уравнения реакций, о которых говориться в стихотворении: Известно, что горят отлично в
- 18. Химические свойства водорода Восстановление меди СuО + Н2 → Горение водорода Н2 + O2 → Взаимодействие
- 19. Горение магния, угля, серы, фосфора, железа и водорода 2Mg + O₂ → 2MgO C + O₂
- 20. Химические свойства водорода Восстановление меди СuО + Н2 → Сu + Н2O Горение водорода 2H2 +
- 21. Применение водорода Водород как топливо будущего При сгорании водорода выделяется большое количество теплоты, при этом не
- 22. Водород используется в производстве перекиси водорода и химических реагентов в водородной сварке в гидрировании растительных масел
- 25. Итог урока Выберите Ничего не понятно Есть вопросы Свой вариант Было скучно Довольна оценкой Узнал(а) много
- 27. Скачать презентацию




















 Числовые неравенства
Числовые неравенства Организация безрецептурного отпуска лекарств. ОТС – препарата
Организация безрецептурного отпуска лекарств. ОТС – препарата Исследовательская работа Сколько весит здоровье школьника
Исследовательская работа Сколько весит здоровье школьника Автоматизация сбора яиц
Автоматизация сбора яиц Разработка и обоснование нового туристского маршрута
Разработка и обоснование нового туристского маршрута Брачный договор
Брачный договор Выращивание кристаллов
Выращивание кристаллов Технические средства реализации информационных процессов. Принципы Фон Неймана
Технические средства реализации информационных процессов. Принципы Фон Неймана Адресация в интернете. Решение задач
Адресация в интернете. Решение задач Сталинградская битва
Сталинградская битва Внутренние воды Евразии
Внутренние воды Евразии Михаил Данилович Тимошенко
Михаил Данилович Тимошенко Синягин Сергей Николаевич – участник боевых действий в Чечне
Синягин Сергей Николаевич – участник боевых действий в Чечне Вирусные и бактериальные воздушно-капельные инфекции. Грипп. Корь. Скарлатина. Менингококковая инфекция. Дифтерия. Легионеллез
Вирусные и бактериальные воздушно-капельные инфекции. Грипп. Корь. Скарлатина. Менингококковая инфекция. Дифтерия. Легионеллез Интернет-магазин экологически чистых товаров EcoFutureShop • EFS
Интернет-магазин экологически чистых товаров EcoFutureShop • EFS Презентация Гороскоп на День учителя
Презентация Гороскоп на День учителя Рождество Христово. Русские обычаи и традиции, связанные с рождественскими праздниками
Рождество Христово. Русские обычаи и традиции, связанные с рождественскими праздниками ВЫСТУПЛЕНИЕ 05.11.2014 Биологические причины неуспеваемости учащихся общеобразовательной школы
ВЫСТУПЛЕНИЕ 05.11.2014 Биологические причины неуспеваемости учащихся общеобразовательной школы Проект по патриотическому воспитанию.
Проект по патриотическому воспитанию. Отдел Голосеменные
Отдел Голосеменные Основное представление об игре баскетбол
Основное представление об игре баскетбол Предлог как часть речи
Предлог как часть речи Внеклассное мероприятие Проблемы экология моей малой родины
Внеклассное мероприятие Проблемы экология моей малой родины Расчетные дозы реагентов
Расчетные дозы реагентов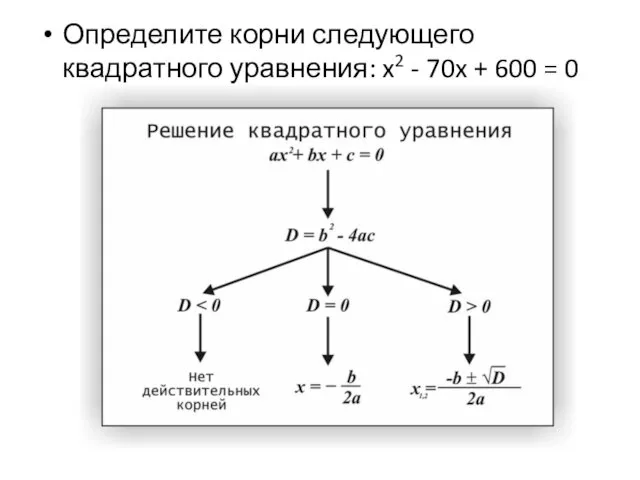 Строки, списки
Строки, списки Устройства для нагревания воздуха. Очистка вентиляционного воздуха. Системы местной вентиляции. (Лекция 8)
Устройства для нагревания воздуха. Очистка вентиляционного воздуха. Системы местной вентиляции. (Лекция 8) Углерод. Оксиды углерода.
Углерод. Оксиды углерода. Модели генераторов в расчетах УР
Модели генераторов в расчетах УР