Содержание
- 2. Лаборатор эш №1 буенча инструкция. “Юучы матдәләрнең составы.” 1.Сезгэ бирелгән юучы матдәнең эремәсен әзерләгез. Аның өчен
- 3. Юучы матдәләрнең составы.
- 4. ?Нигезләрнең гомуми формуласы нинди? ?Нигезләр төшенчәсенә билгеләмә бирергә. ?Нигезләрне ничек классификациялиләр?
- 5. Нигезләр классификациясе Индикаторның төсен үзәртәләр. Җылытканда таркалмыйлар Гигроскопик(суны үзенә ала) Индикаторның төсен үзгәртмиләр Җылытканда таркалалар
- 6. Лаборатор эш №2 буенча инструкция. “ Эремәүчән нигезләрнең үзлекләре” 1.Прибиркага 2 мл су салыгыз, суга әз
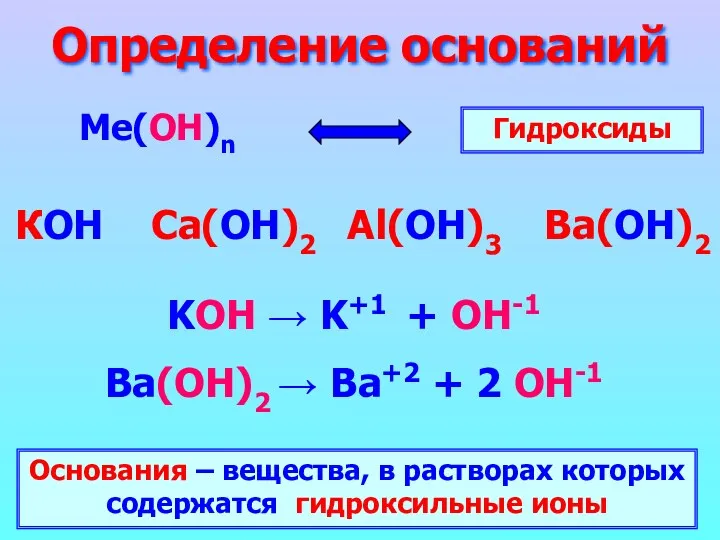
- 7. Определение оснований Ме(ОН)n КОН Ca(ОН)2 Al(ОН)3 Ba(ОН)2 Гидроксиды KOH → K+1 + OH-1 Ba(ОН)2 → Ba+2
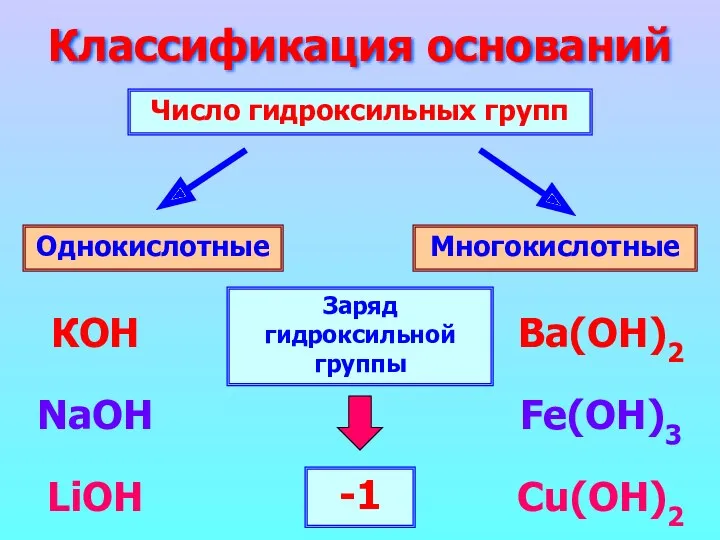
- 8. Классификация оснований Число гидроксильных групп Однокислотные Многокислотные КОН NaOH LiOH Ba(ОН)2 Fe(OH)3 Cu(OH)2 Заряд гидроксильной группы
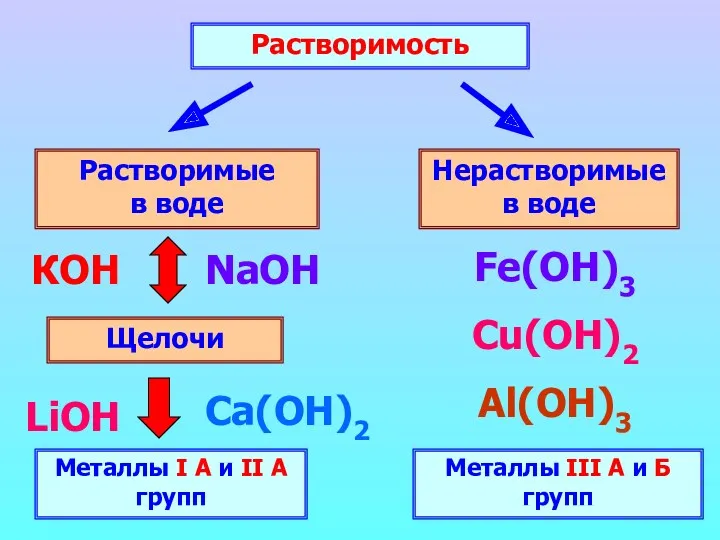
- 9. Растворимость Растворимые в воде Нерастворимые в воде Щелочи Металлы I А и II А групп КОН
- 10. Сильные и слабые основания
- 11. 900igr.net
- 12. 900igr.net 1- группа. Вычислите, какое количество вещества составляет 7,4 г гидроксида кальция ( гашеная известь.) 2
- 13. Өй эше: параграф 26 сөйләргә,№1,3,4 язма.
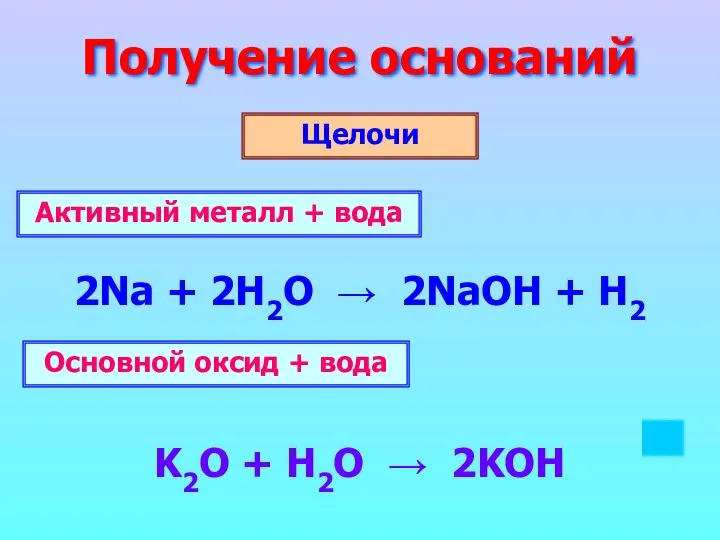
- 14. Получение оснований Щелочи 2Na + 2H2O → 2NaOH + H2 K2O + H2O → 2KOH Активный
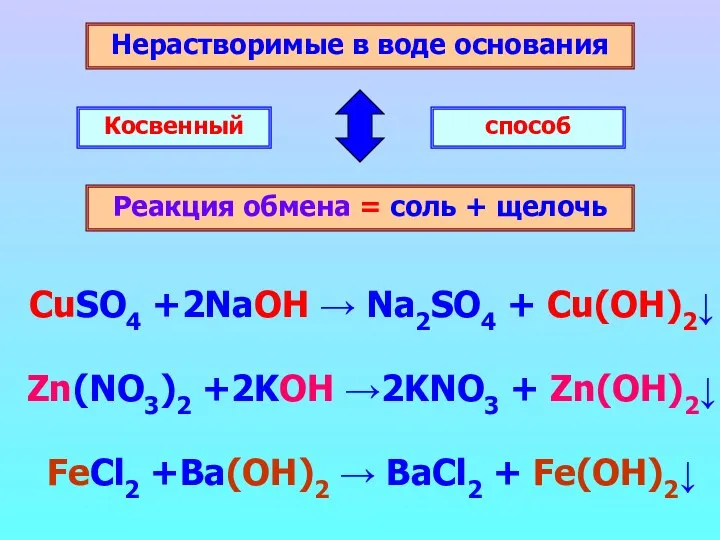
- 15. Нерастворимые в воде основания Реакция обмена = соль + щелочь Косвенный способ CuSO4 +2NaOH → Na2SO4
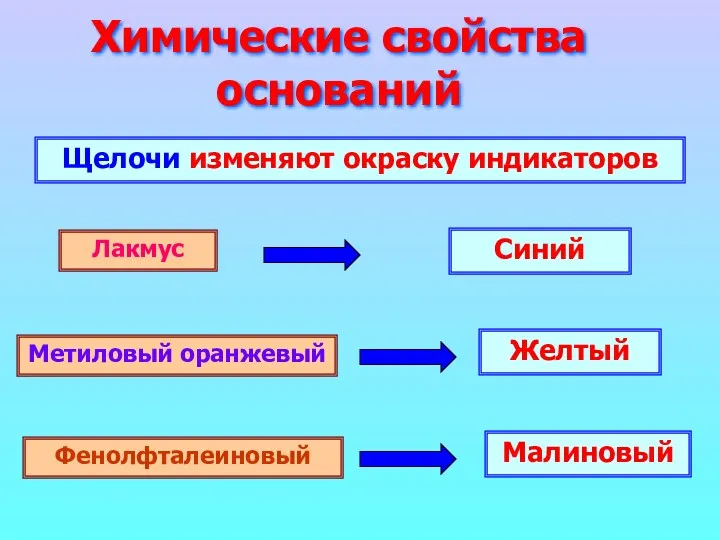
- 16. Химические свойства оснований Щелочи изменяют окраску индикаторов Лакмус Метиловый оранжевый Фенолфталеиновый Синий Желтый Малиновый
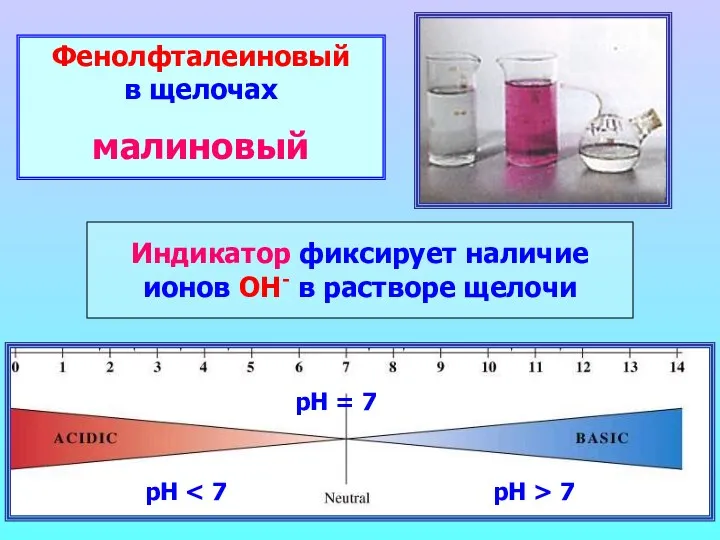
- 17. Фенолфталеиновый в щелочах малиновый Индикатор фиксирует наличие ионов ОН- в растворе щелочи рН рН = 7
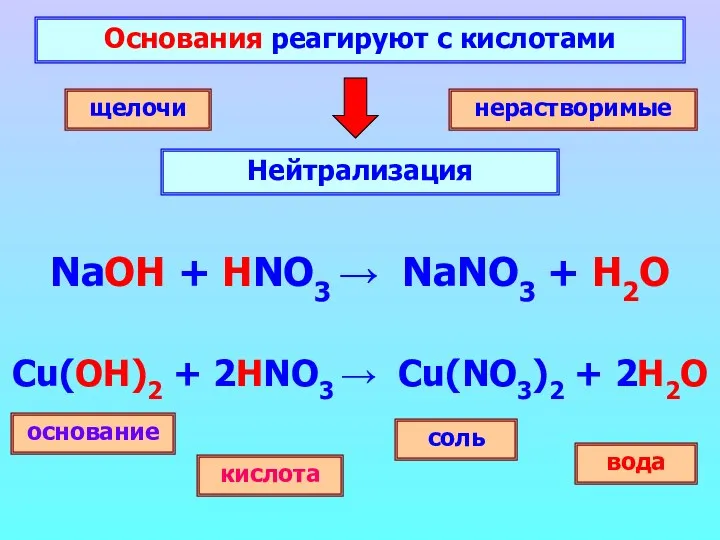
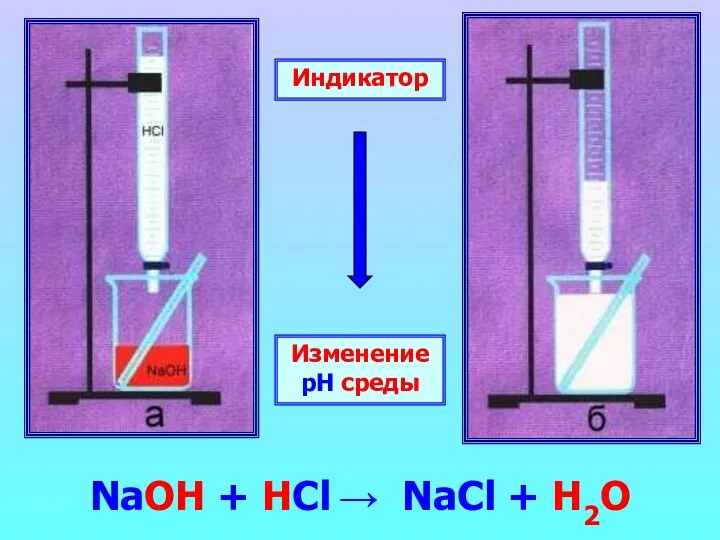
- 18. Основания реагируют с кислотами Нейтрализация щелочи нерастворимые основание соль кислота вода
- 20. Индикатор Изменение рН среды
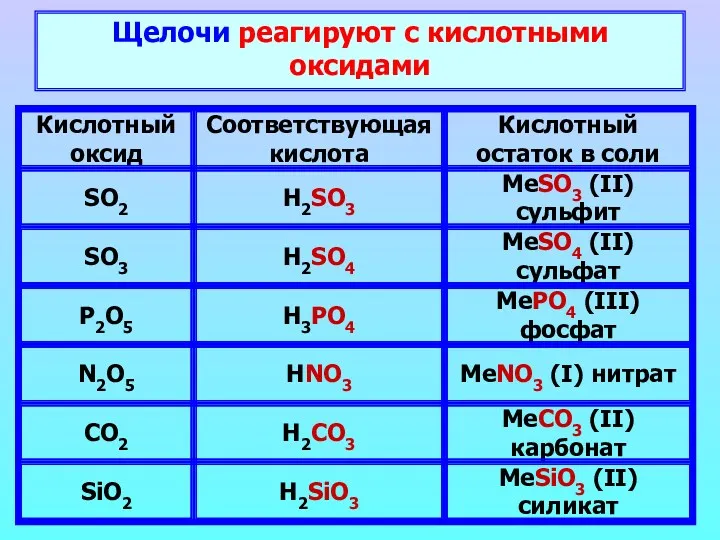
- 21. Щелочи реагируют с кислотными оксидами
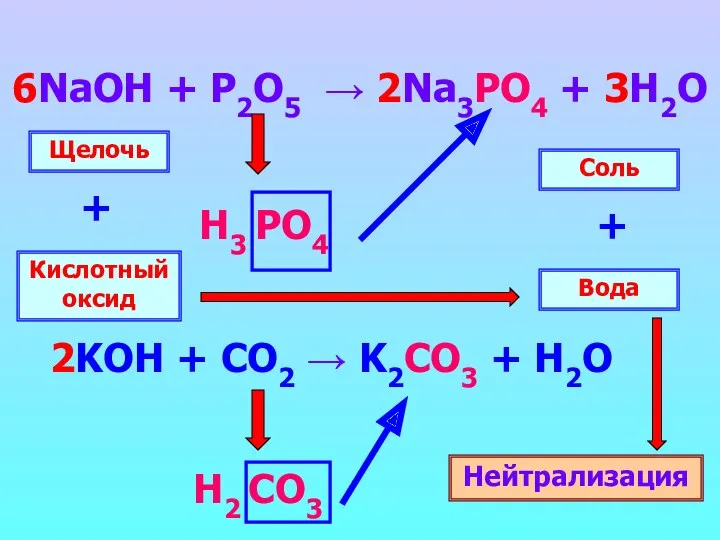
- 22. 6NaOH + P2O5 → 2Na3PO4 + 3H2O Н3 PO4 Н2 CO3 Щелочь Кислотный оксид + Вода
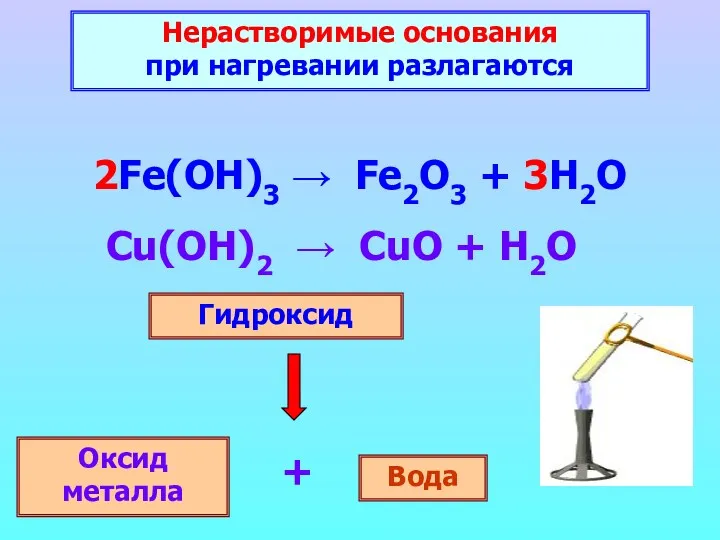
- 23. Нерастворимые основания при нагревании разлагаются 2Fe(OH)3 → Fe2O3 + 3H2O Гидроксид Оксид металла Вода +
- 25. Скачать презентацию










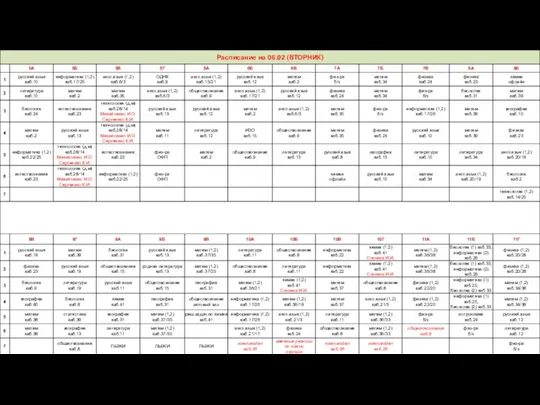 Расписание на 06.02
Расписание на 06.02 Раскол в русской православной церкви во второй половине XVII века
Раскол в русской православной церкви во второй половине XVII века Презентация по предмету Культура народов Ямала.
Презентация по предмету Культура народов Ямала. Ценообразование в общественном питании. План-меню, его назначение, виды, порядок составления
Ценообразование в общественном питании. План-меню, его назначение, виды, порядок составления Курский областной клинический онкологический диспансер
Курский областной клинический онкологический диспансер Арматурные изделия
Арматурные изделия Внутренние воды Южной Америки
Внутренние воды Южной Америки Тестовые задания по русскому языку
Тестовые задания по русскому языку Фёдор Ива́нович Тю́тчев
Фёдор Ива́нович Тю́тчев Символы России. Тест №60
Символы России. Тест №60 Этапы подготовки к прохождению практики
Этапы подготовки к прохождению практики Разработка подвижных уплотнений силовых гидроцилиндров сельскохозяйственных, лесозаготовительных и строительных машин
Разработка подвижных уплотнений силовых гидроцилиндров сельскохозяйственных, лесозаготовительных и строительных машин Презентация:Памятники рассказывают
Презентация:Памятники рассказывают Презентация по литературе 7 класс.
Презентация по литературе 7 класс. Сценарий родительского собрания Ещё раз о воспитании
Сценарий родительского собрания Ещё раз о воспитании Сайт комментарии
Сайт комментарии Энергия объектісін жедел басқару жүйесі
Энергия объектісін жедел басқару жүйесі Презентации к урокам истоки в 8 классе
Презентации к урокам истоки в 8 классе Общие сведения о катализе и катализаторах
Общие сведения о катализе и катализаторах Лесная промышленность
Лесная промышленность Деревообрабатывающее оборудование с ЧПУ
Деревообрабатывающее оборудование с ЧПУ Устройства вывода данных
Устройства вывода данных красота земли родной
красота земли родной Управление качеством и рисками проекта
Управление качеством и рисками проекта Технология 7 класс ( девочки) 17.01.2022
Технология 7 класс ( девочки) 17.01.2022 Модель робота для освоения космоса
Модель робота для освоения космоса Сварочный аппарат XXI века
Сварочный аппарат XXI века Тренажер Таблицу деления учим с увлечением
Тренажер Таблицу деления учим с увлечением