Содержание
- 2. Тема урока: «Простые вещества – неметаллы. Аллотропия»
- 3. Цели урока: Получить представление о простых веществах – неметаллах; Познакомиться с общими физическими свойствами неметаллов и
- 4. Проверка домашнего задания. 1. Где в периодической системе находятся элементы, соответствующие простым веществам металлам?
- 5. 2. Каковы общие физические свойства металлов?
- 6. 3. По каким физическим свойствам различаются металлы?
- 7. 4. Какое из веществ названных в приведённом ниже стихотворении, не относится к металлам? Семь металлов создал
- 8. Изучение новой темы. «Простые вещества – неметаллы. Аллотропия»
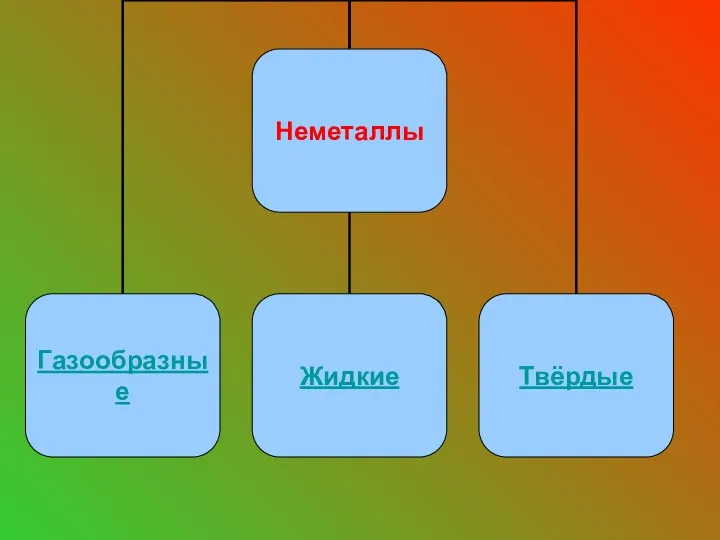
- 9. Неметаллы - это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами
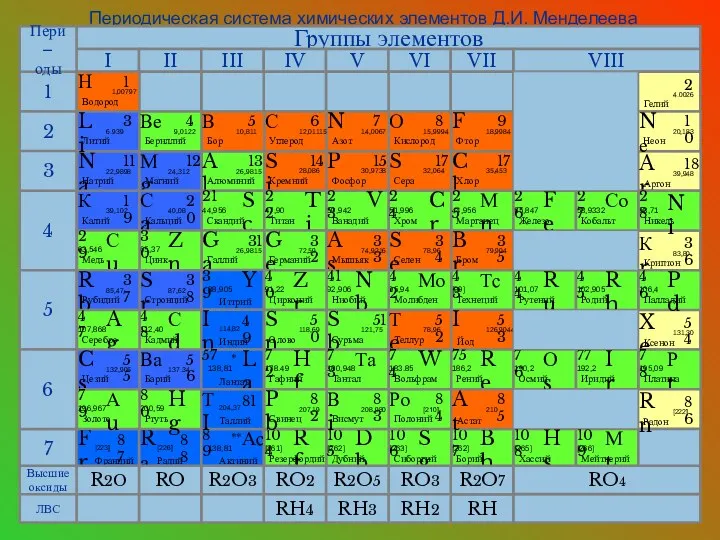
- 10. Периодическая система химических элементов Д.И. Менделеева
- 12. Газообразные вещества неметаллы: О2 - N2 - H2 - Cl2 - F2 -
- 13. N2 Cl2 F2 В начало
- 14. благородные газы: He - Ne - Ar - Kr - Xe - Rn - Инертные газы
- 15. Строение внешнего электронного слоя атомов гелия и неона +2 He ) 2 +10 Ne ) )
- 16. Применение гелия, неона и аргона.
- 17. Единственное жидкое вещество - Br2.
- 18. Твердые вещества: S – P – I2 – C – Si -
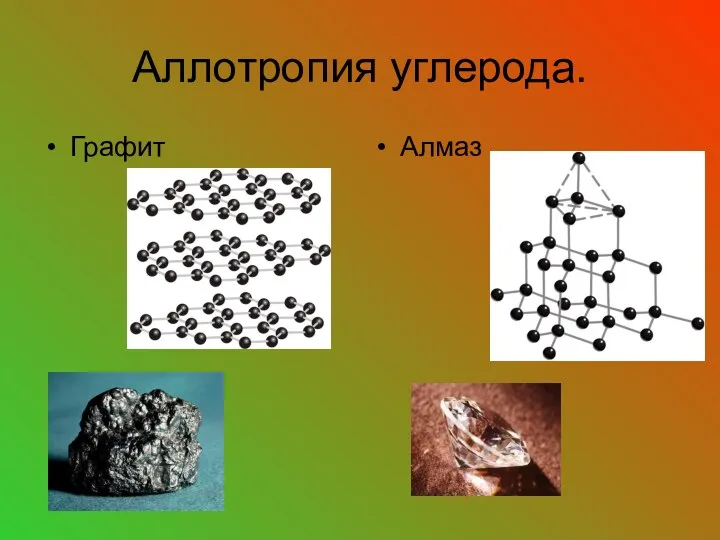
- 19. Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ. Причины аллотропии: Различное число атомов
- 20. Аллотропия кислорода. Кислород и озон
- 21. Модификации кислорода. О2- кислород; бесцветный газ; не имеет запаха; плохо растворим в воде; температура кипения-182,9 С;
- 22. Аллотропия фосфора. Красный и белый фосфор Р (красный фосфор) (белый фосфор) Р4
- 23. Аллотропия углерода. Графит Алмаз
- 24. Аллотропия серы. Кристаллическая, пластическая и моноклинная
- 25. Пограничное положение между металлами и неметаллами. Белое олово металл Серое олово неметалл
- 26. Почему химически неверно поэтическое выражение: «В воздухе пахло грозой»?
- 27. Экспедиция полярного исследователя Р. Скотта к Южному полюсу в 1912 году погибла из-за того, что потеряла
- 28. Какой тип химической связи должен быть в металлическом водороде?
- 29. Выполните задание. 1 вариант О2 – кислород, газ; Р4 – I2 – Si – бетта Sn
- 30. Проверь ответы. 1 вариант О2 – кислород, газ; Р4 – белый фосфор,твёрдый; I2 – йод, твердый
- 31. Критерии оценок 8 правильных ответов – «5»; 7,6 првильных ответов – «4»; 5,4 правильных ответов –
- 33. Скачать презентацию



























 Презентация по выполнению куклы в средневековом костюме в технике бумагопластика Диск
Презентация по выполнению куклы в средневековом костюме в технике бумагопластика Диск Строительная компания Риэлт Строй 36-86-00 rsdoma.ru
Строительная компания Риэлт Строй 36-86-00 rsdoma.ru Внеклассное мероприятие для младших школьников. День Петра и Февронии
Внеклассное мероприятие для младших школьников. День Петра и Февронии Необычные животные
Необычные животные Земледельцы Аттики теряют землю и свободу
Земледельцы Аттики теряют землю и свободу Кровеносные сосуды. Круги кровообращения
Кровеносные сосуды. Круги кровообращения Селекция растений
Селекция растений Қабыршақтылар
Қабыршақтылар Планування та благоустрій котеджного селища
Планування та благоустрій котеджного селища Лексическая тема- Транспорт
Лексическая тема- Транспорт Сельскохозяйственный снабженческо-сбытовой потребительский кооператив Альянс фермервест. История создания и опыт работы
Сельскохозяйственный снабженческо-сбытовой потребительский кооператив Альянс фермервест. История создания и опыт работы Стратегия развития туризма в Мурманской области
Стратегия развития туризма в Мурманской области Доклад Формирование умения работать с учебником в начальной школе — залог успешного обучения в дальнейшем
Доклад Формирование умения работать с учебником в начальной школе — залог успешного обучения в дальнейшем Первичная профсоюзная организация студентов АлтГПУ
Первичная профсоюзная организация студентов АлтГПУ Результаты анализа применения эмульсионных взрывчатых веществ в горно-обогатительных комбинатах компании
Результаты анализа применения эмульсионных взрывчатых веществ в горно-обогатительных комбинатах компании Педагогические аспекты профессиональной деятельности. Тема 5
Педагогические аспекты профессиональной деятельности. Тема 5 Сохранность библиотечных фондов
Сохранность библиотечных фондов Мости
Мости Актуальность курса основы безопасности жизнедеятельности
Актуальность курса основы безопасности жизнедеятельности Зеленоград. Спортивная школа дошколят. Дзюдо
Зеленоград. Спортивная школа дошколят. Дзюдо Опухоли щитовидной железы
Опухоли щитовидной железы Бренд Lumene. Новинки
Бренд Lumene. Новинки культура профессионального общения педагога
культура профессионального общения педагога Кристаллические и аморфные тела
Кристаллические и аморфные тела презентация к классному часу в 4 классе Как воспитать характер по программе Все цвета, кроме черного
презентация к классному часу в 4 классе Как воспитать характер по программе Все цвета, кроме черного JavaScript Основы WEB-программирования
JavaScript Основы WEB-программирования Основные функции и принципы психолого-педагогической диагностики
Основные функции и принципы психолого-педагогической диагностики Родители – не гости, а полноправные участники коррекционно-педагогического процесса в ДОУ.
Родители – не гости, а полноправные участники коррекционно-педагогического процесса в ДОУ.