Содержание
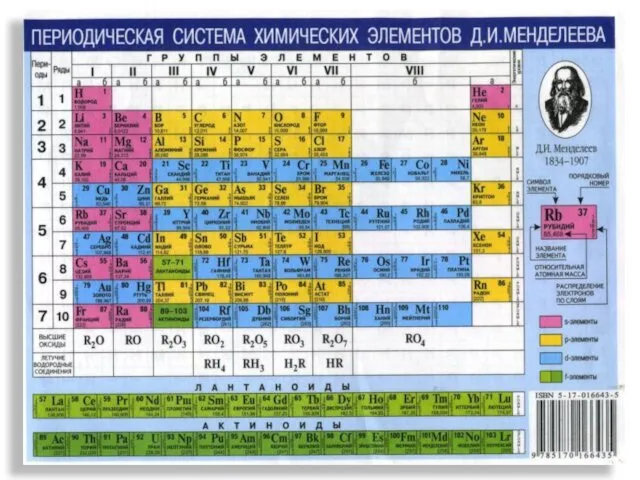
- 3. В 1869 году Д.И.Менделеев создал Периодическую систему
- 4. Периодический закон и периодическая система химических элементов Д.И.Менделеева
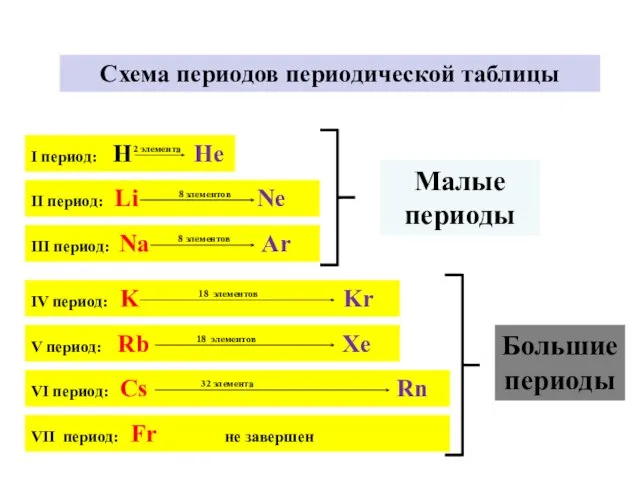
- 5. I период: H He 2 элемента Схема периодов периодической таблицы II период: Li Ne 8 элементов
- 6. Лантаноиды 58 Сe Церий 59 Pr Празеодим 60 Nd Неодим 61 Pm Прометий 62 Sm Самарий
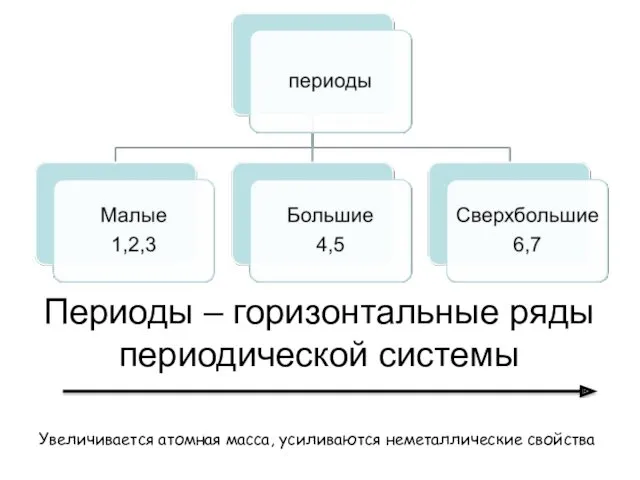
- 7. Периоды – горизонтальные ряды периодической системы Увеличивается атомная масса, усиливаются неметаллические свойства
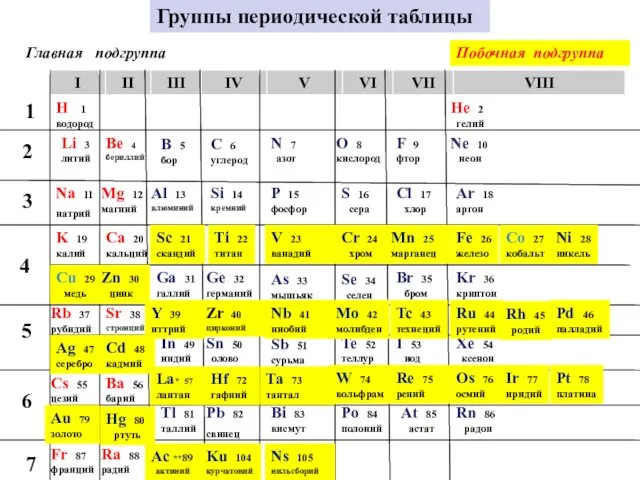
- 8. Группы периодической таблицы Главная подгруппа H 1 водород Li 3 литий Na 11 натрий K 19
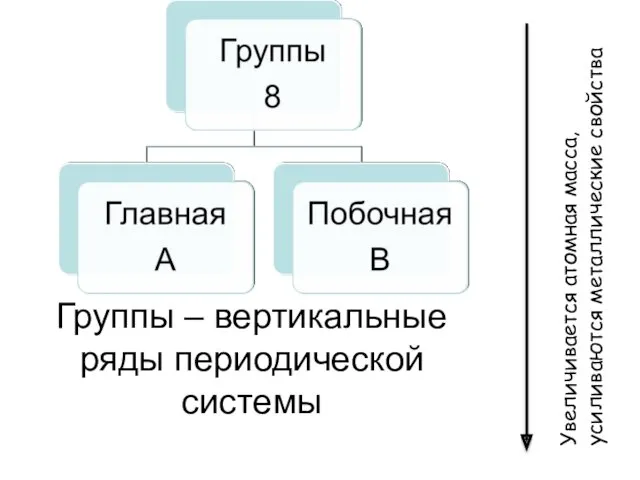
- 9. Группы – вертикальные ряды периодической системы Увеличивается атомная масса, усиливаются металлические свойства
- 10. Периодический закон Свойства химических элементов, а также образуемых ими простых и сложных веществ находится в периодической
- 11. Валентность – свойства атома присоединять определённое число других атомов.
- 12. Правила определения валентности (В) 1. В Водорода – I 2. В Кислорода – II 3. В
- 13. Определите высшую валентность Al Zn Mg Si P Li N Cl Определите низшую валентность Cl N
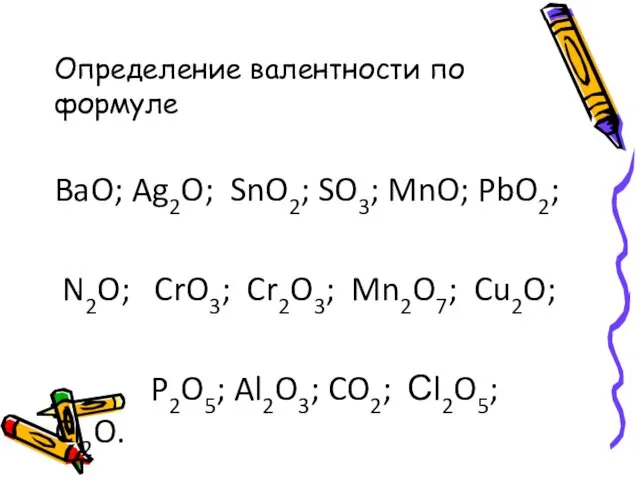
- 14. Определение валентности по формуле BaO; Ag2O; SnO2; SO3; MnO; PbO2; N2O; CrO3; Cr2O3; Mn2O7; Cu2O; P2O5;
- 16. Скачать презентацию







 Особенности изысканий и проектирования дорог на многолетнемерзлых (вечномерзлых) грунтах
Особенности изысканий и проектирования дорог на многолетнемерзлых (вечномерзлых) грунтах ITALY- FILM & TV DIGITAL UPDATE
ITALY- FILM & TV DIGITAL UPDATE Презентация: Анализ содержания КИМ для проведения пробного экзамена по химии в 2013 году.
Презентация: Анализ содержания КИМ для проведения пробного экзамена по химии в 2013 году. 9 мая - День Победы. Презентация к лассному часу
9 мая - День Победы. Презентация к лассному часу Предопухолевая патология и рак молочной железы
Предопухолевая патология и рак молочной железы Вестибулярное головокружение в неотложной неврологии
Вестибулярное головокружение в неотложной неврологии Теория автоматов и формальных языков. Лекция 6
Теория автоматов и формальных языков. Лекция 6 Жилой комплекс
Жилой комплекс Prezentatsia_Microsoft_Office_PowerPoint_2
Prezentatsia_Microsoft_Office_PowerPoint_2 Основы робототехники
Основы робототехники Серия Гимнастика для ума. Магические квадраты
Серия Гимнастика для ума. Магические квадраты Утренник Мы теперь не просто дети, мы теперь ученики
Утренник Мы теперь не просто дети, мы теперь ученики Способ приведения матрицы к ступенчатому виду
Способ приведения матрицы к ступенчатому виду Технология слесарных и слесарно-сборочных работ
Технология слесарных и слесарно-сборочных работ Наблюдение за горящей свечей
Наблюдение за горящей свечей Строительные растворы
Строительные растворы Программа воспитания школьников Я, ты, он, она – вместе дружная семья
Программа воспитания школьников Я, ты, он, она – вместе дружная семья Группы вводных слов по значению. 8 класс
Группы вводных слов по значению. 8 класс Изменения в организации.Тренинг для компании
Изменения в организации.Тренинг для компании Молекулярно-генетические механизмы онтогенеза. Нарушения онтогенеза и их место в патологии человека
Молекулярно-генетические механизмы онтогенеза. Нарушения онтогенеза и их место в патологии человека Древнейшие памятники славянской культуры
Древнейшие памятники славянской культуры Правомерное и противоправное поведение, юридическая ответственность и её задачи
Правомерное и противоправное поведение, юридическая ответственность и её задачи Отчет образовательного учреждения о проведенных мероприятиях Зелёная волна
Отчет образовательного учреждения о проведенных мероприятиях Зелёная волна Вычитание из чисел 6 и 7. Закрепление изученных приёмов
Вычитание из чисел 6 и 7. Закрепление изученных приёмов Умникам и умницам
Умникам и умницам Урок по теме: Типы кристаллических решеток
Урок по теме: Типы кристаллических решеток Медикаментозный аборт. Показания и противопоказания
Медикаментозный аборт. Показания и противопоказания Методы разделения и концентрирования веществ: место в химическом анализе. (Лекция 1)
Методы разделения и концентрирования веществ: место в химическом анализе. (Лекция 1)