Содержание
- 2. Энергия ионизации Энергия (потенциал) ионизации атома Ei - минимальная энергия, необходимая для удаления электрона из атома:
- 3. Сродство к электрону Сродство атома к электрону Ee – способность атомов присоединять добавочный электрон и превращаться
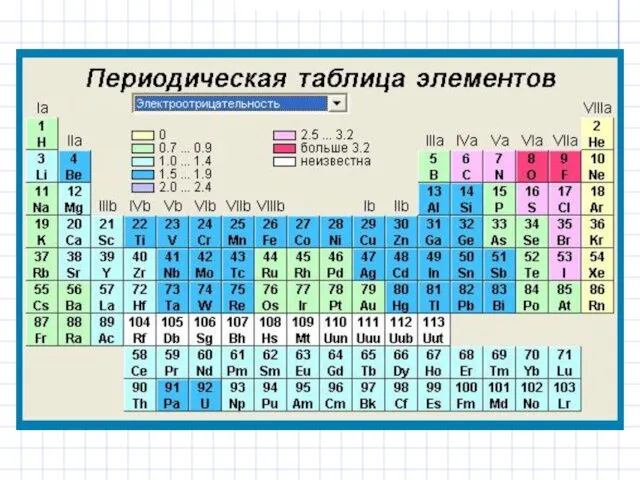
- 4. Электроотрицательность (абсолютная электроотрицательность) Относительная электроотрицательность: χF = 4 Лайнус-Карл ПОЛИНГ (28.02.1901 – 19.08.1994) Одна из самых
- 6. Ряды Рихтера и триады Дёберейнера Немецкий химик И.В. Рихтер в 1793 г. расположил металлы, обладающие близкими
- 7. Группы элементов Гесса В изданном в 1849 г. учебнике "Основания чистой химии", российский химик Г.И. Гесс
- 8. Спираль Шанкуртуа или «теллурический винт» В 1862 году французский ученый А. Бегье де Шанкуртуа сгруппировал элементы
- 9. Закон октав В 1865 г. американский химик Дж. Ньюлендс предложил "закон октав". В таблице Ньюлендса близкие
- 10. Таблица Лотара Мейера В 1864 г. немецкий химик Л.Ю. Мейер в книге "Современные теории химии и
- 11. Периодический закон и периодическая система химических элементов Д.И. Менделеев, 1869 г. Создание учебника «Основы химии»
- 12. Периодический закон "Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости
- 13. Периодическая система химических элементов Д.И. Менделеева (1873 г.)
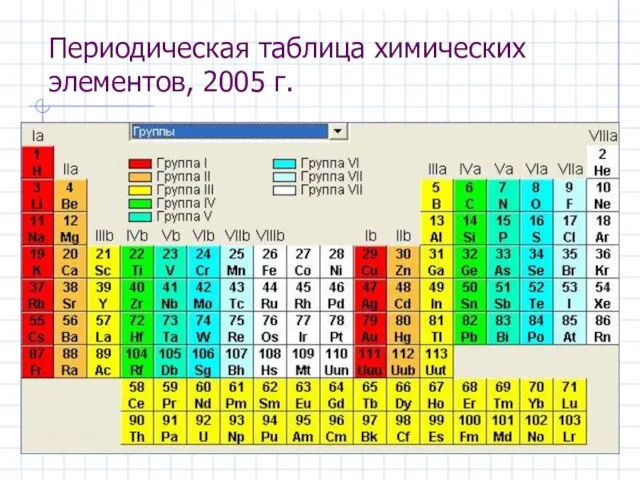
- 14. Периодическая таблица химических элементов, 2005 г.
- 15. Атомные массы и периодическая система химических элементов Менделеев учитывал, что для некоторых элементов атомные массы могли
- 16. Предсказание химических элементов Менделеев оставил в таблице пустые места для не открытых элементов (экабор, экаалюминий, экасилиций,
- 17. Физический смысл порядкового номера элемента А.И. Ван ден Брук (1870-1926) предположил, что "каждому элементу должен соответствовать
- 18. Периодический закон сегодня: "Свойства химических элементов, а также образуемых ими простых и сложных веществ находятся в
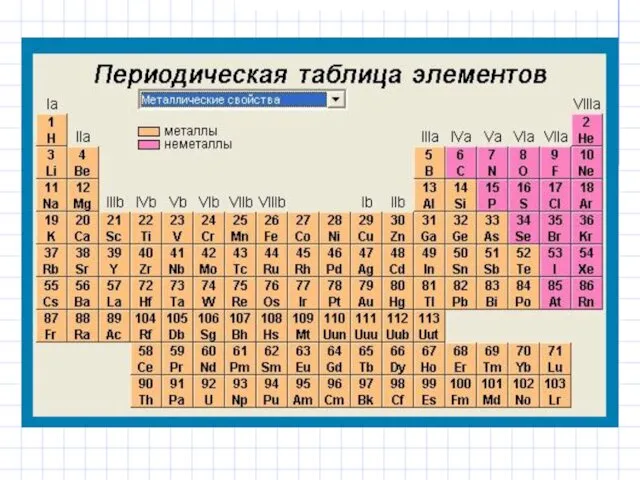
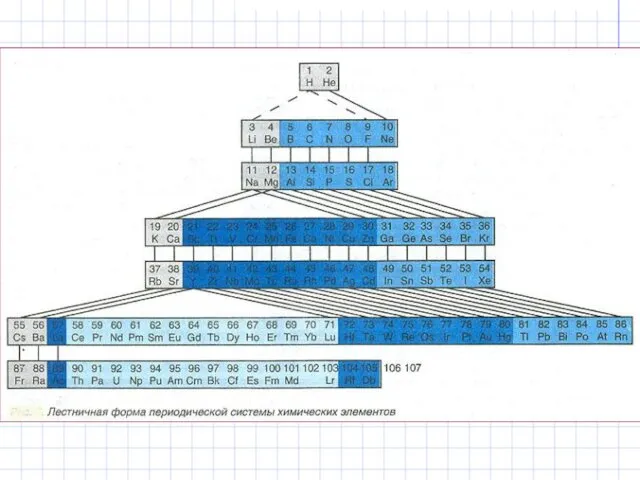
- 19. Структура периодической системы элементов Периодическая система химических элементов - естественная классификация химических элементов, являющаяся табличным выражением
- 23. Период и группа Период – горизонтальная последовательность элементов, начинающаяся со щелочного металла и заканчивающаяся благородным газом;
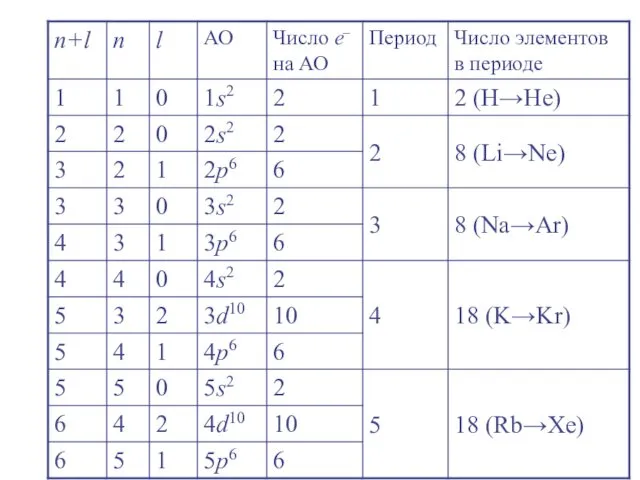
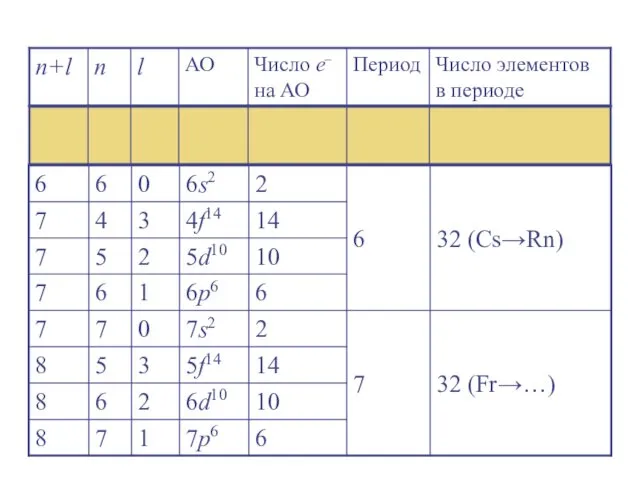
- 24. Правило Клечковского (правило n + l ) Заселение электронами энергетических уровней и подуровней в нейтральных атомах
- 27. Периодичность Периодичность – это повторяемость свойств химических и физических свойств элементов и их соединений по определенному
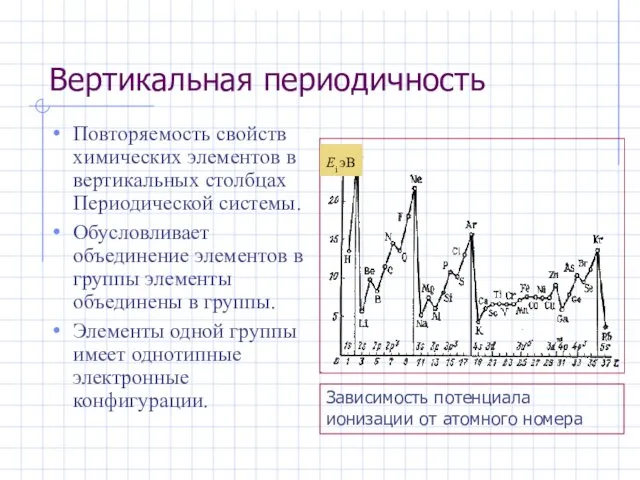
- 28. Вертикальная периодичность Повторяемость свойств химических элементов в вертикальных столбцах Периодической системы. Обусловливает объединение элементов в группы
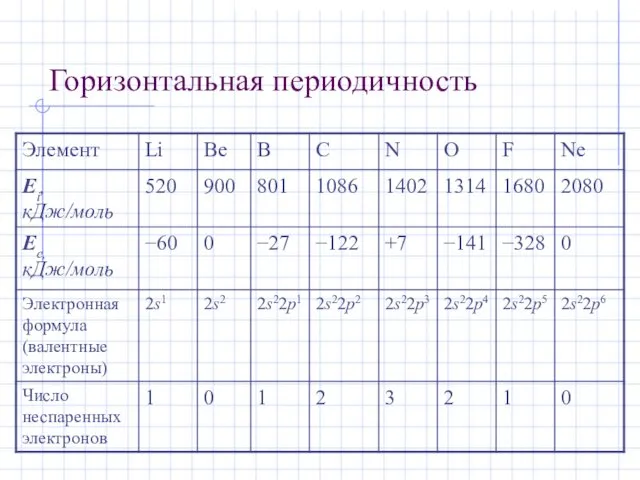
- 29. Горизонтальная периодичность Горизонтальная периодичность заключается в появлении максимальных и минимальных значений свойств простых веществ и соединений
- 30. Горизонтальная периодичность
- 31. Диагональная периодичность Повторяемость свойств простых веществ и соединений по диагоналям Периодической системы; связана с возрастанием неметаллических
- 33. Скачать презентацию






















 Профилактика инфекционных болезней и эпидемий
Профилактика инфекционных болезней и эпидемий Законы жизни семьи. Законы жизни класса.
Законы жизни семьи. Законы жизни класса. Рисование геометрических тел. Куб, призма и пирамида
Рисование геометрических тел. Куб, призма и пирамида Магнитные цепи и электромагнитные устройства. Трансформатор (продолжение)
Магнитные цепи и электромагнитные устройства. Трансформатор (продолжение) Биологическая игра Первый миллион
Биологическая игра Первый миллион Презентация по технологии Цветы из салфеток
Презентация по технологии Цветы из салфеток Холодильное оборудование
Холодильное оборудование Анализ аптечного ассортимента лекарственного растительного сырья, содержащего эфирные масла и препаратов из него
Анализ аптечного ассортимента лекарственного растительного сырья, содержащего эфирные масла и препаратов из него Разработка урока по теме население Алтайского края
Разработка урока по теме население Алтайского края Хранение информации
Хранение информации Презентация к уроку по теме Алкины. Строение, свойства, применение
Презентация к уроку по теме Алкины. Строение, свойства, применение Аналого-цифровые преобразователи. Метрология и теория измерений. Лекция 18
Аналого-цифровые преобразователи. Метрология и теория измерений. Лекция 18 Соединение проводов в распределительной коробке и на потребителе электроэнергии
Соединение проводов в распределительной коробке и на потребителе электроэнергии Подготовка к ОГЭ по географии, 9 класс
Подготовка к ОГЭ по географии, 9 класс Выявление и устройство детей, оставшихся без попечения родителей. Соотношение понятий устройство и воспитание
Выявление и устройство детей, оставшихся без попечения родителей. Соотношение понятий устройство и воспитание Кодирование и обработка числовой информации
Кодирование и обработка числовой информации Спирт этиловый
Спирт этиловый Историческая живопись
Историческая живопись Презентация по теме Цели и задачи проекта 1 класс Курс Учусь создавать проект Р. И. Сизова, Р. Ф. Селимова
Презентация по теме Цели и задачи проекта 1 класс Курс Учусь создавать проект Р. И. Сизова, Р. Ф. Селимова Қаттылықты анықтау тәсілдер
Қаттылықты анықтау тәсілдер Подготовка к краевым контрольным работам
Подготовка к краевым контрольным работам Реконструкция Калужского шоссе и развязки МКАД - Профсоюзная улица
Реконструкция Калужского шоссе и развязки МКАД - Профсоюзная улица Организация производственного и технологического процесса. Лекция 4
Организация производственного и технологического процесса. Лекция 4 IS-Passport. Автоматизация работы с миграционными службами
IS-Passport. Автоматизация работы с миграционными службами Гломерулонефриты у детей
Гломерулонефриты у детей Гибридизация
Гибридизация Противоэрозионная организация территории севооборотов ЗАО Ульяновский Ртищевского района Саратовской области
Противоэрозионная организация территории севооборотов ЗАО Ульяновский Ртищевского района Саратовской области Катализ. Цепные реакции. (Лекция 11)
Катализ. Цепные реакции. (Лекция 11)