Пезентация к уроку Изменение числа электронов на внешнем энергетическом уровне. Ионная связь 8 класс презентация
Содержание
- 2. Энергетические уровни Завершенные Обладают повышенной устойчивостью и стабильностью Атомы каких химических элементов имеют завершенный внешний энергетический
- 3. Na +11 ) _ 2 e ) _ 8 e ) _ 1 e Как можно
- 4. Na +11 ) _ 2 e ) _ 8 e ) _ 1 e _ ?
- 5. Атому натрия следует отдать с внешнего уровня один электрон. При этом предвнешний слой из 8 электронов
- 6. Cl +17 ) 2e ) 8e ) 7e ? 7e ? 1e Строение атома хлора.
- 7. Атому хлора выгоднее принять один недостающий электрон на свой внешний энергетический уровень, чем отдать 7 электронов.
- 8. Таким образом, существует 2 пути достижения завершенного внешнего энергетического уровня: - отдача («лишних») электронов внешнего уровня
- 9. Химические элементы Металлы - это элементы, атомы которых отдают внешние электроны. Неметаллы – это элементы, атомы
- 10. Задание. 1. Рассмотрите электронное строение атомов Na и Mg. 2. Сделайте вывод, у какого элемента металлические
- 11. Строение атомов Na + 11 ) ) ) ---- ---- ---- 2e 8e 1e Mg +12
- 12. Способность к отдаче электронов по периоду будет уменьшаться, т. е. металлические свойства будут ослабевать. Вывод:
- 13. Задание: 1. Рассмотрите строение атомов Si и Cl. 2. Сделайте вывод, у какого из элементов неметаллические
- 14. Строение атомов Si +14 ) ) ) ---- --- --- 2e 8e 4e Cl +17 )
- 15. В пределах периода способность принимать электроны усиливается, т. е. усиливаются неметаллические свойства. Причиной этого является: -
- 16. Рассмотрим строение атомов F и Cl F +9 ) ) --- --- 2e 7e Cl +17
- 17. В пределах одной и той же группы (в главной подгруппе) неметаллические свойства ослабевают, а металлические усиливаются,
- 18. Na +11 ) ) ) --- --- -- 2e 8e 0e Cl +17 ) ) )
- 19. +1 Na ион натрия Атомы металлов приобретают положительный заряд -1 Cl ион хлора атомы неметаллов –
- 20. +1 -1 +1 -1 Na + Cl = Na Cl хлорид натрия Связь между ионами называется
- 22. Скачать презентацию









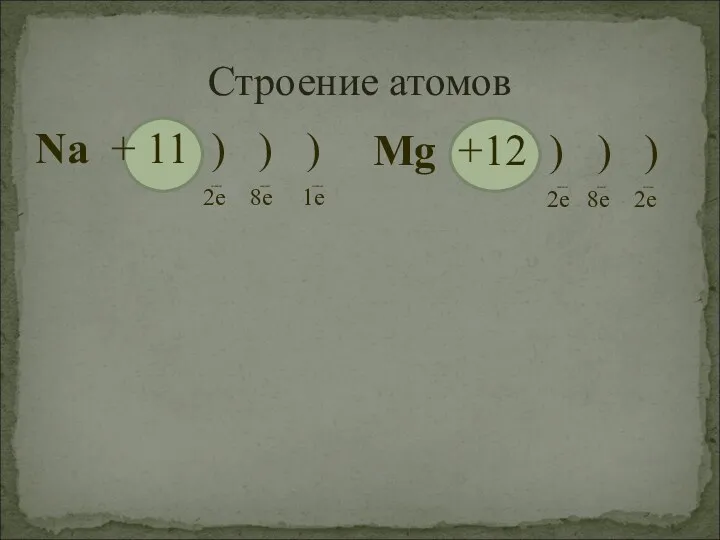









 Презентация на классный час
Презентация на классный час Замки України
Замки України Презентация Каргопольская глиняная игрушка
Презентация Каргопольская глиняная игрушка Анализ языка и стиля текста СМИ
Анализ языка и стиля текста СМИ Металургiйний комплекс України
Металургiйний комплекс України Articles A/THE
Articles A/THE Фрезерный станок НГФ110Ш3 и технология фрезерования
Фрезерный станок НГФ110Ш3 и технология фрезерования Тест по химии (8 класс) по теме Генетическая связь классов неорганических соединений для системы тестирования PROClass
Тест по химии (8 класс) по теме Генетическая связь классов неорганических соединений для системы тестирования PROClass Штамповка. Технология горячей объемной штамповки
Штамповка. Технология горячей объемной штамповки Родина
Родина Обобщение темы Треугольник
Обобщение темы Треугольник Древнегреческий философ Аристотель
Древнегреческий философ Аристотель Философия Аристотеля. Онтология
Философия Аристотеля. Онтология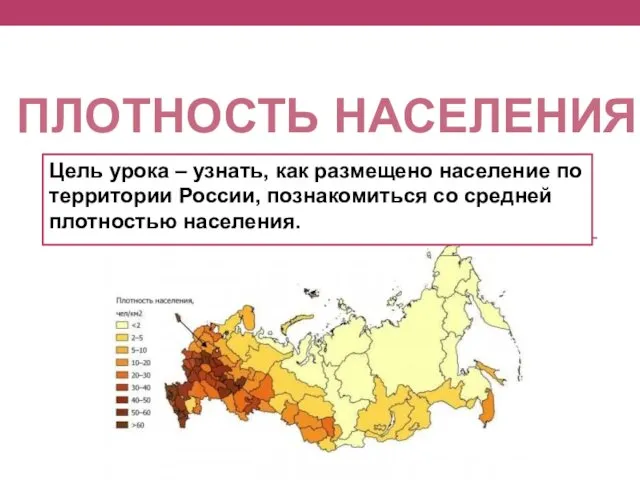 Размещение населения по территории России. Плотность населения
Размещение населения по территории России. Плотность населения Туберкулез. Первичное инфицирование
Туберкулез. Первичное инфицирование конкурс по экологии
конкурс по экологии Линейка моторных масел Лукойл Генезис
Линейка моторных масел Лукойл Генезис Основные параметры авиационных ГТД
Основные параметры авиационных ГТД Интерьер дома. Проект по технологии
Интерьер дома. Проект по технологии Основные модели развития науки о праве
Основные модели развития науки о праве Развивающие упражнения как средство повышения познавательной деятельности учащихся
Развивающие упражнения как средство повышения познавательной деятельности учащихся Чистохин Г.Д
Чистохин Г.Д Внутренняя политика в 1725-1762 гг
Внутренняя политика в 1725-1762 гг Профилактика эмоционального выгорания преподавателей и студентов
Профилактика эмоционального выгорания преподавателей и студентов Ваши возможности трудоустройства
Ваши возможности трудоустройства Снежинки
Снежинки Лекция 11. Классификация и возможности технических разведок
Лекция 11. Классификация и возможности технических разведок Отечественная война 1812 года в произведениях искусства
Отечественная война 1812 года в произведениях искусства