- Главная
- Без категории
- пезентация строение атома

Содержание
- 2. СОДЕРЖАНИЕ Строение атома Форма электронных орбиталей Распределение электронов Электронные конфигурации
- 3. Строение атома В конце XIX - начале XX века физики доказали, что атом является сложной частицей
- 4. следы альфа-частиц в кислороде
- 5. В результате проведенных исследований было установлено, что в атоме каждого элемента (кроме 1H) присутствуют протоны, нейтроны
- 6. . Форма d-орбиталей (число которых на соответствующем d-подуровне равно 5) - более сложная Форма s-орбитали -
- 7. распределение электронов
- 8. Электронные конфигурации атомов Электронные конфигурации атомов записываются в виде полных и сокращенных электронных формул: 1H 1s1
- 10. Скачать презентацию
Слайд 2
СОДЕРЖАНИЕ
Строение атома
Форма электронных орбиталей
Распределение электронов
Электронные конфигурации
СОДЕРЖАНИЕ
Строение атома
Форма электронных орбиталей
Распределение электронов
Электронные конфигурации
Слайд 3
Строение атома
В конце XIX - начале XX века физики доказали,
Строение атома
В конце XIX - начале XX века физики доказали,
что атом является сложной частицей и состоит из более простых (элементарных) частиц. Были обнаружены:
катодные лучи (английский физик Дж. Дж. Томсон, 1897 г.), частицы которых получили название электроны e− (несут единичный отрицательный заряд);
естественная радиоактивность элементов (французские ученые - радиохимики А. Беккерель элементов (французские ученые - радиохимики А. Беккерель и М. Склодовская-Кюри, физик Пьер Кюри, 1896 г.) и существование α-частиц (ядер гелия 4He2+);
наличие в центре атома положительно заряженного ядра (английский физик и радиохимик Э. Резерфорд, 1911 г.);
искусственное превращение одного элемента в другой, например азота в кислород (Э. Резерфорд, 1919 г.). Из ядра атома одного элемента (азота - в опыте Резерфорда) при соударении с α-частицей образовывалось ядро атома другого элемента (кислорода) и новая частица, несущая единичный положительный заряд и названная протоном (p+, ядро 1H)
наличие в ядре атома электронейтральных частиц - нейтронов n0 (английский физик Дж. Чедвик, 1932 г.).
катодные лучи (английский физик Дж. Дж. Томсон, 1897 г.), частицы которых получили название электроны e− (несут единичный отрицательный заряд);
естественная радиоактивность элементов (французские ученые - радиохимики А. Беккерель элементов (французские ученые - радиохимики А. Беккерель и М. Склодовская-Кюри, физик Пьер Кюри, 1896 г.) и существование α-частиц (ядер гелия 4He2+);
наличие в центре атома положительно заряженного ядра (английский физик и радиохимик Э. Резерфорд, 1911 г.);
искусственное превращение одного элемента в другой, например азота в кислород (Э. Резерфорд, 1919 г.). Из ядра атома одного элемента (азота - в опыте Резерфорда) при соударении с α-частицей образовывалось ядро атома другого элемента (кислорода) и новая частица, несущая единичный положительный заряд и названная протоном (p+, ядро 1H)
наличие в ядре атома электронейтральных частиц - нейтронов n0 (английский физик Дж. Чедвик, 1932 г.).
Слайд 4
следы альфа-частиц в кислороде
следы альфа-частиц в кислороде
Слайд 5
В результате проведенных исследований было установлено, что в атоме каждого элемента
В результате проведенных исследований было установлено, что в атоме каждого элемента
(кроме 1H) присутствуют протоны, нейтроны и электроны, причем протоны и нейтроны сосредоточены в ядре атома, а электроны - на его периферии (в электронной оболочке).
Число протонов в ядре равно числу электронов в оболочке атома и отвечает порядковому номеру этого элемента в Периодической системе.
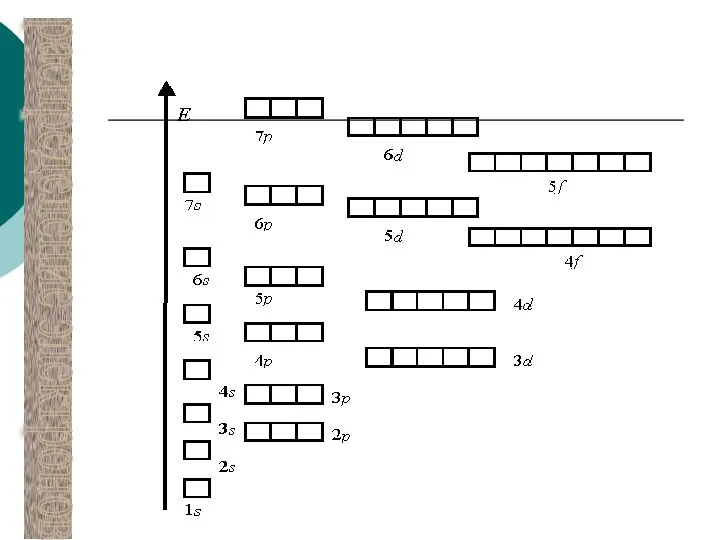
Электронная оболочка атома представляет собой сложную систему. Она делится на подоболочки с разной энергией (энергетические уровни); уровни, в свою очередь, подразделяются на подуровни, а подуровни включают атомные орбитали, которые могут различаться формой и размерами (обозначаются буквами s, p, d, f и др.).
Число протонов в ядре равно числу электронов в оболочке атома и отвечает порядковому номеру этого элемента в Периодической системе.
Электронная оболочка атома представляет собой сложную систему. Она делится на подоболочки с разной энергией (энергетические уровни); уровни, в свою очередь, подразделяются на подуровни, а подуровни включают атомные орбитали, которые могут различаться формой и размерами (обозначаются буквами s, p, d, f и др.).
Слайд 6
.
Форма d-орбиталей (число которых на соответствующем d-подуровне равно
.
Форма d-орбиталей (число которых на соответствующем d-подуровне равно
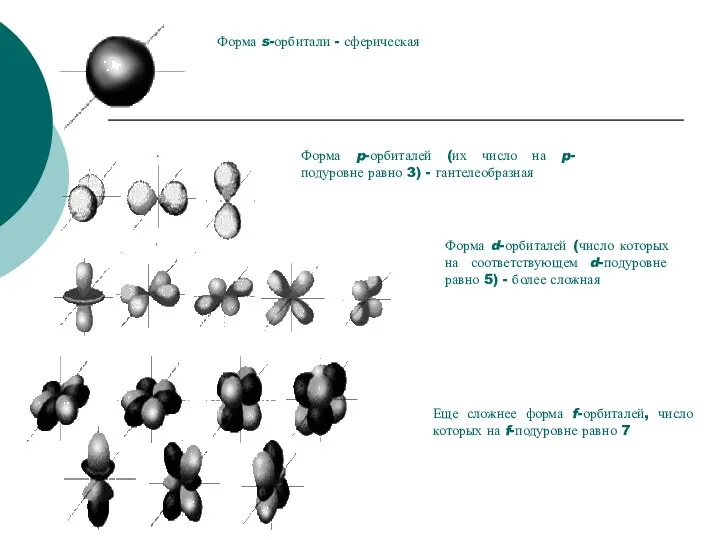
5) - более сложная
Форма s-орбитали - сферическая
Форма p-орбиталей (их число на p-подуровне равно 3) - гантелеобразная
Еще сложнее форма f-орбиталей, число которых на f-подуровне равно 7
Слайд 7
распределение электронов
распределение электронов
Слайд 8
Электронные конфигурации атомов
Электронные конфигурации атомов записываются в виде полных и сокращенных
Электронные конфигурации атомов
Электронные конфигурации атомов записываются в виде полных и сокращенных
электронных формул:
1H 1s1
2He 1s2
3Li 1s22s1 = [2He] 2s1
4Be 1s22s2 = [2He] 2s2
5B 1s2 2s2 2p1 = [2He] 2s2 2p1
6C 1s2 2s2 2p2 = [2He] 2s2 2p2
7N 1s2 2s2 2p3 = [2He] 2s2 2p3
8O 1s2 2s2 2p4 = [2He] 2s2 2p4
9F 1s2 2s2 2p5 = [2He] 2s2 2p5
10Ne 1s2 2s2 2p6 = [2He] 2s2 2p6
11Na 1s2 2s2 2p6 3s110Ne] 3s1
12Mg 1s2 2s2 2p6 3s2 = [10Ne] 3s2
13Al 1s2 2s2 2p6 3s2 3p1 = [10Ne] 3s2 3p1
14Si 1s2 2s2 2p6 3s2 3p2 = [10Ne] 3s2 3p2
15P 1s2 2s2 2p6 3s2 3p3 = [10Ne] 3s2 3p3
16S 1s2 2s2 2p6 3s2 3p4 = [10Ne] 3s2 3p4
17Cl 1s2 2s2 2p6 3s2 3p5 = [10Ne] 3s2 3p5
18Ar 1s2 2s2 2p6 3s2 3p6 = [10Ne] 3s2 3p6
19K 1s2 2s2 2p6 3s2 3p64s1 = [18Ar] 4s1
20Ca 1s2 2s2 2p6 3s2 3p6 4s2 = [18Ar] 4s2
21Sc 1s2 2s2 2p6 3s2 3p6 3d1 4s2 = [18Ar] 3d1 4s2
22Ti 1s2 2s2 2p6 3s2 3p6 3d2 4s2 = [18Ar] 3d2 4s2
- Предыдущая
Оптические иллюзии




 Окислительно-восстановительные реакции - электронная презентация для подготовки учащихся к выполнению задания С1 на ЕГЭ по химии
Окислительно-восстановительные реакции - электронная презентация для подготовки учащихся к выполнению задания С1 на ЕГЭ по химии Презентация - краеведческая викторина _Земля Ульяновская_
Презентация - краеведческая викторина _Земля Ульяновская_ игра сложи ракету
игра сложи ракету 20231016_zadachi_po_molekul._biologii_i_energozatratam_dlya_9_kl_microsoft_powerpoint
20231016_zadachi_po_molekul._biologii_i_energozatratam_dlya_9_kl_microsoft_powerpoint Цвет как средство выражения: тихие (глухие) и звонкие цвета
Цвет как средство выражения: тихие (глухие) и звонкие цвета Рабочий проект Жилая застройка
Рабочий проект Жилая застройка Общие положения об обязательствах
Общие положения об обязательствах Презентация Глобальные проблемы человечества
Презентация Глобальные проблемы человечества Доктор Яша из Огненного выпуска. Яков Григорьевич Ченибалаев
Доктор Яша из Огненного выпуска. Яков Григорьевич Ченибалаев кинодискуссия - как
кинодискуссия - как Доставка генетических конструкций в клетки человека. (Лекция 6)
Доставка генетических конструкций в клетки человека. (Лекция 6) Песнь о Роланде
Песнь о Роланде Исследование в области гуманитарных наук
Исследование в области гуманитарных наук презентация Правописание НЕ с именами существительными
презентация Правописание НЕ с именами существительными 10 ошибок в воспитании, которые все когда-нибудь совершали
10 ошибок в воспитании, которые все когда-нибудь совершали Основные положения теории логистики. Основные понятия и определения
Основные положения теории логистики. Основные понятия и определения Игра, как средство развития воображения и мышления у детей с ОВЗ
Игра, как средство развития воображения и мышления у детей с ОВЗ Семинар Добро пожаловать в проектные технологии!
Семинар Добро пожаловать в проектные технологии! Роль кожи в терморегуляции организма
Роль кожи в терморегуляции организма The “europolis” residential complex: a fantasy in palladian style traditions
The “europolis” residential complex: a fantasy in palladian style traditions Задания по сольфеджио и слушанию музыки для 1 класса
Задания по сольфеджио и слушанию музыки для 1 класса Посвящается учителям
Посвящается учителям Награда за терпение
Награда за терпение ПРЕЗЕНТАЦИЯ ЗАНИМАТЕЛЬНЫЙ ТРУД - ПОДЕЛКИ ИЗ ПРИРОДНОГО МАТЕРИАЛА
ПРЕЗЕНТАЦИЯ ЗАНИМАТЕЛЬНЫЙ ТРУД - ПОДЕЛКИ ИЗ ПРИРОДНОГО МАТЕРИАЛА Упрощение выражений
Упрощение выражений Режим труда и отдыха старшеклассников
Режим труда и отдыха старшеклассников Беременность и заболевания сердечно-сосудистой системы. Лекция 7
Беременность и заболевания сердечно-сосудистой системы. Лекция 7 Бизнес-план. Индивидуальное предприятие
Бизнес-план. Индивидуальное предприятие