Содержание
- 2. Исследование политропных процессов 1. Уравнение процесса выводится из аналитического выражения I закона термодинамики: dq=du+pdv; cdT=cvdT+pdv; (c-cv)dT-pdv=0.
- 3. Преобразование выражения I закона термодинамики Умножим полученное выражение на R/(c-cv): pdv+vdp-Rpdv/(c-cv)=0. С учетом уравнения Майера R=cp-cv:
- 4. Уравнение политропных процессов Разделим переменные, поделив уравнение на pv: ndv/v+dp/p=0. После интегрирования при n=сonst: nlnv+lnp=сonst; или:
- 5. Соотношения между параметрами На предыдущем слайде за показатель политропы принято выражение: n =[1-(cp-cv)/(c-cv)]= (c-cp)/(c-cv). 2. pv-диаграмму
- 6. Работа и теплота 4. Изменение внутренней энергии: Δu=cvΔT. 5. Выражения для работы также запишутся по аналогии
- 7. Показатель политропы и энергетический коэффициент Политропную теплоемкость можно найти из выражения показателя политропы: n=(c-cp)/(c-cv); nc-ncv=c-cp; приводим
- 8. Обобщающее значение политропных процессов Уравнение политропных процессов pvn=сonst справедливо для любого из частных термодинамических процессов: ●
- 9. Три группы политропных процессов На следующем слайде изображены все возможные термодинамические процессы. Изотерма T=сonst разделяет их
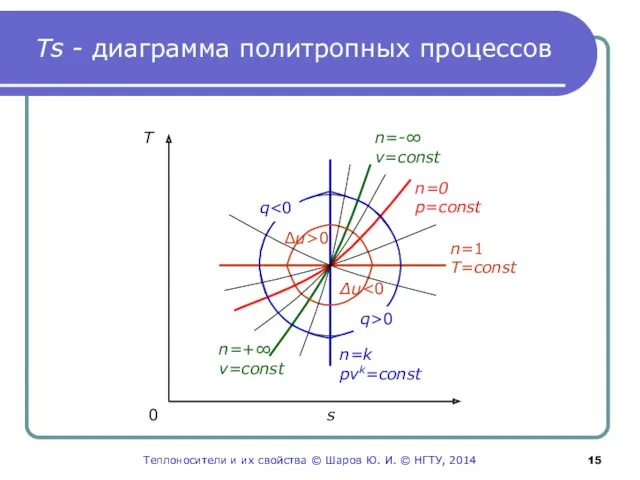
- 10. pv - диаграмма политропных процессов p n=-∞ v=сonst n=0 p=сonst n=1 T=сonst n=k pvk=сonst n=+∞ v=сonst
- 11. Энтропия идеального газа Обозначим через дифференциал энтропии выражение ds=dq/T, Дж/(кг·К). (1) Тогда теплоту можно определить как
- 12. Изменение энтропии в термодинамических процессах Проинтегрировав выражения (2) и (3), получим изменения энтропии в политропных процессах:
- 13. Изображение термодинамических процессов в Ts-диаграмме Из выражений (6, 7) следует, что изохора и изобара в Ts-
- 14. Изотерма и адиабата в Ts-диаграмме Так как T≠0, то ds=0, следовательно s=сonst – это и есть
- 15. Ts - диаграмма политропных процессов T 0 s n=0 p=сonst n=-∞ v=сonst n=1 T=сonst n=k pvk=сonst
- 16. Основные определения Равновесное состояние, при котором во всех точках объема давление, температура, удельный объем и физические
- 17. Обратимые и необратимые процессы Все реальные состояния газа и процессы – неравновесные и необратимые. Термодинамика изучает
- 18. II закон термодинамики То есть в I законе термодинамики речь идет о возможности преобразования тепловой энергии
- 19. Формулировки II закона термодинамики ● Карно: для преобразования тепловой энергии в механическую необходимы два источника теплоты
- 20. Круговые процессы или циклы Цикл – это замкнутый процесс, в конце которого рабочее тело возвращается в
- 21. Обратный цикл В процессе сжатия 261 работа газа: (lсж=пл.261542)>(lp=пл.132451), следовательно работа такого цикла отрицательная lц=lр-lсж=пл.13261. Цикл
- 22. Прямой цикл В процессе сжатия 271 работа газа: (lсж=пл.271542) то есть работа цикла положительная: lц=lр-lсж=пл.13271. Цикл
- 23. Цикл теплового двигателя Запишем для цикла 12341 I закон термодинамики q=q1-q2=l, так как изменение внутренней энергии
- 24. Обратимые и необратимые циклы Цикл называется обратимым, если он состоит только из обратимых процессов. Все реальные
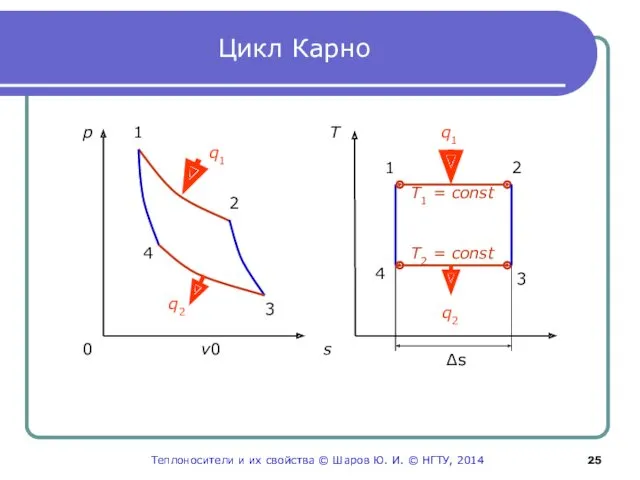
- 25. Цикл Карно 1 2 3 4 q1 q2 p 0 v 0 s T 1 2
- 26. Процессы, составляющие цикл Карно 1-2 изотермический подвод теплоты от энергоемкого горячего источника к рабочему телу; 2-3
- 27. Термический КПД цикла Карно Адиабатный процесс расширения газа самый подходящий, так как в нем нет потерь
- 28. Независимость ηt цикла Карно от физических свойств рабочего тела В выражении термического КПД нет физических свойств
- 29. Обратный цикл Карно Обратный цикл Карно характеризует совершенство передачи теплоты от холодного источника к горячему. 1-2
- 31. Скачать презентацию


























 Герои Великой Отечественной войны, уроженцы Тихвинского края
Герои Великой Отечественной войны, уроженцы Тихвинского края конструктивно-тональный рисунок натюрморта
конструктивно-тональный рисунок натюрморта Одуванчики из салфеток
Одуванчики из салфеток Концептуальные основы ФГОС НОО (статья и презентация)
Концептуальные основы ФГОС НОО (статья и презентация) Бойове застосування радіостанцій Harris КХ, УКХ діапазону. (Тема 2.8)
Бойове застосування радіостанцій Harris КХ, УКХ діапазону. (Тема 2.8) презентация к классному часу по теме Поговорим о настроении
презентация к классному часу по теме Поговорим о настроении Презентация учителя на конкурс Учитель года
Презентация учителя на конкурс Учитель года Исследовательский проект Влияние гигиены полости рта на здоровье зубов
Исследовательский проект Влияние гигиены полости рта на здоровье зубов Многонациональный Крым
Многонациональный Крым Основные виды вступлений
Основные виды вступлений Логопедическая работа с детьми с ограниченными возможностями (ДЦП)
Логопедическая работа с детьми с ограниченными возможностями (ДЦП) Колоректальный рак
Колоректальный рак Государственный строй Донецкой Народной Республики
Государственный строй Донецкой Народной Республики Комедия Дениса Ивановича Фонвизина Недоросль. Отрицательные герои. Тема воспитания и образования
Комедия Дениса Ивановича Фонвизина Недоросль. Отрицательные герои. Тема воспитания и образования Родительское собрание Друзья моего ребёнка
Родительское собрание Друзья моего ребёнка Методические указания для выполнения индивидуальных заданий. Проверка статистических гипотез
Методические указания для выполнения индивидуальных заданий. Проверка статистических гипотез Классификация судов промыслового флота
Классификация судов промыслового флота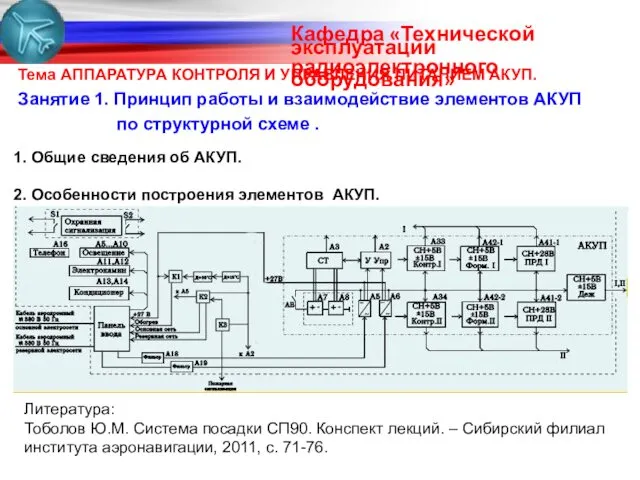 Принцип работы и взаимодействие элементов АКУП по структурной схеме
Принцип работы и взаимодействие элементов АКУП по структурной схеме Презентация Мы желаем здоровья вам
Презентация Мы желаем здоровья вам Социальный проект Строительство площадки для паркура и workout
Социальный проект Строительство площадки для паркура и workout Организация ухода за недоношенными детьми
Организация ухода за недоношенными детьми Танзания
Танзания Мотивация обучения
Мотивация обучения Робот-помощник
Робот-помощник Закон постоянства состава
Закон постоянства состава презентация Проблемы осанки
презентация Проблемы осанки Простые проценты
Простые проценты Неисправности посудомоечной машины: типы, причины и решение проблем
Неисправности посудомоечной машины: типы, причины и решение проблем