Слайд 2

Цель урока:
1. на основе положения металлов в ПСХЭ прийти к
пониманию особенностей строения их атомов и кристаллов (металлической химической связи и кристаллической металлической решетки).
2.Обобщить и расширить знания о физических свойствах металлов и их классификаций.
3. Развивать умение анализировать, делать выводы исходя из положения металлов в периодической системе химических элементов.
Слайд 3

МЕДЬ
Иду на мелкую монету,
В колоколах люблю звенеть,
Мне ставят памятник за это
И
знают: имя мое-….
Слайд 4

ЖЕЛЕЗО
Пахать и строить -
все он может,
если ему уголек в
том поможет…
Слайд 5

Металлы – это группа веществ с общими свойствами.
Слайд 6
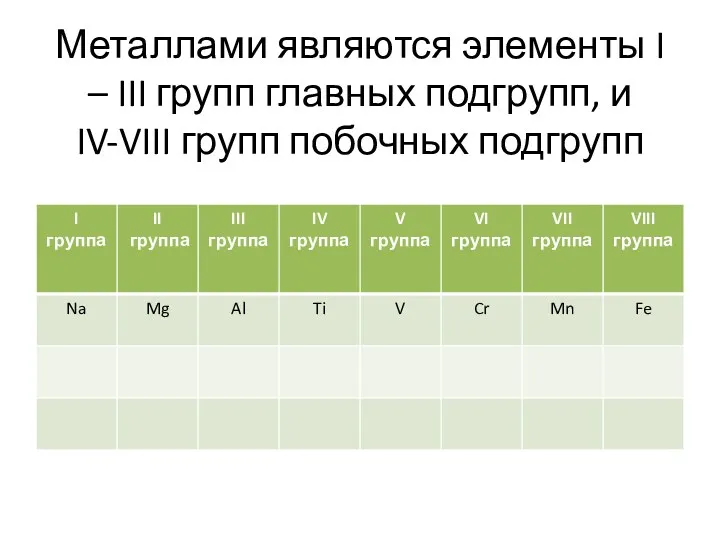
Металлами являются элементы I – III групп главных подгрупп, и IV-VIII
групп побочных подгрупп
Слайд 7
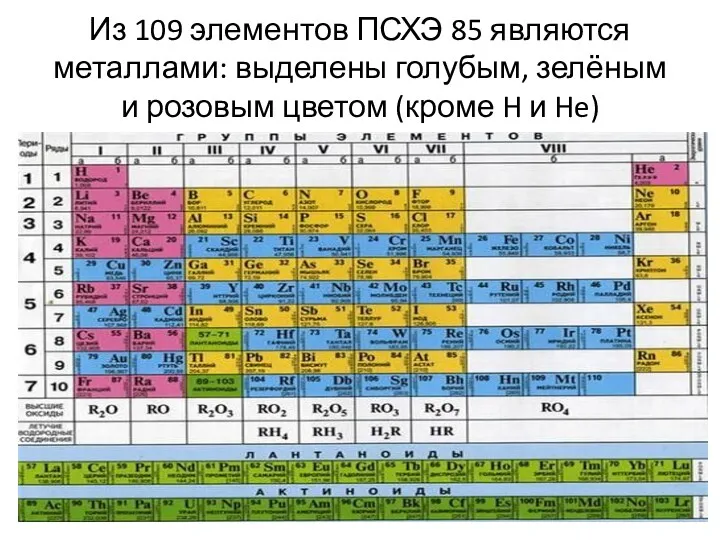
Из 109 элементов ПСХЭ 85 являются металлами: выделены голубым, зелёным и
розовым цветом (кроме H и He)
Слайд 8

Положение элемента в ПС отражает строение его атомов
Слайд 9

Слайд 10
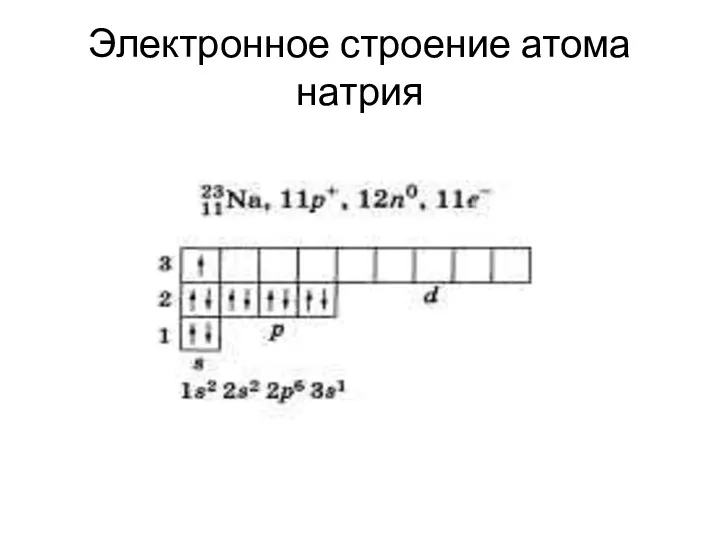
Электронное строение атома натрия
Слайд 11

Задание 2.
Составьте схему электронного строения атома алюминия и кальция в тетради
самостоятельно по примеру с атомом натрия.
Слайд 12

Вывод:
1. Металлы– элементы, имеющие на внешнем энергетическом уровне 1-3 электрона,
реже 4-6.
2. Металлы – это химические элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
Слайд 13

Металлическая химическая связь характеризуется:
- делокализацией связи, т.к. сравнительно небольшое количество электронов
одновременно связывают множество ядер;
- валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
- металлическая связь не обладает направленностью и насыщенностью.
Слайд 14
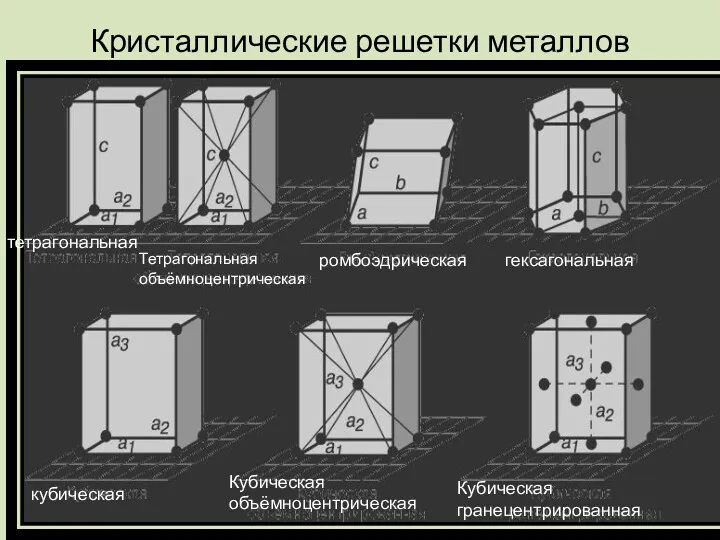
Кристаллические решетки металлов
тетрагональная
Тетрагональная объёмноцентрическая
ромбоэдрическая
гексагональная
кубическая
Кубическая объёмноцентрическая
Кубическая гранецентрированная
Слайд 15

Видеоинформация о кристаллах металлов
Слайд 16

Свойства металлов определяются строением их атомов.
Слайд 17

Проверьте усвоение знаний на уроке тестированием
Слайд 18

Слайд 19



















 Презентация Индустриальный пейзаж
Презентация Индустриальный пейзаж урок по технологии обработки древесины на деревообрабатывающих станках
урок по технологии обработки древесины на деревообрабатывающих станках 3 ноября 1918 года - выступление военных моряков в городе Киле
3 ноября 1918 года - выступление военных моряков в городе Киле Пасха 2019. Православная книга
Пасха 2019. Православная книга Презентация к классному часу Огонь - наш друг или враг...
Презентация к классному часу Огонь - наш друг или враг... Силикатозы. Основные клинические синдромы. Принципы терапии
Силикатозы. Основные клинические синдромы. Принципы терапии Русские народные волшебные сказки. 1 часть
Русские народные волшебные сказки. 1 часть What is autumn
What is autumn Древнегреческая лирика
Древнегреческая лирика 8 марта Диск
8 марта Диск Система и методы трудового права
Система и методы трудового права Орнамент в полосе (урок технологии, 1 класс)
Орнамент в полосе (урок технологии, 1 класс) Конкурс публикаций Математика и физика здоровья для обучающихся АГПУ
Конкурс публикаций Математика и физика здоровья для обучающихся АГПУ Приложение к уроку русского языка в 3 классе
Приложение к уроку русского языка в 3 классе Субпродукты
Субпродукты Германия. Традиции Германии
Германия. Традиции Германии Линзы. Построение в линзах. Формула тонкой линзы
Линзы. Построение в линзах. Формула тонкой линзы Робот-домовой. Проект
Робот-домовой. Проект Расстройства учебных навыков у детей
Расстройства учебных навыков у детей Виды реконструктивных вмешательств на челюстных костях и техника их проведения
Виды реконструктивных вмешательств на челюстных костях и техника их проведения Фотоотчёт по программе Разговор о правильном питании (1 класс)
Фотоотчёт по программе Разговор о правильном питании (1 класс) Классификация неметаллических материалов. Пластмассы
Классификация неметаллических материалов. Пластмассы Планеты земной группы
Планеты земной группы Налоговая политика России
Налоговая политика России Временное пломбирование корневых каналов
Временное пломбирование корневых каналов Инсектная аллергия
Инсектная аллергия Baseband R503
Baseband R503 Презентация 27
Презентация 27