Содержание
- 2. Некоторые несложные химические опыты можно проводить в домашних условиях с использованием веществ, которые можно найти на
- 3. Есть такие химические опыты, вещества для которых не всегда могут оказаться дома. Для проведения опытов можно
- 4. Цель нашей работы: получить кристаллы и попытаться объяснить происходящие явления. Объект исследования: безопасные и простые опыты
- 5. Задачи исследования: Изучить технику безопасности при проведении опытов по химии в домашних условиях. Провести опыт «Белые
- 6. «Химический» анекдот -Почему ты так поздно пришел из школы? -Мы ставили химический эксперимент. -Неужели он так
- 7. ТЕХНИКА БЕЗОПАСНОСТИ При проведении химических опытов нужно соблюдать технику безопасности: ! Не проводи опытов с нагреванием
- 8. Опыт «Белые иглы» 1. Этап: подготовка к опыту.
- 9. Опыт «Белые иглы» Приборы и реактивы: Поваренная соль (NaCl) сульфат меди (CuSO4) сульфит натрия (Na2SO3) вода(H2O),
- 10. Что нужно делать? Насыпать в пробирку на 1 см по высоте соль (NaCl), Добавить немного воды,
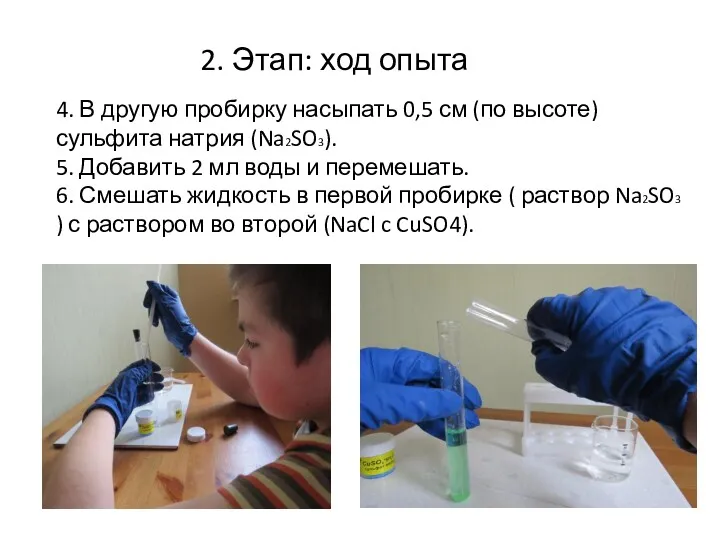
- 11. 4. В другую пробирку насыпать 0,5 см (по высоте) сульфита натрия (Na2SO3). 5. Добавить 2 мл
- 12. Наблюдения: выпадает светло-желтый осадок, который через некоторое время превращается в белый. Можно увидеть кристаллы. 2. Этап:
- 13. Почему так получилось? Сульфит меди (CuSO3) – соединение неустойчивое и в присутствии хлоридов превращается в хлорид
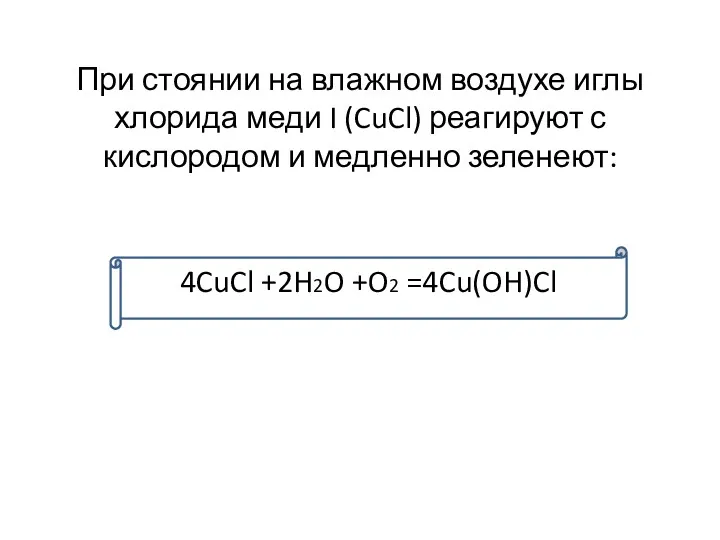
- 14. При стоянии на влажном воздухе иглы хлорида меди I (CuCl) реагируют с кислородом и медленно зеленеют:
- 15. Изучение ХИМИИ можно начинать в ЛЮБОМ ВОЗРАСТЕ, с простых и интересных ОПЫТОВ. Выводы: При проведении опытов
- 17. Скачать презентацию












 Arduino. Что это такое?
Arduino. Что это такое? Моё хобби
Моё хобби Хочу стать палеонтологом
Хочу стать палеонтологом Работа над ошибками в комплексной работе 3 класс.Осень в лесу.(И.Соколов –Микитов )
Работа над ошибками в комплексной работе 3 класс.Осень в лесу.(И.Соколов –Микитов ) Аппликация Собачка из кругов
Аппликация Собачка из кругов Закрепляем звук [л]
Закрепляем звук [л] Обобщение сведений о классах соединений
Обобщение сведений о классах соединений Методика развития речи как педагогическая наука
Методика развития речи как педагогическая наука Культура Беларуси
Культура Беларуси Сайт Strahovka59.ru
Сайт Strahovka59.ru Использование техники оригами во внеурочной деятельности как средство развития конструкторских умений учащихся
Использование техники оригами во внеурочной деятельности как средство развития конструкторских умений учащихся Пневмонии у детей
Пневмонии у детей Основы микробиологии и иммунологии
Основы микробиологии и иммунологии Чрезвычайные ситуации химического характера
Чрезвычайные ситуации химического характера Алтай - уникальный природный район Восточной Сибири
Алтай - уникальный природный район Восточной Сибири Кинезиологические упражнения как средство помощи детям с проблемами в развитии
Кинезиологические упражнения как средство помощи детям с проблемами в развитии Гепард. Места обитания. Основная причина вымирания
Гепард. Места обитания. Основная причина вымирания Система управления безопасностью полетов эксплуатанта. Управление факторами риска
Система управления безопасностью полетов эксплуатанта. Управление факторами риска культура профессионального общения педагога
культура профессионального общения педагога Презентация Работа с жанром притча как один способов формирования УУД на уроках ОРКСЭ
Презентация Работа с жанром притча как один способов формирования УУД на уроках ОРКСЭ Портфолио учителя начальных классов
Портфолио учителя начальных классов презентация Мин яратам, сине Татарстан
презентация Мин яратам, сине Татарстан Песенки -потешки в режиме дня для детей младшей группы
Песенки -потешки в режиме дня для детей младшей группы Предложения с однокоренными словами
Предложения с однокоренными словами кроме 4, 75, 76ASEPTIKA_I_ANTISEPTIKA
кроме 4, 75, 76ASEPTIKA_I_ANTISEPTIKA Моделирование химико-технологических процессов
Моделирование химико-технологических процессов Биологические основы паразитизма и трансмиссивных заболеваний
Биологические основы паразитизма и трансмиссивных заболеваний Германия в конце XIX – начале XX века. Борьба за место под солнцем
Германия в конце XIX – начале XX века. Борьба за место под солнцем