Содержание
- 2. План лекции Введение. Предмет науки химия. Основные разделы и понятия. Материя, вещество. Физические и химические свойства
- 3. п1. Введение. Предмет науки химия. Основные разделы и понятия. Материя, вещество. Физические и химические свойства вещества
- 4. 4 п.2. Строение вещества. Строение атома. Качественная и количественная характеристика состава атомов Квантово- механическая модель атома
- 5. Особенности микромира Квантование энергии: энергия микрообъекта изменяется не непрерывно, а дискретно, порциями (квантами) Корпускулярно-волновой дуализм микрообъекта
- 6. 6 п. 3. Строение электронных оболочек атомов. Квантовые числа. Энергетические уровни и подуровни, атомные электронные орбитали
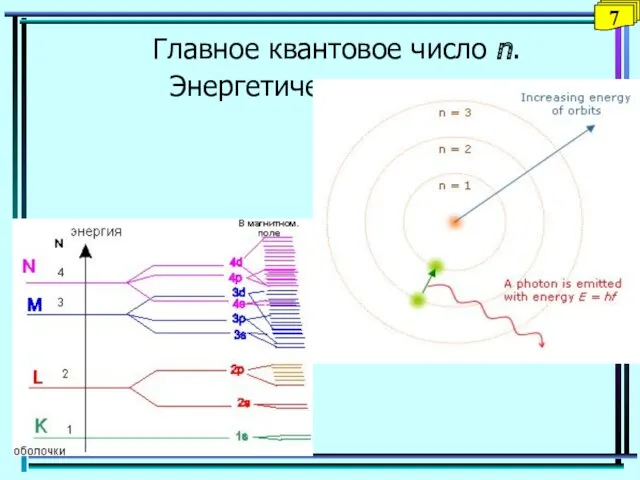
- 7. Главное квантовое число n. Энергетические уровни 7
- 8. Орбитальное квантовое число l. Энергетические подуровни. Формы электронных орбиталей l = 0, 1, 2, 3…… (n-1)
- 9. Формы электронных орбиталей 9
- 10. Магнитное квантовое число (ml) ml = -l…… -1, 0, +1……+l Значения l Значения ml 10 ml
- 11. Формы электронных орбиталей 11
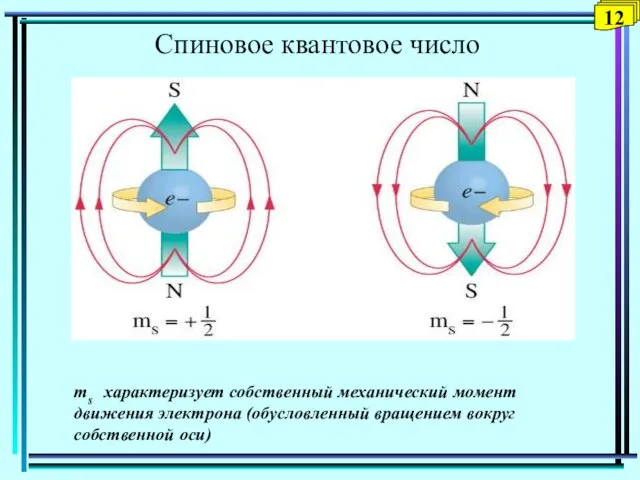
- 12. Спиновое квантовое число s 12 ms характеризует собственный механический момент движения электрона (обусловленный вращением вокруг собственной
- 13. Клечковский Всеволод Маврикиевич (1900 -1972) Россия, 1961 Правило Клечковского: Электрон занимает в основном состоянии уровень не
- 14. Вольфганг Эрнст Паули (1900 – 1958) Австрия, 1940 Лауреат нобелевской премии (1945) Принцип Паули: В атоме
- 15. Фридрих Хунд (1896 – 1997) Германия \ Правило Хунда: При данном значении l (т. е. в
- 16. 16 Электронная формула (конфигурация) атома – это условная запись, в которой все электроны атома распределены по
- 17. 17 п.5. Периодический закон Д.И. Менделеева. Сущность периодического закона. Строение периодическая системы. Распределение электронов согласно пр.
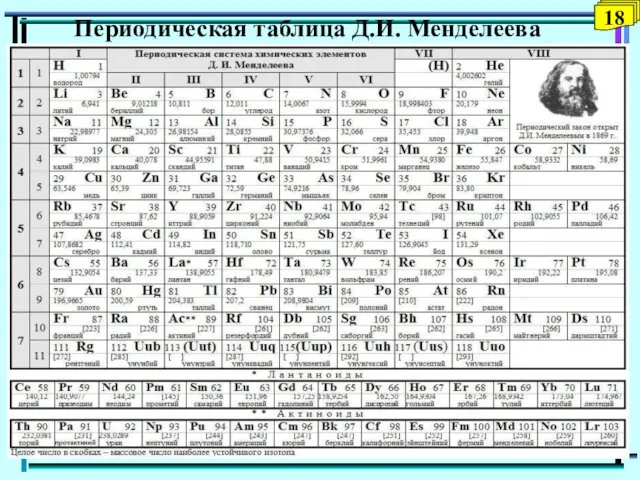
- 18. Периодическая таблица Д.И. Менделеева 18
- 19. Периодический закон "Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости
- 20. Периодический закон сегодня: "Свойства химических элементов, а также образуемых ими простых и сложных веществ находятся в
- 21. Периодическая система химических элементов Периодическая система химических элементов - естественная классификация химических элементов, являющаяся табличным выражением
- 22. 22
- 23. Периодичность Периодичность – это повторяемость химических и физических свойств элементов и их соединений по определенному направлению
- 24. Периодичность Вертикальная периодичность заключается в повторяемости свойств химических элементов в вертикальных столбцах Периодической системы и обусловливает
- 25. 25 Cвойства атомов: энергия ионизации энергия сродства к электрону электроотрицательность атомный и ионный радиус металлические свойства
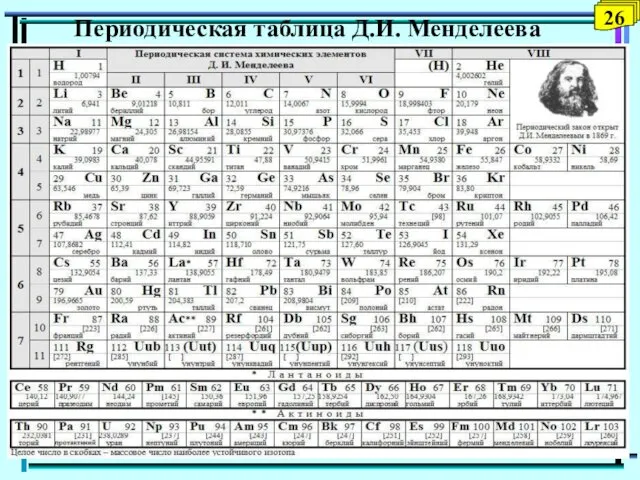
- 26. Периодическая таблица Д.И. Менделеева 26
- 27. Энергия ионизации Энергия (потенциал) ионизации атома Ei - минимальная энергия, необходимая для удаления электрона из атома:
- 28. Сродство к электрону Сродство атома к электрону Ee – способность атомов присоединять добавочный электрон и превращаться
- 29. Электроотрицательность (абсолютная электроотрицательность) Относительная электроотрицательность: χLi = 1 χF = 4 Лайнус-Карл ПОЛИНГ (28.02.1901 – 19.08.1994)
- 30. Изменение свойств атомов слева направо (в малых периодах): заряд ядер атомов увеличивается; число электронных слоев (энергетических
- 31. П.6. Электронные s-,p-,d- и f- семейства устанавливают связь между положением элемента в периодической системе и электронным
- 32. Литература Кафедра химии УрГАУ/ ВКонтакте Vk.com/club86527277 Тел кафедры: 221-41-03 1. О.С. Габриелян и др. Химия. Учебное
- 33. 33 Вопросы к экзамену по общей и неорганической химии 1. Понятия: материя, вещество. Предмет науки химия
- 35. Скачать презентацию




























 СТРУКТУРА САМОАНАЛИЗА ПРОФЕССИОНАЛЬНОЙ ДЕЯТЕЛЬНОСТИ ПЕДАГОГА (самопрезентация результатов педагогической деятельности учителя)
СТРУКТУРА САМОАНАЛИЗА ПРОФЕССИОНАЛЬНОЙ ДЕЯТЕЛЬНОСТИ ПЕДАГОГА (самопрезентация результатов педагогической деятельности учителя) Графика
Графика Конструирование печатного узла и печатной платы. Лекция №10 (1)
Конструирование печатного узла и печатной платы. Лекция №10 (1) География населения мира. Обобщающий урок
География населения мира. Обобщающий урок Система образования
Система образования урок :Биосфера
урок :Биосфера Презентация исследовательско-творческого проекта Как вырастить витаминку на подоконнике? Пословицы про лук
Презентация исследовательско-творческого проекта Как вырастить витаминку на подоконнике? Пословицы про лук Зигзагообразная строчка
Зигзагообразная строчка Библия и Евангелие
Библия и Евангелие 65 лет войне
65 лет войне Программа развития для ДОУ
Программа развития для ДОУ Производство автомобилей в Китае
Производство автомобилей в Китае Презентации для уроков Истории и культуры Санкт-Петербурга
Презентации для уроков Истории и культуры Санкт-Петербурга К 75 летию снятия блокады Ленинграда
К 75 летию снятия блокады Ленинграда Принцип построения МРТ
Принцип построения МРТ Презентация открытого урока по теме Рельеф Мордовии
Презентация открытого урока по теме Рельеф Мордовии Региональное устройство Российской Федерации. Конституция РФ
Региональное устройство Российской Федерации. Конституция РФ Первая мировая война
Первая мировая война Мобильное приложение для москвичей и гостей столицы
Мобильное приложение для москвичей и гостей столицы Шаблон (фон) презентации Скоро в школу
Шаблон (фон) презентации Скоро в школу Гжель
Гжель Детство, опаленное войной
Детство, опаленное войной Русская народная сказка Петух и собака. Урок чтения, 1 класс
Русская народная сказка Петух и собака. Урок чтения, 1 класс Оптимизация портфеля заказов ОАО ОЭМК
Оптимизация портфеля заказов ОАО ОЭМК Американская общественно-политическая мысль
Американская общественно-политическая мысль Молдавия
Молдавия Функции многих переменных (лекция 8)
Функции многих переменных (лекция 8) Опасные химические вещества и объекты
Опасные химические вещества и объекты