Содержание
- 2. Предметно-количественный учет лекарственных препаратов (приказ Минздрава России от 22.04.2014 г. № 183н «Об утверждении перечня лекарственных
- 3. Предметно-количественный учет лекарственных препаратов
- 4. Федеральный закон от 8 января 1998 г. № 3-ФЗ «О наркотических средствах и психотропных веществах» Наркотические
- 5. Федеральный закон от 8 января 1998 г. № 3-ФЗ «О наркотических средствах и психотропных веществах» Психотропные
- 6. Федеральный закон от 8 января 1998 г. № 3-ФЗ «О наркотических средствах и психотропных веществах» Прекурсоры
- 7. Постановление Правительства РФ от 30 июня 1998 г. № 681 (от 03.06.2010 № 398, от 29.07.2010
- 8. Список III
- 9. К списку III дополнительно отнесены следующие препараты: Постановление Правительства РФ №78 от 04.02. 2013 «О внесении
- 10. Таблица 1 списка IV ПККН
- 11. Федеральный закон от 08 января 1998 г. № 3-ФЗ «О наркотических средствах и психотропных веществах» Основные
- 12. Лицензирование деятельности, связанной с оборотом наркотических средств, психотропных веществ и их прекурсоров Процедура лицензирования деятельности, связанной
- 13. Лицензионное требование по учету НС и ПВ т) соблюдение лицензиатом, осуществляющим деятельность по обороту наркотических средств
- 14. Предметно-количественный учет лекарственных препаратов Лекарственные средства - фармацевтические субстанции и лекарственные препараты НС и ПВ и
- 18. Учет и отчетность в работе с наркотическими средствами и психотропными веществами Постановление Правительства РФ от 4
- 20. Правила ведения и хранения журналов регистрации Юридические лица, а также их подразделения, осуществляющие виды деятельности, связанные
- 21. Правила ведения и хранения журналов регистрации Журналы регистрации должны быть сброшюрованы, пронумерованы и скреплены подписью руководителя
- 22. Правила ведения и хранения журналов регистрации Записи в журналах регистрации производятся лицом, ответственным за их ведение
- 23. Правила ведения и хранения журналов регистрации Нумерация записей в журналах регистрации по каждому наименованию наркотического средства
- 24. Правила ведения и хранения журналов регистрации Исправления в журналах регистрации заверяются подписью лица, ответственного за их
- 25. Правила ведения и хранения журналов регистрации На основании записей в соответствующем журнале регистрации юридические лица представляют
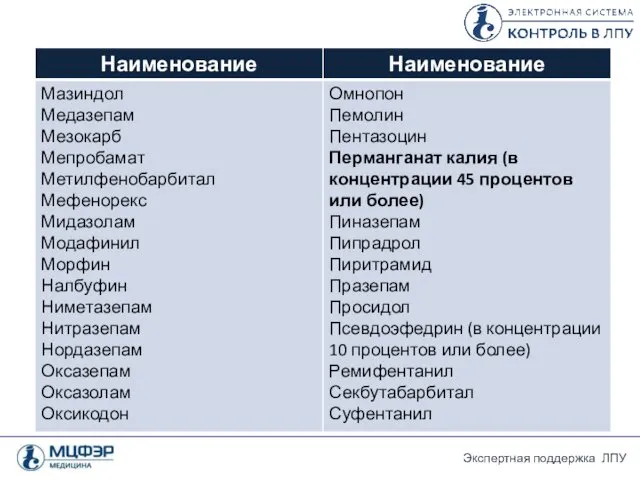
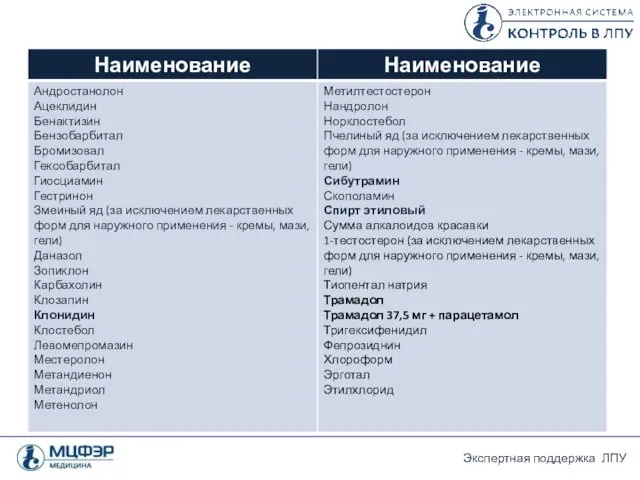
- 26. Перечень лекарственных препаратов, подлежащих ПКУ 2. Лекарственные средства , субстанции и ЛП, содержащие сильнодействующие и ядовитые
- 27. Ответственность за нарушения в сфере оборота ядовитых и сильнодействующих ЛС наступает в случае нарушений, на которые
- 28. Перечень лекарственных препаратов, подлежащих ПКУ Положение о лицензировании фармацевтической деятельности (утверждено Постановлением Правительства РФ от 22
- 30. Комбинированные лекарственные препараты, включенные в пункт 5 Порядка отпуска физическим лицам лекарственных препаратов для медицинского применения,
- 31. 1) кодеин или его соли (в пересчете на чистое вещество) в количестве до 20 мг включительно
- 32. 6) эфедрина гидрохлорид в количестве до 50 мг включительно (на 1 дозу твердой лекарственной формы); 7)
- 33. Письмо Минздрава России от 03.09.2014 № 25-4/ 2-6691 По 3 разделу в письме приведены некоторые торговые
- 35. Правила регистрации операций, связанных с обращением ЛС, подлежащих ПКУ Приказ Минздрава РФ от 17.06.2013 № 378н
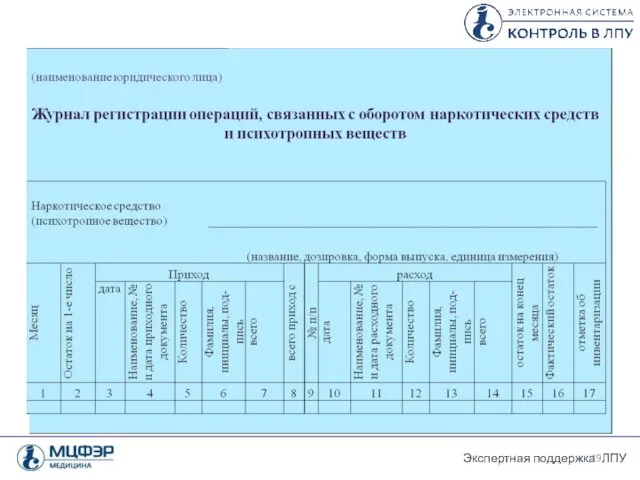
- 36. 3 формы журналов регистрации Форма журнала регистрации ПКУ у производителей ЛС и в организациях оптовой торговли
- 37. Порядок ведения журналов ПКУ лекарственных препаратов Все формы журналов состоят из приходной и расходной части. В
- 38. Порядок ведения журналов ПКУ лекарственных препаратов Журналы учета оформляются на календарный год. По истечении года пустые
- 40. Скачать презентацию


































 Интеллектуальные развивающие игры
Интеллектуальные развивающие игры Брачный договор
Брачный договор Ректоцеле. Эпидемиология
Ректоцеле. Эпидемиология Профилактика онкологических заболеваний в России
Профилактика онкологических заболеваний в России Построение процесса обучения на основе инновационных технологий. Экспериментирование при использовании нетрадиционных материалов в художественной деятельности детей
Построение процесса обучения на основе инновационных технологий. Экспериментирование при использовании нетрадиционных материалов в художественной деятельности детей ИГРА-ПРЕЗЕНТАЦИЯ ГДЕ ЗВУК Л
ИГРА-ПРЕЗЕНТАЦИЯ ГДЕ ЗВУК Л Презентация выступления Роль здоровье сберегающей пространственной предметно-развивающей среды в развитии активной деятельности детей
Презентация выступления Роль здоровье сберегающей пространственной предметно-развивающей среды в развитии активной деятельности детей Текстовые задачи. Классификация видов простых задач
Текстовые задачи. Классификация видов простых задач Олимпиада по изобразительному искусству. Тест 4-5 класс
Олимпиада по изобразительному искусству. Тест 4-5 класс Сказочные лабиринты игр Воскобовича
Сказочные лабиринты игр Воскобовича Вывихи. Классификация
Вывихи. Классификация Нерациональное питание и его влияние на развитие различной патологии
Нерациональное питание и его влияние на развитие различной патологии остроградский убъ бюв ыф
остроградский убъ бюв ыф Химическая формула. Относительная молекулярная масса вещества.
Химическая формула. Относительная молекулярная масса вещества. Рукоделие и его виды
Рукоделие и его виды Великие женщины великой России
Великие женщины великой России книги
книги Социальная реклама. Разработка социальной кампании по защите окружающей среды от мусора
Социальная реклама. Разработка социальной кампании по защите окружающей среды от мусора В гости к Дедушке Морозу (для дошкольников)
В гости к Дедушке Морозу (для дошкольников) Корреляционный анализ
Корреляционный анализ Провода и электрические соединения. Занятие 2
Провода и электрические соединения. Занятие 2 Повышение экономической эффективности деятельности ООО Киноцентр Вологда
Повышение экономической эффективности деятельности ООО Киноцентр Вологда Жизнь пресного водоёма
Жизнь пресного водоёма Chování spotřebitele, formování a elasticity poptávky na trhu statků
Chování spotřebitele, formování a elasticity poptávky na trhu statků Рентгеноанатомия глотки и пищевода
Рентгеноанатомия глотки и пищевода Народные промыслы
Народные промыслы Мир художественной культуры Эпохи Возрождения
Мир художественной культуры Эпохи Возрождения Жизнь и творчество Ван Гога
Жизнь и творчество Ван Гога