Содержание
- 2. Химические реакции (химические превращения; химические явления) – это процессы, в результате которых из одних веществ образуются
- 3. Закон сохранения массы веществ. Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ. М В
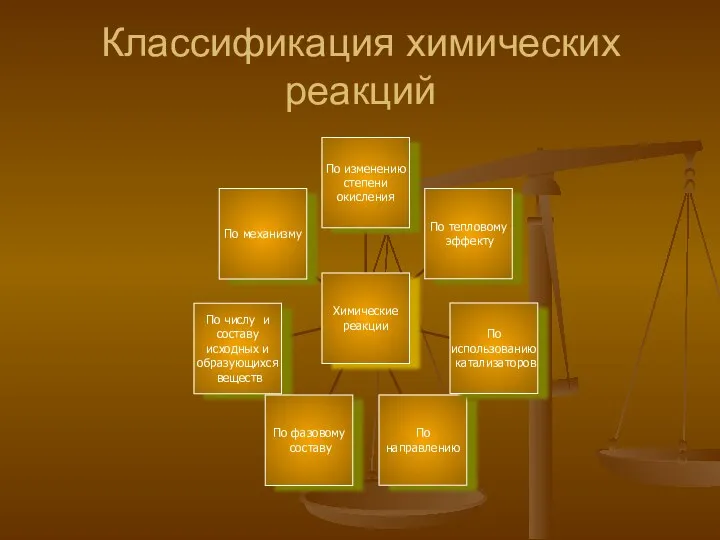
- 4. Классификация химических реакций
- 5. По числу и составу исходных и образующихся веществ Разложения Соединения Обмена Замещения задание : выписать из
- 6. По изменению степени окисления Al + S Al2S3 HCl + NaOH NaCl + H2O Zn +
- 7. По тепловому эффекту Исходные Продукты + вещества реакции - ( разрыв хим. ( образование связи) хим.
- 8. По направлению Хим. Реакции. Необратимые Обратимые протекают в одном протекают одновременно направлении ( до конца) в
- 9. Закрепление Задание: К какому типу реакций относится данные процессы? Уравнять реакции. Fe + O2 Fe3O4 +
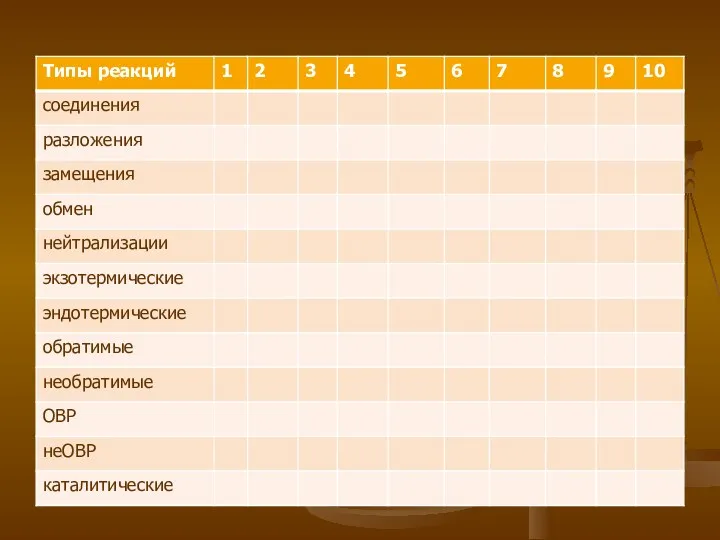
- 10. Творческое задание Охарактеризуйте химическую реакцию, результаты занести в таблицу 1. разложение перманганата калия 2. магний взаимодействует
- 12. Кинетика – наука о скорости химических реакций. Реакции Гомогенные Гетерогенные H2( г ) + O2( г
- 13. Факторы влияющие на скорость химических реакций. Природа реагирующих веществ. Температура. Концентрации реагирующих веществ. Площадь соприкосновения реагирующих
- 14. Температура Повышение температуры на каждые 10 градусов скорость реакции возрастает в 2-4 раза (температурный коэффициент). Вант-Гофф.
- 15. Природа реагирующих веществ Zn + CH3COOH Ca + H2O Zn + HCl Na + H2O U1
- 16. Концентрация реагирующих веществ Скорость химической реакции прямо пропорционально произведению концентрации реагирующих веществ (закон действующих масс). nA
- 17. Катализ Определение Виды катализа Ингибиторы
- 18. Химическое равновесие Прямая и обратная реакции 2SO2 + O2 2SO3 U( прям ) = U( обрат
- 19. Влияние на химическое равновесие Температура Повышение t хим. равн. смещается - Q (эндо) Понижение t хим.
- 20. Концентрация повышение [исход. вещ-в] хим. равн. смещ продуктам реакции понижение [исход. вещ-в] хим. равн. смещ исходным
- 21. Давление Повышение P хим. равн. смещ уменьшению объёму Понижение P хим. равн. смещ увеличению объёму Задание:
- 23. Скачать презентацию
















![Концентрация повышение [исход. вещ-в] хим. равн. смещ продуктам реакции понижение](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/508578/slide-19.jpg)

 Оказание первой медицинской помощи в чрезвычайных ситуациях
Оказание первой медицинской помощи в чрезвычайных ситуациях Элементы оборудования информационно-вычислительных комплексов. Системные шины. (Лекция 3а)
Элементы оборудования информационно-вычислительных комплексов. Системные шины. (Лекция 3а) Резание заготовок из металла, проволок
Резание заготовок из металла, проволок Урок 30
Урок 30 Балалардагы бронхит
Балалардагы бронхит ПО ЭКОЛОГИИ ДЛЯ СЕМИНАРА2
ПО ЭКОЛОГИИ ДЛЯ СЕМИНАРА2 Звукоизоляционные материалы
Звукоизоляционные материалы Мікропроцесорна техніка. [email protected]/5 PWM
Мікропроцесорна техніка. [email protected]/5 PWM Религиозные ценности и свобода совести
Религиозные ценности и свобода совести Презентация Игра в жизни ребенка
Презентация Игра в жизни ребенка Особенности организации оздоровительной кампании детей Свердловской области в 2018 году
Особенности организации оздоровительной кампании детей Свердловской области в 2018 году Электромотор. Схема подключения
Электромотор. Схема подключения Оптимизация инфраструктуры напольной аппаратуры с использованием новой разработки САУТ-ЦМ/НСП
Оптимизация инфраструктуры напольной аппаратуры с использованием новой разработки САУТ-ЦМ/НСП Презентация Школьный музей как центр формирования воспитательного пространства ОУ
Презентация Школьный музей как центр формирования воспитательного пространства ОУ презентация к проекту Вагоны грузовогои пассажирского парков
презентация к проекту Вагоны грузовогои пассажирского парков Профилактика нарушений звукопроизношения
Профилактика нарушений звукопроизношения Важность использования напорно -всасывающего рукава
Важность использования напорно -всасывающего рукава Мой наставник и друг
Мой наставник и друг Пиломатериалы. Виды и классификация пиломатериалов
Пиломатериалы. Виды и классификация пиломатериалов Database
Database Формы в HTML-документе. Элементы форм
Формы в HTML-документе. Элементы форм Презентация: Что подарить Снеговику
Презентация: Что подарить Снеговику Александр Григорьевич Столетов
Александр Григорьевич Столетов Информационный стенд о проведении капитального ремонта в многоквартирном доме
Информационный стенд о проведении капитального ремонта в многоквартирном доме Импульс
Импульс Олимпийские игры в древней Греции
Олимпийские игры в древней Греции Обрабатывающая промышленность. Металлургия
Обрабатывающая промышленность. Металлургия Воинские звания
Воинские звания