Содержание
- 2. План: Определение гомологического ряда алканов Метан Строение алканов Номенклатура алканов Изомерия алканов Получение алканов Физические свойства
- 3. Определение Алканы – алифатические (ациклические) углеводороды, в молекулах которых атомы углерода связаны между собой одинарными σ-связями,
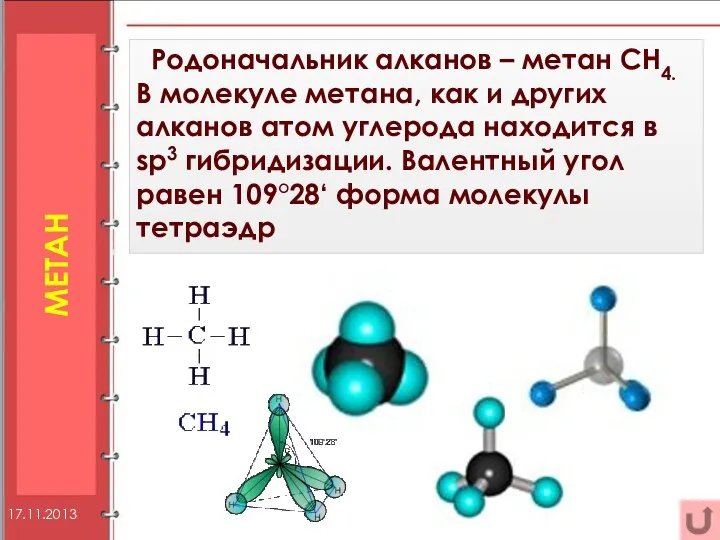
- 4. Метан Родоначальник алканов – метан СН4. В молекуле метана, как и других алканов атом углерода находится
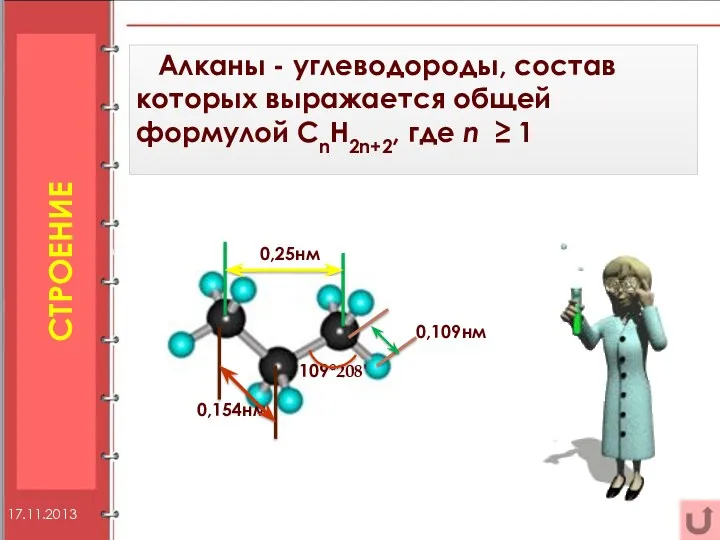
- 5. Строение Алканы - углеводороды, состав которых выражается общей формулой CnH2n+2, где n 1 0,25нм 0,109нм
- 6. Закрепим Общая формула алканов CnH2n+2 Гибридизация sp3 Все связи атома углерода направлены к вершинам тетраэдра Все
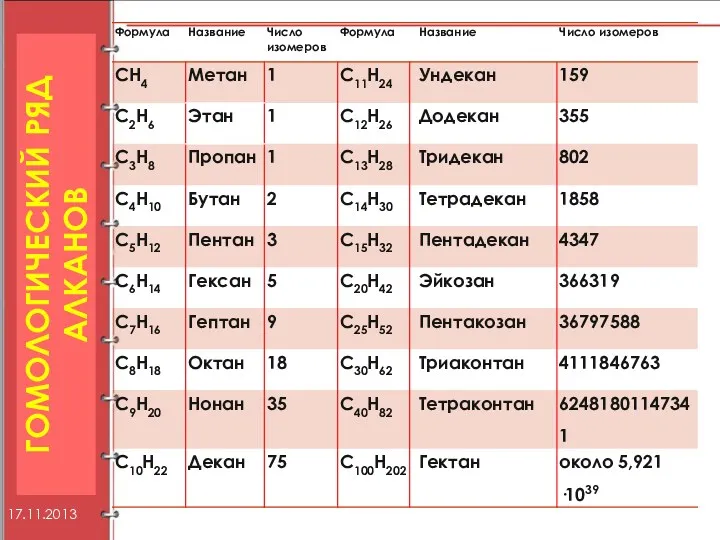
- 7. ГОМОЛОГИЧЕСКИЙ РЯД АЛКАНОВ
- 8. НОМЕНКЛАТУРА Найти самую длинную цепь; Пронумеровать цепь с того конца где ближе разветвление; Выделить заместители; Место
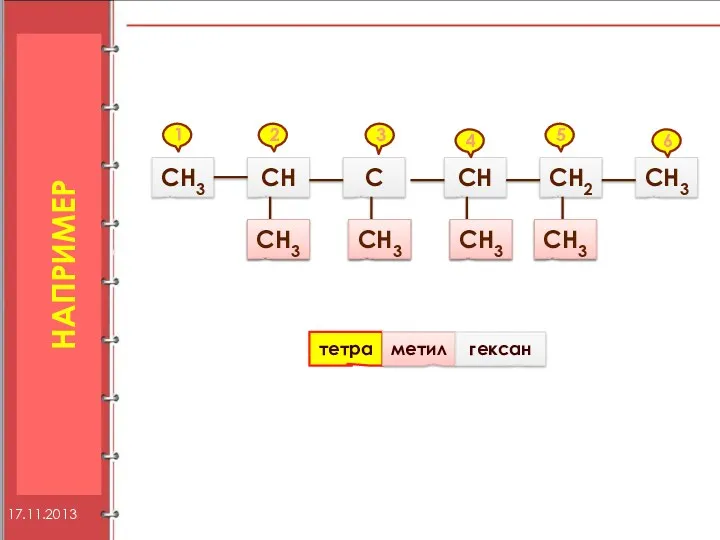
- 9. Например СН3 СН С СН3 СН3 СН3 СН СН2 СН3 СН3 1 2 3 4 5
- 10. Изомерия Изомерия углеродного скелета c C4;
- 11. 2. Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг σ -связей С–С, называют
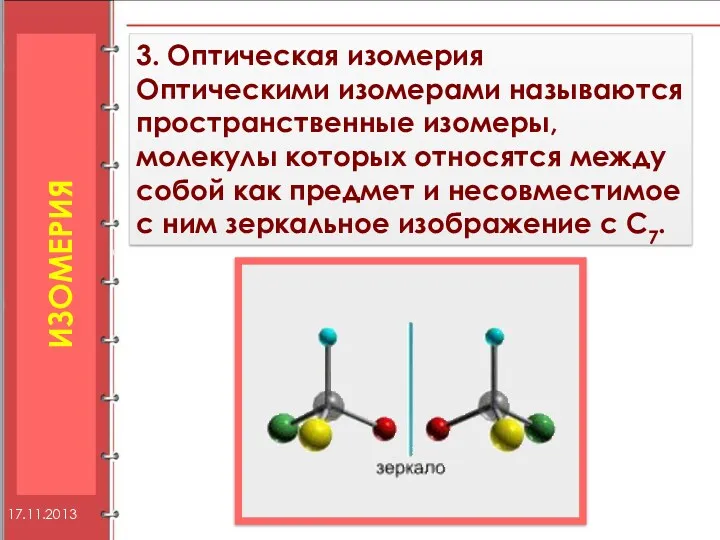
- 12. 3. Оптическая изомерия Оптическими изомерами называются пространственные изомеры, молекулы которых относятся между собой как предмет и
- 13. Получение метана Разложение карбида алюминия: Al4C3 + 12H2O = 3CH4↑ + 4Al(OH)3; Синтез из простых веществ
- 14. Получение алканов Промышленные способы: Выделение из природного газа, нефти, твердых парафинов; Химическая переработка угля; Получение на
- 15. Получение алканов В ПРОМЫШЛЕННОАСТИ 1. Природные источники углеводородов: нефть, уголь, природный и попутный нефтяной газ. Содержание
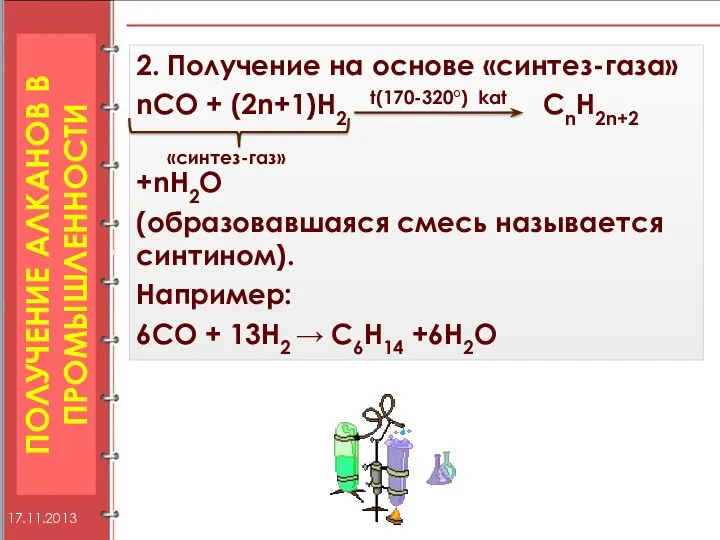
- 16. Получение алканов В ПРОМЫШЛЕННОСТИ 2. Получение на основе «синтез-газа» nCO + (2n+1)H2 t(170-320°) kat CnH2n+2 «синтез-газ»
- 17. ПОЛУЧЕНИЕ АЛКАНОВ В ЛАБОРАТОРИИ Реакция Вюрца (1855г): R' – I + Na + I – R''
- 18. 2. Электролиз солей одноосновный карбоновых кислот. Реакция Кольбе (Ме - одновалентный) 2R-COONa + H2O → R
- 19. 3. Декарбоксилирование солей одноосновный карбоновых кислот реакция Дюма: ПОЛУЧЕНИЕ АЛКАНОВ В ЛАБОРАТОРИИ R-COONa + NaOH →
- 20. 4. Каталитическое гидрирование (гидрогенизация) непредельных углеводородов (катализаторы Ni, Pt, Pd, t и P) СnH2n + 2H2
- 21. 5. Получение из производных алканов. R-Mg-X + H-OH → R – H + Mg(OH)X CH3-Mg-Cl +
- 22. С1 – С4 – газы без запаха и цвета; С5 – С17 – жидкости без цвета
- 23. ХИМИЧЕСКИЕ СВОЙСТВА
- 24. Реакции радикального замещения (SR).
- 25. Галогенирование CH4 + Cl2 → HCl + CH3Cl (хлорметан или хлористый метил) CH3Cl + Cl2 →
- 26. Реакционная способность убывает в рядах: F2 > Cl2 > Br2 > I2 R3C – H >
- 27. Инициирование (зарождение цепи) Cl2 → 2Cl · 2. Рост (развитие) цепи CH4 + Cl· → ·CH3
- 28. 2. Нитрование (реакция Коновалова), при температуре 140°С, 13% азотной кислотой CnH2n+2 + HO – NO2 →
- 29. РЕАКЦИИ ОКИСЛЕНИЯ
- 30. 1. Горение или полное окисление СН4 + 2О2 → СО2 + Н2О +880кДж Общее уравнение: CnH2n+2
- 31. 2. Неполное окисление: А) метана: 2CH4 + O2 → 2CH3OH +3H2 (kat, t) b) 2CH4 +
- 32. Термические превращения
- 33. А) Термическое разложение метана при сильном нагревании (выше 1000°С) без доступа воздуха (пиролиз) СН4 → 2С
- 34. В) Крекинг разрыв связи С – С С9Н20 → С4Н10 + С5Н10 600°С С9Н20 → С5Н12
- 35. Г ) Дегидрирование C2H6 → C2H4 + H2 (300°, Cr2O3, Р) Д) Дегидроциклизация (ароматизация) характерна для
- 36. Е) изомеризация – превращение алкана нормального строения в разветвленный изомер (t, Al2O3) СН3 – СН2 –
- 37. Процесс конверсии протекает при высокой температуре (800 - 900°) и в присутствии никелевого катализатора. В этих
- 39. Скачать презентацию
























 Классификация иглокожих
Классификация иглокожих Психологические особенности детей подросткового возраста
Психологические особенности детей подросткового возраста Ток и заряд в магнитном поле
Ток и заряд в магнитном поле Производство сварных воздуховодов
Производство сварных воздуховодов Формирование телевидения
Формирование телевидения Тропинка истории села Закубежье
Тропинка истории села Закубежье Происхождение романских языков
Происхождение романских языков A weather and clothes
A weather and clothes Презентация Изготовление кормушки
Презентация Изготовление кормушки Проблема применения лекарственных препаратов с недоказанной эффективностью
Проблема применения лекарственных препаратов с недоказанной эффективностью Bluetooth 101. Training for Plantronics
Bluetooth 101. Training for Plantronics Биологическое действие радиоактивных излучений
Биологическое действие радиоактивных излучений Передвижная поверочная лаборатория средств измерения давления филиала Минское РПУ
Передвижная поверочная лаборатория средств измерения давления филиала Минское РПУ Історія і перспективи робототехніки
Історія і перспективи робототехніки Свойства опасных и вредных веществ
Свойства опасных и вредных веществ Алгоритмические задачи с исполнителями
Алгоритмические задачи с исполнителями Особенности коррозии в морской воде
Особенности коррозии в морской воде Как возникла древнерусская письменность
Как возникла древнерусская письменность Радиоактивные изотопы в биологии и медицине
Радиоактивные изотопы в биологии и медицине Группы детей с комплексными нарушениями развития
Группы детей с комплексными нарушениями развития Britis theatre
Britis theatre Презентация к ЦОР. Тема: Формирование временных ориентировок и представлений.
Презентация к ЦОР. Тема: Формирование временных ориентировок и представлений. Урок мужества
Урок мужества Лёгкий защитный костюм Л-1
Лёгкий защитный костюм Л-1 Технологии предстерилизационной очистки и стерилизации, их значение
Технологии предстерилизационной очистки и стерилизации, их значение Каменная кладка. Каменные материалы и изделия для кладки
Каменная кладка. Каменные материалы и изделия для кладки Советский тыл в годы Великой Отечественной войны
Советский тыл в годы Великой Отечественной войны Торговая марка Ижорский глушитель
Торговая марка Ижорский глушитель