Слайд 2

Цели: формирование общеучебных умений и навыков.
Задачи:
образовательные: изучить строение и свойства аммиака; рассмотреть
донорно – акцепторный механизм образования химической связи; развить умения по составлению окислительно-восстановительного баланса уравнений реакций
воспитательные: формирование умений работать с учебной и дополнительной литературой ; провести профориентационную информацию.
познавательные: развивать интерес к предмету, умение высказывать свои мысли, логически рассуждать, соблюдать технику безопасности при встрече с аммиаком в быту.
Слайд 3

План
1.Состав молекулы аммиака
2.Строение молекулы аммиака
3.Физические свойства аммиака
4.Химические свойства аммиака
5.Получение аммиака
6.Применение аммиака
Слайд 4

1.Состав молекулы аммиака
Слайд 5

2. Строение молекулы.
NH3
Молекула полярная, имеет форму треугольной пирамиды с атомом
азота в вершине, ∠HNH = 107,3°.
Слайд 6
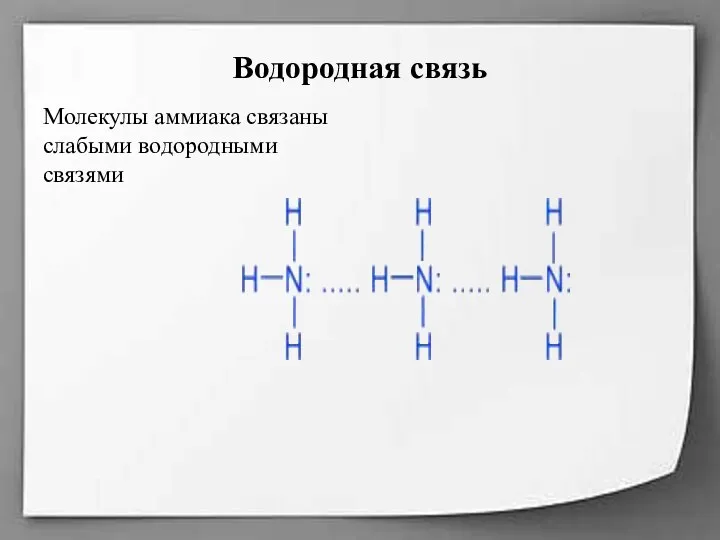
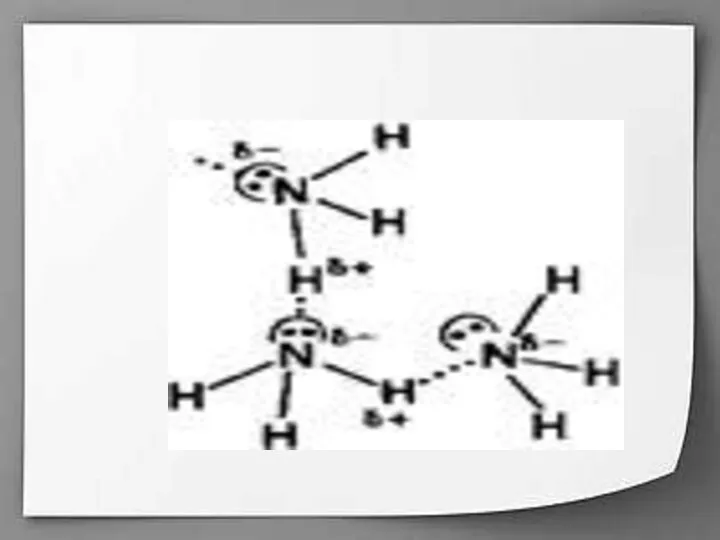
Водородная связь
Молекулы аммиака связаны слабыми водородными связями
Слайд 7
Слайд 8

3. Физические свойства аммиака.
изучите физические свойства аммиака по учебнику;
рассчитайте его плотность
по воздуху Dвозд = 29/МNН3;
предложите способ собирания газа в лабораторных условиях.
Слайд 9

3.Физические свойства.
NH3 – газ без цвета, с резким запахом, почти в
два раза легче воздуха, при охлаждении до -33,6оС он сжижается, а при температуре -77,8оС превращается в твердое белое вещество, хорошо растворим в воде.
Слайд 10
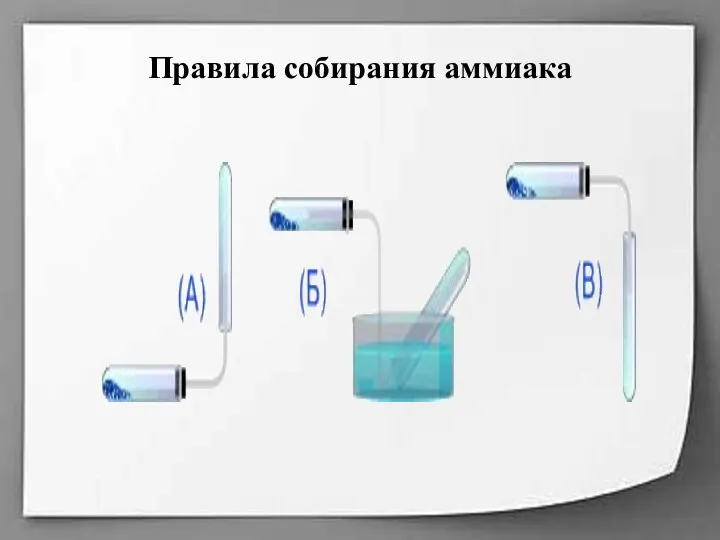
Правила собирания аммиака
Слайд 11

4. Химические свойства аммиака
I.Реакции, идущие без изменения степени окисления.
1)Растворение аммиака в
воде.
NH3 + Н2O ↔ NH4OH ↔ NH4+ + OH-
Слайд 12

Растворение аммиака в воде.
Слайд 13
Слайд 14

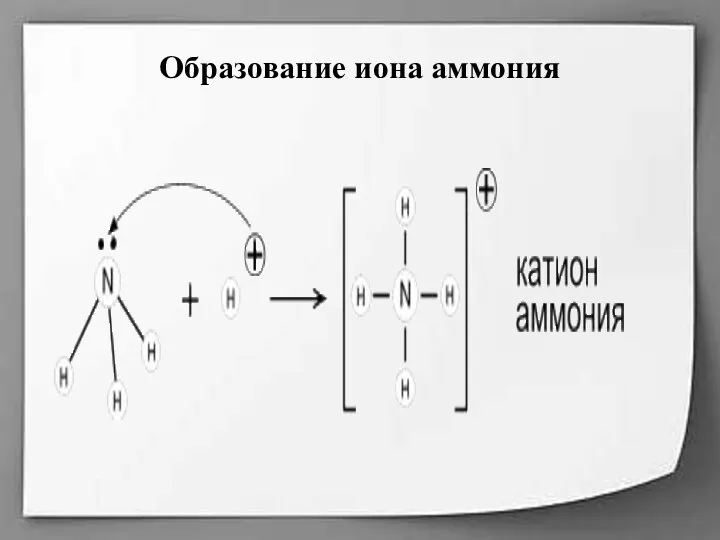
2) Взаимодействие с кислотами.
Слайд 15

Аммиак реагирует с кислотами с образованием солей аммония.
NH3 + HCl
→ NH4Cl
2NH3 + H2SO4 → (NH4)2SO4
NH3 + HNO3 → NH4NO3
Слайд 16

II. Реакции, идущие с изменением степени окисления.
1.Аммиак- непрочное соединение и при
нагревании разлагается.
2N-3H3 ←t°→ N20 + 3H2
Слайд 17

2.Горение аммиака в кислороде
Слайд 18

1. В отсутствии катализатора.
4N-3H3 + 3O2 → 2N20 + 6Н2O
Слайд 19

3.Каталитическое окисление аммиака
Слайд 20

4N-3H3 + 5O2 → 4N+2O + 6Н2O
В присутствии катализатора
Слайд 21

4.Аммиак способен восстанавливать оксиды малоактивных металлов .
3Cu+2O + 2N-3H3 →
3Cu0 + N20 + 3Н2O
Слайд 22

IV.Получение аммиака.
Работа с учебником. Прочитайте с. 47-48 учебника. Запишите уравнения
реакций получения аммиака а) в промышленности
б) в лаборатории.
Слайд 23

а) в промышленности
N2 + 3H2 → 2NH3
б) в лаборатории.
2NH4Cl +
Ca(OH)2 –t°→ CaCl2 + 2NH3↑ + 2Н2O
(NH4)2SO4 + 2KOH –t°→ K2SO4 + 2NH3↑ + 2Н2O
Слайд 24

Слайд 25

Распознавание аммиака
а) по запаху;
б) по посинению влажной лакмусовой бумажки
в) по появлению
белого дыма от поднесенной стеклянной палочки, смоченной HCl( конц.)
Слайд 26

Слайд 27

5.Применение аммиака.
NH3
1) в холодильных установках;
2) в медицине и быту;
3)
для производства азотной кислоты, солей аммония;
4) как удобрение
Слайд 28

IV. Закрепление изученного материала.
1.Азот при обычных условиях – это:
а) тяжелый металл;
б) бесцветная маслянистая жидкость; в) одноатомный инертный газ; г)газ без цвета и запаха, молекула двухатомная.
2.реакция между хлоридом аммония и гидроксидом кальция идет потому, что
а) выпадает осадок; б) выделяется газ – аммиак; в)образуется растворимая соль; г) реакция не идет.
3.Аммиак горит в кислороде в присутствии катализатора с образованием?
а) азота; б)оксида азота (II); в)оксида азота (III); г) образуется азотная кислота.
4. степень окисления азота в молекуле аммиака?
а) 0; б) +3; в) -3; г)+5.
5.Нашатырь –это:
А) раствор аммиака в воде; б) раствор аммиака в спирте; в) хлорид аммония; г) поваренная соль



























 Инструкция для участника итогового сочинения
Инструкция для участника итогового сочинения Ремонт зубчатых колес коробки подач токарных станков
Ремонт зубчатых колес коробки подач токарных станков Визитка группы раннего возраста Ладушки
Визитка группы раннего возраста Ладушки Лето, Лето к нам пришло! Средняя группа Ласточка
Лето, Лето к нам пришло! Средняя группа Ласточка Основы рекреологии
Основы рекреологии Типы химических реакций
Типы химических реакций Бытие 1-2. Сотворение и его значение
Бытие 1-2. Сотворение и его значение Обмен веществ
Обмен веществ Использование многослойных лоскутов при восстановительной хирургии в ЧЛО. Принципы микрососудистой хирургии в ЧЛО
Использование многослойных лоскутов при восстановительной хирургии в ЧЛО. Принципы микрососудистой хирургии в ЧЛО Знакомство с жителями Страны Чувств
Знакомство с жителями Страны Чувств Взаимодействие токов. Магнитное поле. Вектор магнитной индукции. Линии магнитной индукции
Взаимодействие токов. Магнитное поле. Вектор магнитной индукции. Линии магнитной индукции Знакомый и незнакомый картофель
Знакомый и незнакомый картофель Обыкновенные дроби
Обыкновенные дроби Совместная деятельность
Совместная деятельность Презентация Руссая народная кукла. Домашние обрядовые куклы
Презентация Руссая народная кукла. Домашние обрядовые куклы Презентация к внеклассному мероприятию Изготовление поделки РАДУГА
Презентация к внеклассному мероприятию Изготовление поделки РАДУГА Аппаратное обеспечение компьютера
Аппаратное обеспечение компьютера Права ребёнка. Презентация.
Права ребёнка. Презентация. Оперативная память
Оперативная память Россия советская и постсоветская 1953 – 2008 гг
Россия советская и постсоветская 1953 – 2008 гг Донецко-Криворожская республика. Артем(Ф.А.Сергеев)
Донецко-Криворожская республика. Артем(Ф.А.Сергеев) Аналоговый датчик линии
Аналоговый датчик линии Я Научу Тебя Творить
Я Научу Тебя Творить Собака - лучший друг человека!
Собака - лучший друг человека! Формы взаимодействия психолога с коллективом
Формы взаимодействия психолога с коллективом Безопасность, гигиена, эргономика, ресурсосбережение. Эксплуатационные требования к компьютерному рабочему месту
Безопасность, гигиена, эргономика, ресурсосбережение. Эксплуатационные требования к компьютерному рабочему месту Игра - путешествие
Игра - путешествие Правовой режим земель населенных пунктов
Правовой режим земель населенных пунктов