Содержание
- 2. ЦЕЛИ : Повторить и закрепить знания о строении атома и молекулы азота. Изучить физические и химические
- 3. ДЕВИЗ УРОКА : «Нет жизни без азота, ибо он является непременной составной частью белков.» Д.Н.Прянишников
- 4. ИСТОРИЯ ОТКРЫТИЯ К.Шееле и Г.Кавендиш получили азот 1772г. Д.Резерфорд описал получение и свойства 1787г. Лавуазье предложил
- 5. НАХОЖДЕНИЕ В ПРИРОДЕ: 1)В СВОБОДНОМ СОСТОЯНИИ В АТМОСФЕРЕ (78%), 2)В СВЯЗАННОМ СОСТОЯНИИ (СМОТРИ ТАБЛИЦУ)
- 6. СТРОЕНИЕ И СВОЙСТВА АТОМА 2 период, 5 группа, главная подгруппа Содержит на внешнем энергетическом уровне 5
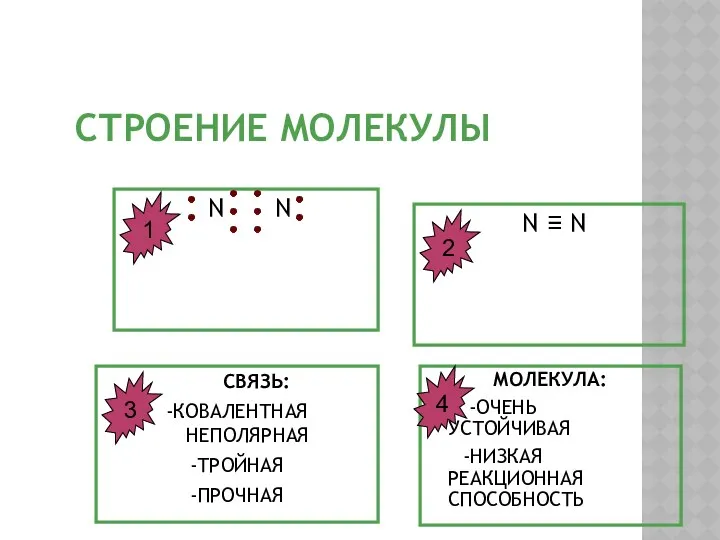
- 7. СТРОЕНИЕ МОЛЕКУЛЫ N N N ≡ N СВЯЗЬ: -КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ -ТРОЙНАЯ -ПРОЧНАЯ МОЛЕКУЛА: -ОЧЕНЬ УСТОЙЧИВАЯ -НИЗКАЯ
- 8. ФИЗИЧЕСКИЕ СВОЙСТВА. Газ без цвета, запаха и вкуса Плохо растворим в воде Немного легче воздуха, плотность
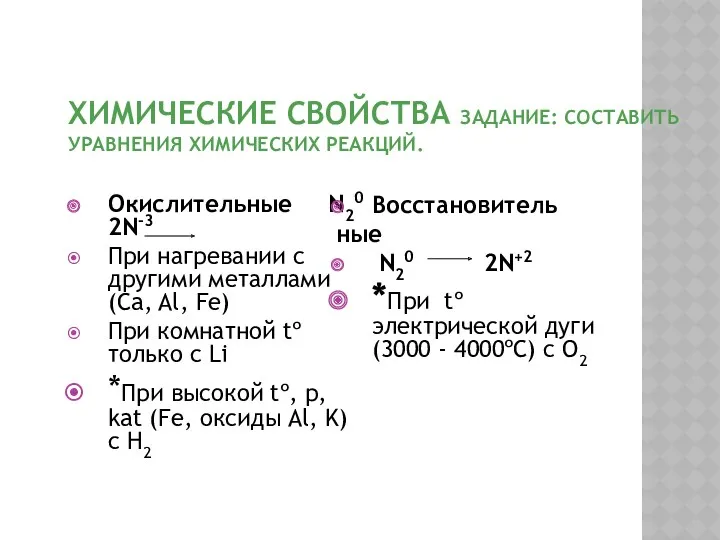
- 9. ХИМИЧЕСКИЕ СВОЙСТВА ЗАДАНИЕ: СОСТАВИТЬ УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ. Окислительные N20 2N-3 При нагревании с другими металлами(Ca, Al,
- 10. ПРИМЕНЕНИЕ АЗОТА Применение Получение аммиака и азотной кислоты. Создание инертной атмосферы в металлургии. Производство азотных удобрений.
- 11. ПОЛУЧЕНИЕ АЗОТА Получение В промышленности – из жидкого воздуха В лаборатории – разложением неустойчивых соединений азота
- 12. Закрепление нового материала
- 13. Рефлексия (работа в парах) Название темы – одно существительное Описание темы – два прилагательных Описание действия
- 15. Скачать презентацию









 Difference between a few and few
Difference between a few and few Организационный классный час. Начало 4 четверти
Организационный классный час. Начало 4 четверти Вещий сон: миф или реальность
Вещий сон: миф или реальность Проекты-презентации
Проекты-презентации Защитное вооружение русской дружины
Защитное вооружение русской дружины Mobile Phone
Mobile Phone Соборы Московского Кремля
Соборы Московского Кремля Микроконтроллеры PIC16R8x
Микроконтроллеры PIC16R8x Автомобильная промышленность Японии
Автомобильная промышленность Японии Современные образовательные технологии
Современные образовательные технологии История возникновения образа Золотой век Голливуда 40-х годов
История возникновения образа Золотой век Голливуда 40-х годов Аналитическая геометрия. Линии на плоскости и их уравнения
Аналитическая геометрия. Линии на плоскости и их уравнения 20231015_otkrytyy_urok_tsifry_anlanticheskiy_poligon
20231015_otkrytyy_urok_tsifry_anlanticheskiy_poligon 1С Парфюм Логистик
1С Парфюм Логистик Использование логических устройств в вычислительной технике
Использование логических устройств в вычислительной технике Обратные задачи вероятностных расчётов конструкций
Обратные задачи вероятностных расчётов конструкций Проект SDR приемника
Проект SDR приемника Комплексный подход к системе оценки результатов образования согласно ФГОС
Комплексный подход к системе оценки результатов образования согласно ФГОС Рождество Христово
Рождество Христово Модуль действительного числа
Модуль действительного числа Люди и роботы. Насколько они похожи
Люди и роботы. Насколько они похожи Тибетский тест личности
Тибетский тест личности Industry of fish and fish products
Industry of fish and fish products загадки о профессиях
загадки о профессиях Разработка бизнес-плана дизайн-агентства RedGrаy
Разработка бизнес-плана дизайн-агентства RedGrаy Урок-рефлексии по теме Соли
Урок-рефлексии по теме Соли Поурочные планы, внеклассные мероприятия
Поурочные планы, внеклассные мероприятия Созидательное и разрушительное общение. Конфликты. Модели поведения в конфликте
Созидательное и разрушительное общение. Конфликты. Модели поведения в конфликте