Содержание
- 2. Повторение Определите вид химической связи, составьте электронные формулы образования веществ: NH3, Li3N, Cl2, Na2S, H2S, Mg.
- 3. 5. Какие из приведённых утверждений верны? А. Вещества с молекулярной решёткой имеют низкие температуры плавления и
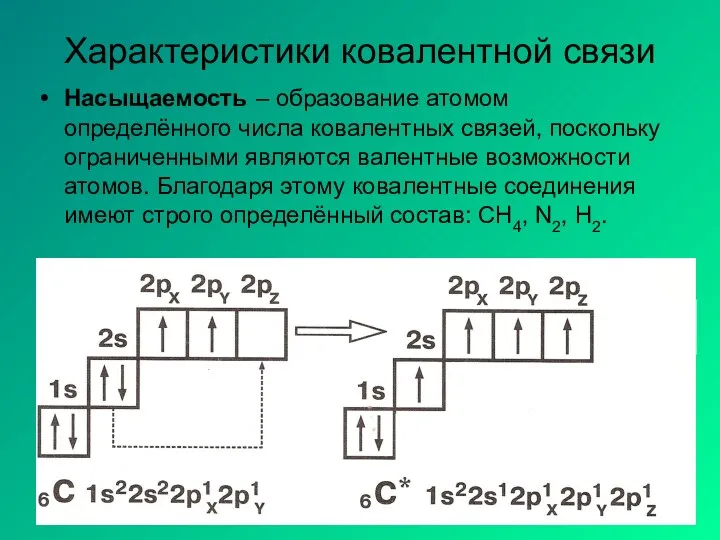
- 4. Характеристики ковалентной связи Насыщаемость – образование атомом определённого числа ковалентных связей, поскольку ограниченными являются валентные возможности
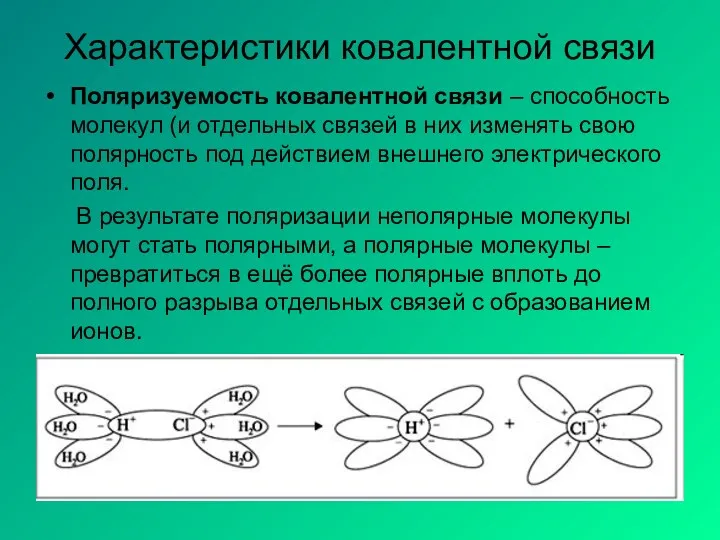
- 5. Характеристики ковалентной связи Поляризуемость ковалентной связи – способность молекул (и отдельных связей в них изменять свою
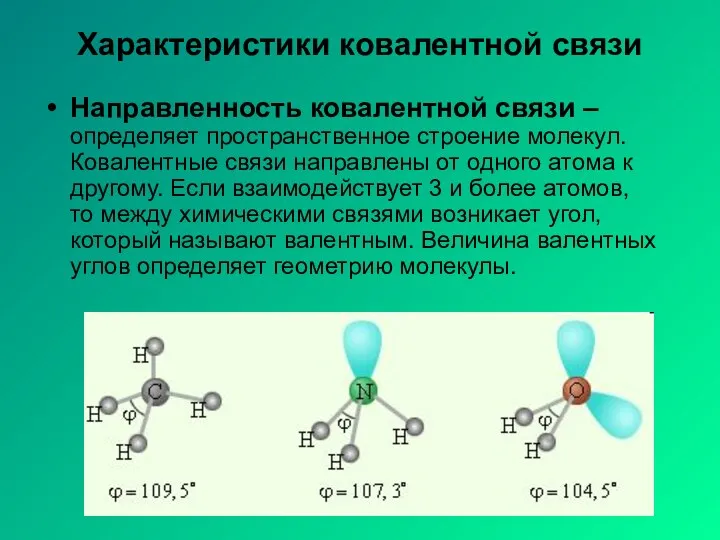
- 6. Характеристики ковалентной связи Направленность ковалентной связи – определяет пространственное строение молекул. Ковалентные связи направлены от одного
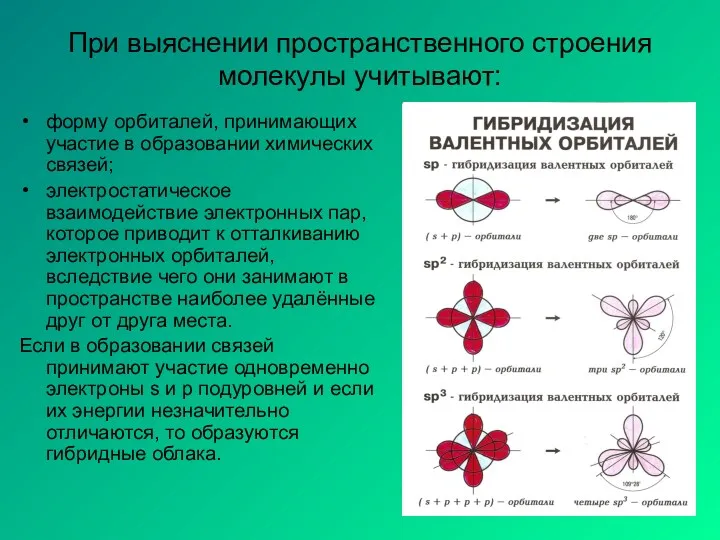
- 7. При выяснении пространственного строения молекулы учитывают: форму орбиталей, принимающих участие в образовании химических связей; электростатическое взаимодействие
- 8. Гибридизация - процесс выравнивания электронных облаков по форме и энергии Основные положения теории гибридизации. Гибридизуются только
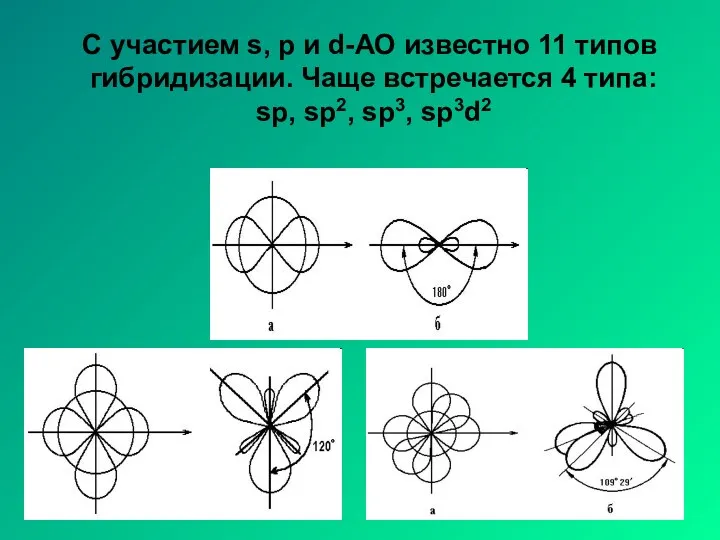
- 9. С участием s, p и d-АО известно 11 типов гибридизации. Чаще встречается 4 типа: sp, sp2,
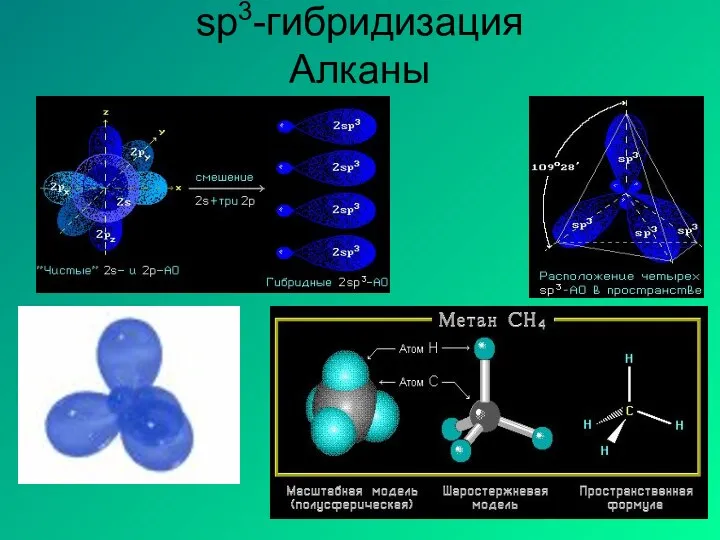
- 10. Определение типа гибридизации на примере молекулы метана. 1.Написать полную структурную формулу вещества. 2.Подсчитать число электронов, предоставляемые
- 11. sp3-гибридизация Алканы
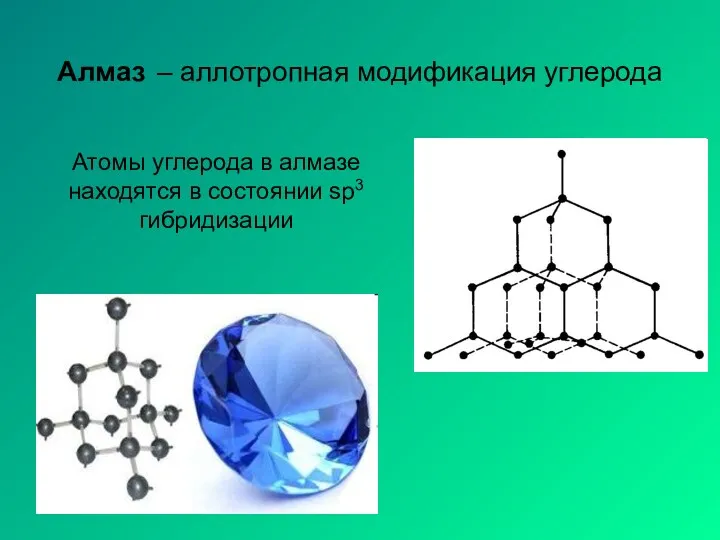
- 12. Алмаз – аллотропная модификация углерода Атомы углерода в алмазе находятся в состоянии sp3 гибридизации
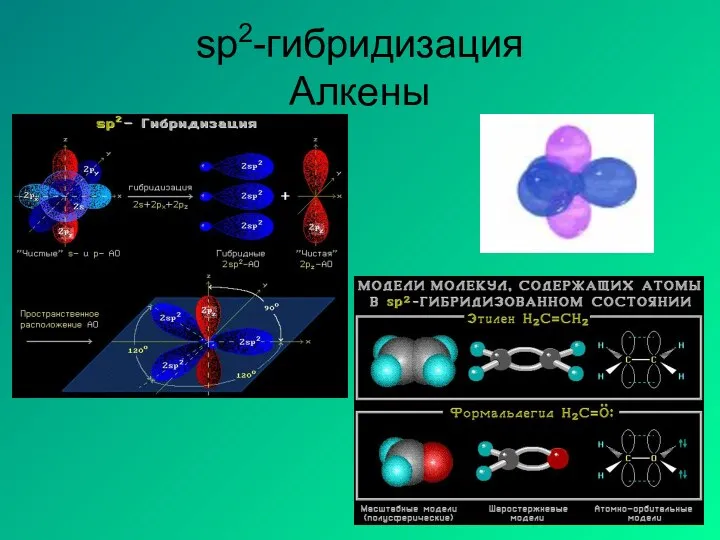
- 13. sp2-гибридизация Алкены
- 14. Графит – аллотропная модификация углерода. Атомы углерода в молекуле графита находятся в состоянии sp2 гибридизации.
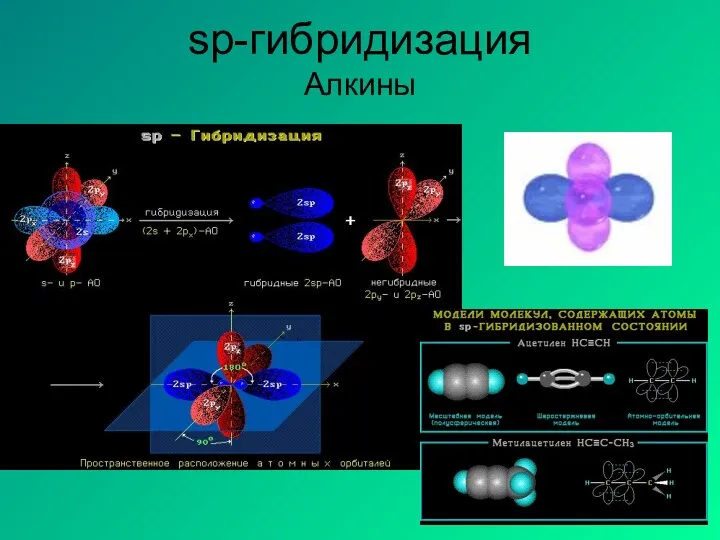
- 15. sp-гибридизация Алкины
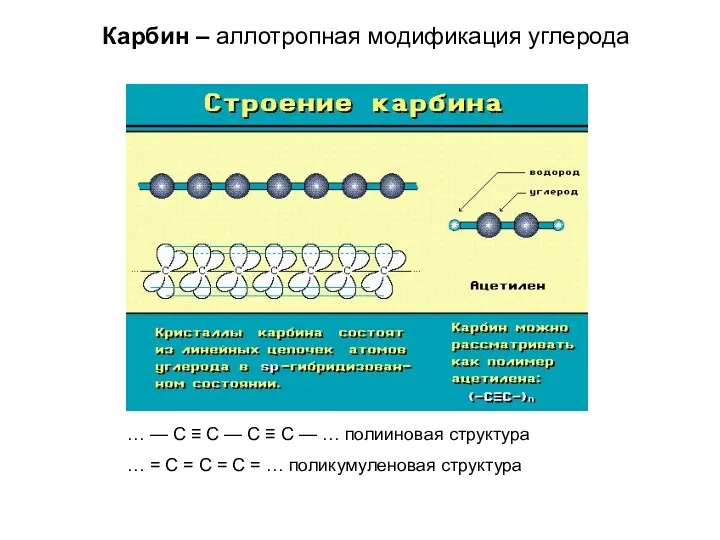
- 16. Карбин – аллотропная модификация углерода … — С ≡ С — С ≡ С — …
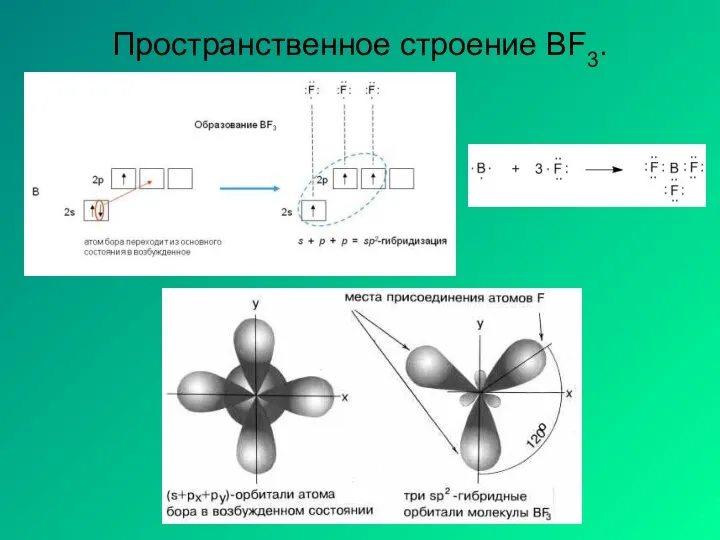
- 17. Пространственное строение BF3.
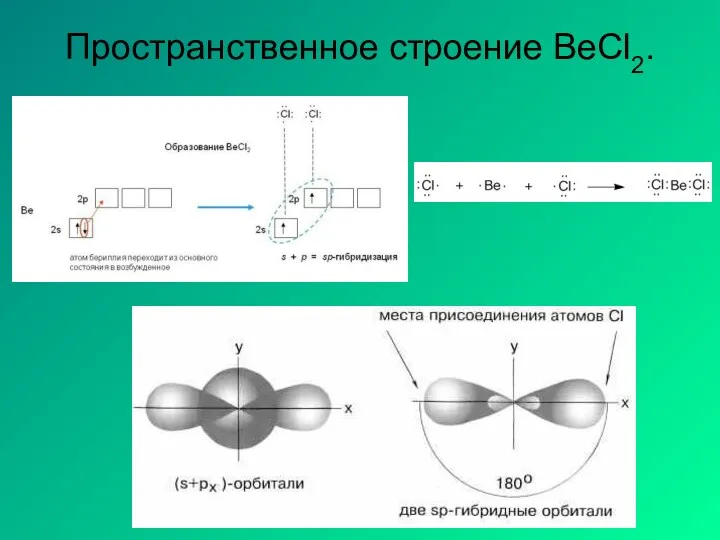
- 18. Пространственное строение BeCl2.
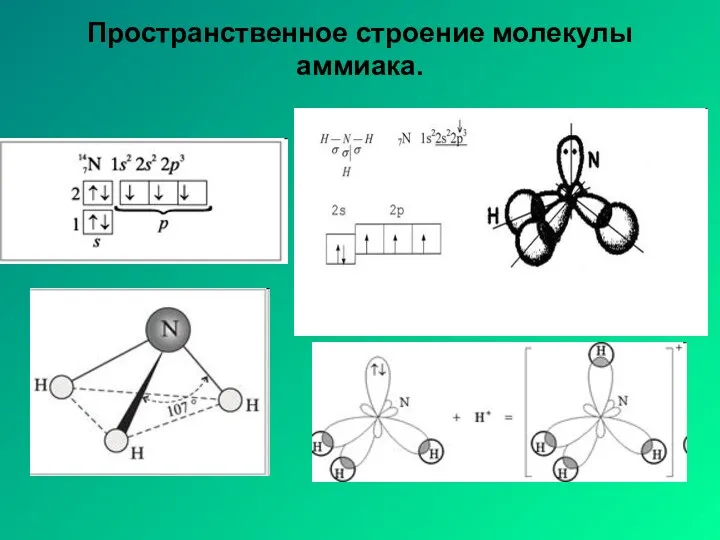
- 19. Пространственное строение молекулы аммиака.
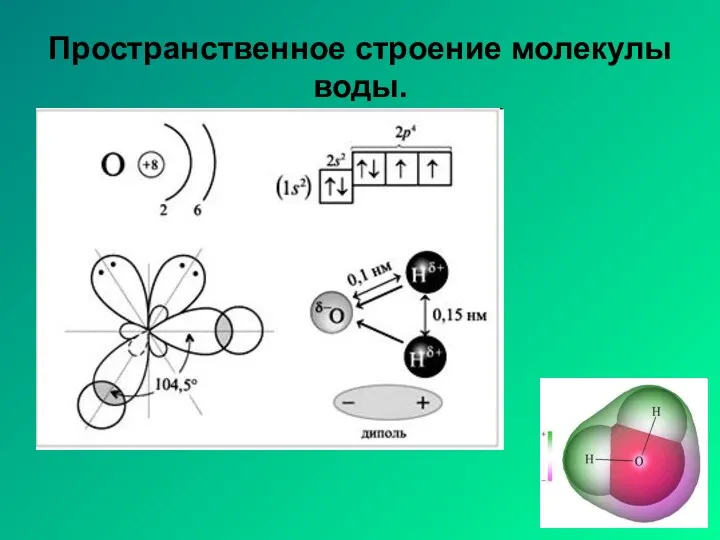
- 20. Пространственное строение молекулы воды.
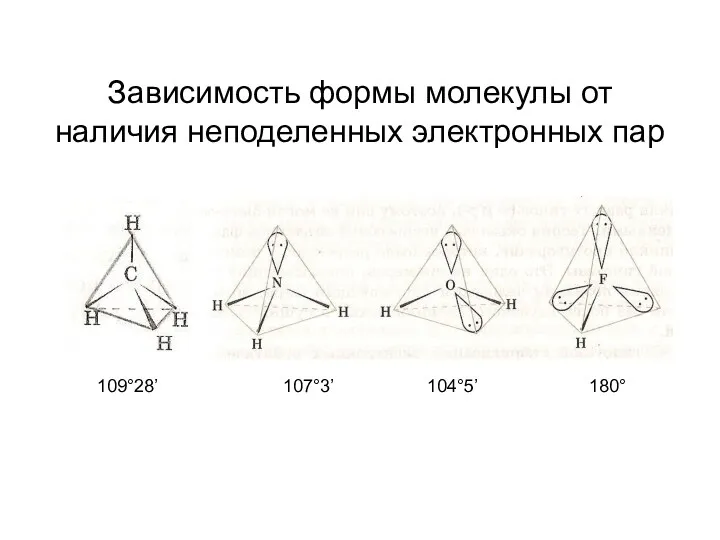
- 21. Зависимость формы молекулы от наличия неподеленных электронных пар 109°28’ 107°3’ 104°5’ 180°
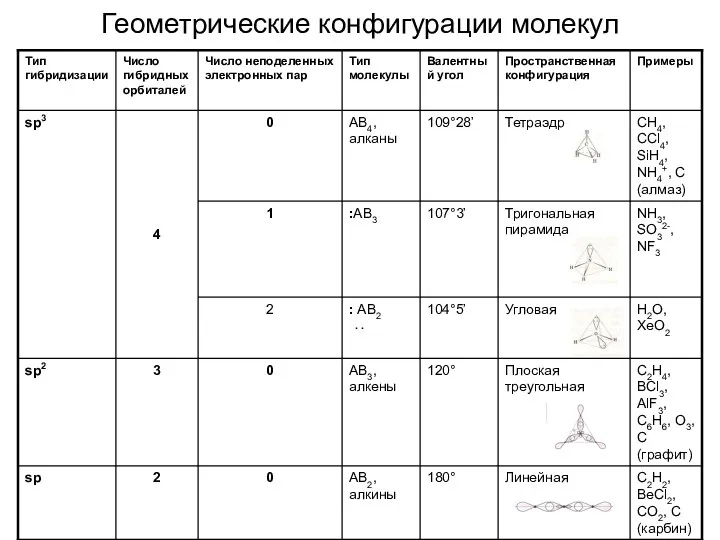
- 22. Геометрические конфигурации молекул
- 23. Вопросы для закрепления Даны формулы веществ: а) C2H4; г) Н2О; ж) С (алмаз); к) C2H2; б)
- 24. 3. Анионы PO43-, SO42-, ClO4- имеют тетраэдрическое строение. Анионы BO33-, CO32-, NO3- имеют форму плоского треугольника.
- 26. Скачать презентацию







 Семинарское занятие кружка Волшебный карандаш - Рисуем горы. Наш горный край
Семинарское занятие кружка Волшебный карандаш - Рисуем горы. Наш горный край Sector Team Умный дом
Sector Team Умный дом Аминокислоты. Открытие аминокислот
Аминокислоты. Открытие аминокислот Применение здоровьесберегающих технологий в работе с детьми и семьей в средней группе
Применение здоровьесберегающих технологий в работе с детьми и семьей в средней группе Серге́й Па́влович Королёв
Серге́й Па́влович Королёв Тема 1 УП
Тема 1 УП Графические материалы на комиссию №6. Генеральный план города Ижевска
Графические материалы на комиссию №6. Генеральный план города Ижевска Частицы
Частицы Понятие, значение, система особенной части уголовного права. Понятие, значение и основы квалификации преступлений
Понятие, значение, система особенной части уголовного права. Понятие, значение и основы квалификации преступлений Город Глазов в Удмуртской Республике России
Город Глазов в Удмуртской Республике России Гидроцилиндры общего назначения. Варианты задач
Гидроцилиндры общего назначения. Варианты задач Вышивка крестом
Вышивка крестом Патогенез плохих выступлений
Патогенез плохих выступлений Презентация к ЮБИЛЕЮ детского сада ТЕРЕМОК
Презентация к ЮБИЛЕЮ детского сада ТЕРЕМОК Новый год
Новый год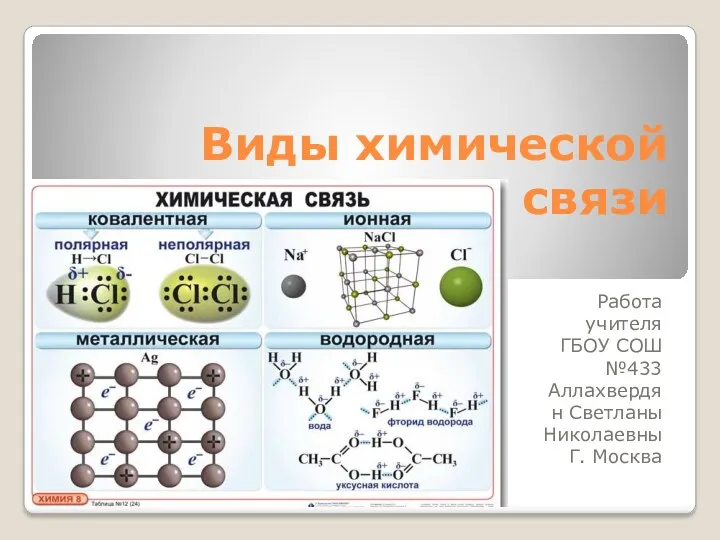 виды химической связи
виды химической связи Принципова схема підземної газифікації
Принципова схема підземної газифікації Права ребенка через социальные взаимоотношения.
Права ребенка через социальные взаимоотношения. Экологические сообщества
Экологические сообщества Методика ортопедического лечения литыми вкладками
Методика ортопедического лечения литыми вкладками Требования к оформлению исследовательской работы для научно-исследовательской конференции
Требования к оформлению исследовательской работы для научно-исследовательской конференции Вертикальные резервуары
Вертикальные резервуары Структура Базельских стандартов. Обзор
Структура Базельских стандартов. Обзор Перпендикуляр и наклонная. Угол между прямой и плоскостью
Перпендикуляр и наклонная. Угол между прямой и плоскостью Республика Крым
Республика Крым ДИСЛЕКСИЯ – МУЛЬТИФАКТОРНАЯ МОДЕЛЬ.
ДИСЛЕКСИЯ – МУЛЬТИФАКТОРНАЯ МОДЕЛЬ. Упражнение в определении лексического значения глагола
Упражнение в определении лексического значения глагола презенетантация на тему Душа танца
презенетантация на тему Душа танца