Содержание
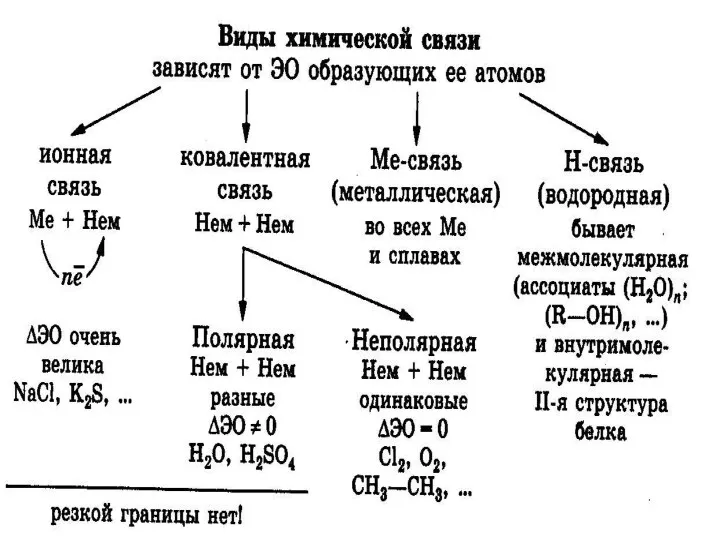
- 2. Вскрыть причину образования химической связи Актуализировать знания о видах химической связи Показать относительный характер ее классификации.
- 3. Причиной образования химической связи является стремление системы к минимуму энергии: при её образовании, как правило, энергия
- 4. Химическая связь- взаимодействие между атомами, приводящее к образованию устойчивой системы- молекулы, иона, кристалла.
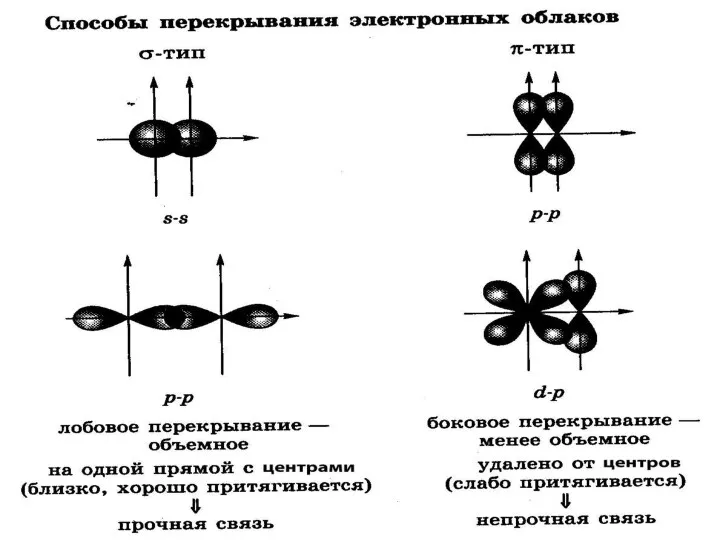
- 5. Ковалентная связь- связь между атомами, возникающая за счёт образования общих электронных пар. Способы образования общей электронной
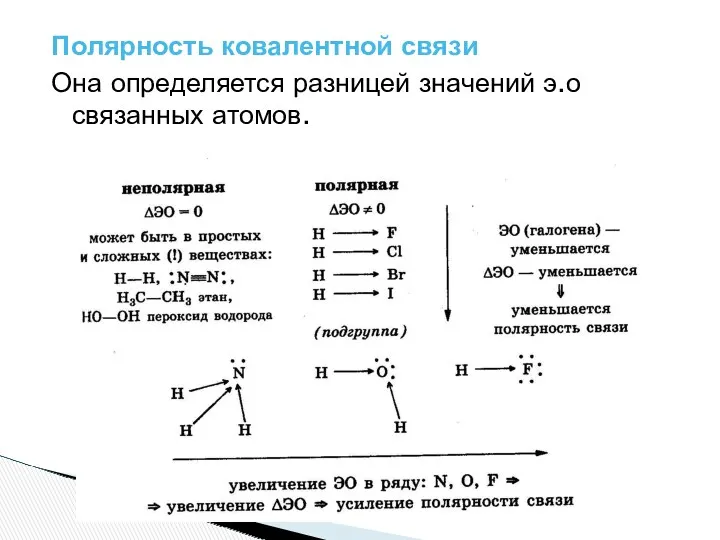
- 6. Полярность ковалентной связи Она определяется разницей значений э.о связанных атомов.
- 9. Ионная связь- электростатическое притяжение между ионами. Ионных соединений немного: элементы + элементы I и IIгр. гл.
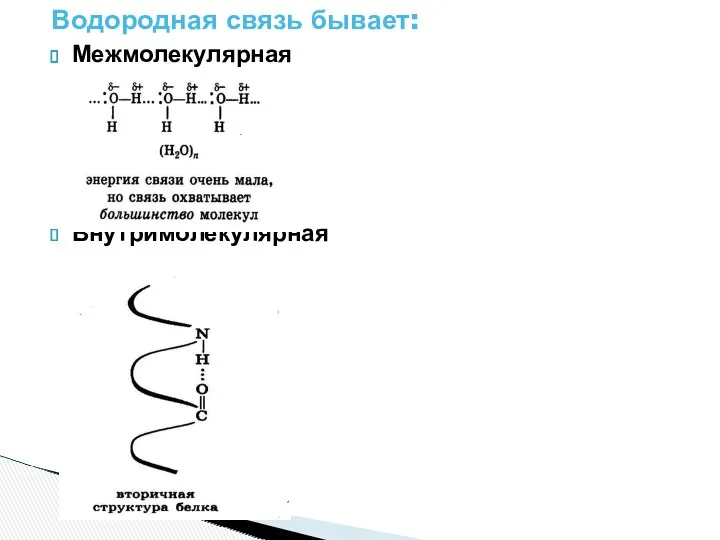
- 11. Водородная связь- электростатической притяжение между положительно поляризованными атомами водорода одной молекулы и отрицательно поляризованными атомами( F,O,N,
- 12. Водородная связь бывает: Межмолекулярная Внутримолекулярная
- 15. Скачать презентацию







 Достопримечательности Нового Уренгоя
Достопримечательности Нового Уренгоя Продолговатый мозг. Черепно-мозговые нервы продолговатого мозга
Продолговатый мозг. Черепно-мозговые нервы продолговатого мозга Налог на прибыль организаций
Налог на прибыль организаций Нетрадиционные приемы в развитии музыкальности дошкольников
Нетрадиционные приемы в развитии музыкальности дошкольников 20230816_sera_himiya_9_klass
20230816_sera_himiya_9_klass Религия как одна из форм культуры
Религия как одна из форм культуры Профилактика самовольных уходов ребенка из семьи
Профилактика самовольных уходов ребенка из семьи Творческий коррекционно - образовательный проект Стихи и сказки К. И. Чуковского
Творческий коррекционно - образовательный проект Стихи и сказки К. И. Чуковского Импульсные сверхширокополосные сигналы и перспективы их применения в РЭС
Импульсные сверхширокополосные сигналы и перспективы их применения в РЭС Библиотека молодым: поиск позитивных и действенных форм работы
Библиотека молодым: поиск позитивных и действенных форм работы Радиационная безопасность на предприятиях нефтегазового комплексе
Радиационная безопасность на предприятиях нефтегазового комплексе Первый этап Великой Отечественной войны 1941 – 1945 г.г
Первый этап Великой Отечественной войны 1941 – 1945 г.г Биологическое и социальное в структуре личности
Биологическое и социальное в структуре личности Отчет об итогах работы СПб ГКУ Организатор перевозок в 2015 году
Отчет об итогах работы СПб ГКУ Организатор перевозок в 2015 году Презентация к классному часу Великие женщины России
Презентация к классному часу Великие женщины России Профильное обучение
Профильное обучение Перемещение. Путь
Перемещение. Путь Тест по произведению Д.И. Фонвизина Недоросль
Тест по произведению Д.И. Фонвизина Недоросль Профессия электрик
Профессия электрик Школьный спортивный клуб Спасатель
Школьный спортивный клуб Спасатель Повышение эффективности развития овощеводства в ОАО Фирма Вейно Могилевского района
Повышение эффективности развития овощеводства в ОАО Фирма Вейно Могилевского района Химия элементов VA группы
Химия элементов VA группы Разработка автоматизированной системы градуировки датчиков температуры
Разработка автоматизированной системы градуировки датчиков температуры обобщение знаний по теме Главные особенности природы Земли презентация
обобщение знаний по теме Главные особенности природы Земли презентация Пьеса Старший сын. Александр Вампилов
Пьеса Старший сын. Александр Вампилов Полевой маршрут и камеральная обработка материалов
Полевой маршрут и камеральная обработка материалов Ускорение свободного падения на других планетах
Ускорение свободного падения на других планетах Викторина. Евангельские сюжеты в искусстве
Викторина. Евангельские сюжеты в искусстве