Содержание
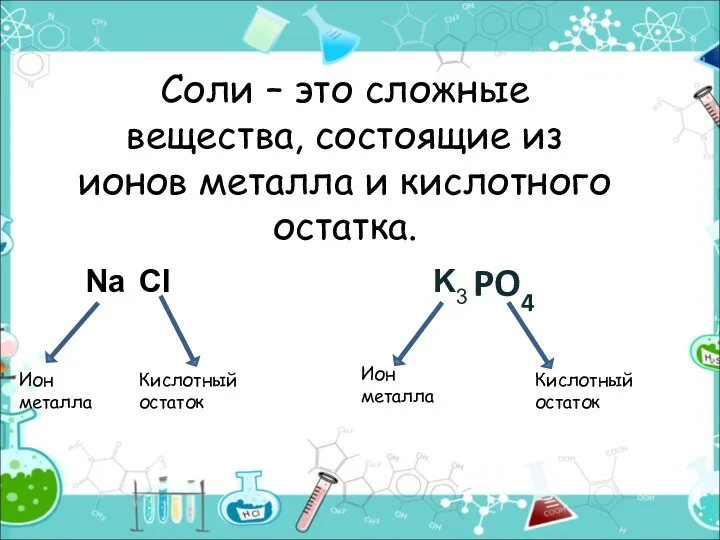
- 2. Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка. PO4 Ион металла Кислотный
- 3. Классификация 1. По составу кислотного остатка СОЛИ средние кислые Na 2SO4 K3PO4 NaHSO4 K2HPO4
- 4. Номенклатура средних солей магния Название кислотного остатка Наименование металла в родительном падеже МgСL2 хлорид
- 5. Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в
- 6. Химические свойства 1. Взаимодействие с металлами: SnCl2 + Zn ? ZnCl2 + Sn
- 7. Химические свойства 2. Взаимодействие со щелочами: 2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
- 8. Химические свойства 3. Взаимодействие солей между собой КСl + AgNO3 → AgCl + KNO3
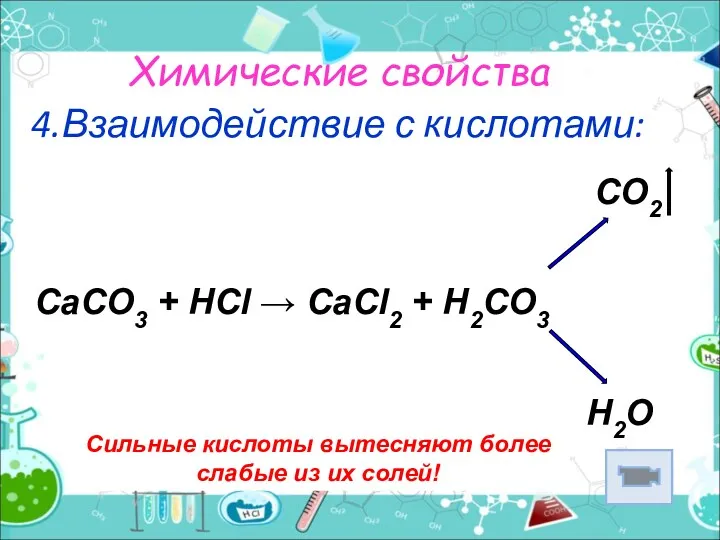
- 9. Химические свойства 4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO2 CaCO3 +
- 10. Химические свойства Разложение при нагревании СаСО3= СО2 + Н2О
- 11. Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O
- 13. Скачать презентацию








 Организация хирургической стоматологической помощи населению
Организация хирургической стоматологической помощи населению Общие сведения о самолёте МиГ-29 и его силовой установке
Общие сведения о самолёте МиГ-29 и его силовой установке Неблагоприятные факторы, влияющие на численность животных
Неблагоприятные факторы, влияющие на численность животных Презентация Влияние толерантности и правовой культуры на нравственное воспитание дошкольников
Презентация Влияние толерантности и правовой культуры на нравственное воспитание дошкольников 20231010_prezentatsiya_k_uroku
20231010_prezentatsiya_k_uroku Дорожные знаки для пешеходов
Дорожные знаки для пешеходов Города на старых водных торговых путях
Города на старых водных торговых путях Главные праздники в различных религиях
Главные праздники в различных религиях Текстура деформации
Текстура деформации Синхронные машины. Лекция №10
Синхронные машины. Лекция №10 Сервисные комплексы
Сервисные комплексы Подборка и анализ поселков численностью 2000 человек
Подборка и анализ поселков численностью 2000 человек Семинар Талант и гениальность
Семинар Талант и гениальность Человек и Бог в православии
Человек и Бог в православии Урок логопеда для учащихся 3 класса по теме Звуки З и С
Урок логопеда для учащихся 3 класса по теме Звуки З и С Цель и задачи пропедевтики внутренних болезней. Лекция №1
Цель и задачи пропедевтики внутренних болезней. Лекция №1 Архитектурное проектирование общественных зданий. Лекция 6
Архитектурное проектирование общественных зданий. Лекция 6 Маркетинговые возможности спортивных сооружений
Маркетинговые возможности спортивных сооружений Масленица
Масленица Шаблоны презентаций - 14
Шаблоны презентаций - 14 Урок по географии Реки России
Урок по географии Реки России ЭЛОУ-АТ-6 (блок ЭЛОУ). Электродегидратор
ЭЛОУ-АТ-6 (блок ЭЛОУ). Электродегидратор Ознакомительный тест Углеводы. Моносахариды
Ознакомительный тест Углеводы. Моносахариды Общие положения о договоре
Общие положения о договоре Презентация к уроку технология 4 класс с творческими проектами детей. Тема Дизайн календаря
Презентация к уроку технология 4 класс с творческими проектами детей. Тема Дизайн календаря Основные нормы ПС
Основные нормы ПС Инженерный анализ методом конечных элементов. Работа со сборками. Задание контактов
Инженерный анализ методом конечных элементов. Работа со сборками. Задание контактов Природа человека. Цель и смысл жизни человека
Природа человека. Цель и смысл жизни человека