Содержание
- 2. Цели. Повторить основные положения теории электролитической диссоциации и окисления и восстановления. Рассмотреть сущность электролиза, как окислительно-восстановительного
- 3. Тема урока: «ЭЛЕКТРОЛИЗ»
- 4. С точки зрения химии: «Электролиз это - совокупность окислительно-восстановительных процессов, протекающих на электродах при пропускании электрического
- 5. С точки зрения физики: «Электролиз – это процесс выделения на электродах вещества, связанный с окислительно -
- 6. Какие реакции называются окислительно – восстановительными? Что такое окисление? Что такое восстановление? Что такое электролит? Что
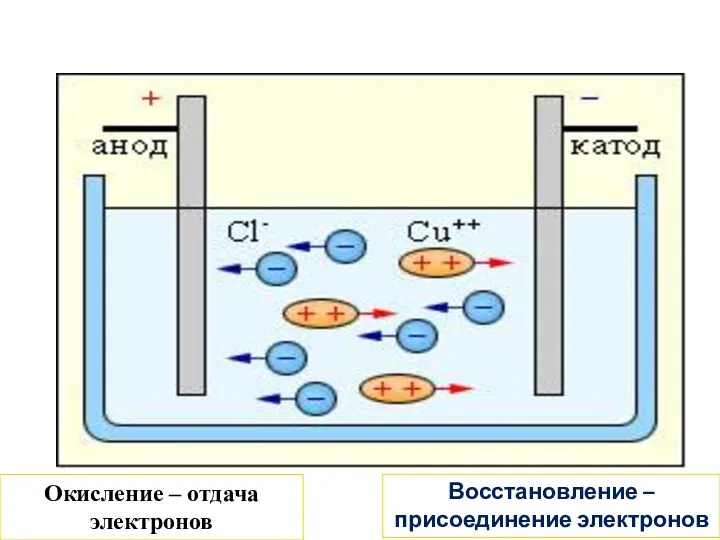
- 7. Окисление – отдача электронов Восстановление – присоединение электронов
- 8. Катодные процессы в водных растворах электролитов :катионы или молекулы воды принимают электронов и восстанавливаются. Li,K,Ca, |
- 9. Правило №2. А) При электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления
- 10. Анионы по их способности окисляться располагаются в следующем порядке: Iˉ,Brˉ,S²ˉ,Clˉ,OHˉ, SO4²ˉ,NO3ˉ,Fˉ -------------------------------------------------→ Восстановительная активность уменьшается
- 12. Скачать презентацию








 IOS (Basic Input Output System) – базовая система ввода/вывода
IOS (Basic Input Output System) – базовая система ввода/вывода Уголовная ответственность несовершеннолетних
Уголовная ответственность несовершеннолетних Презентация проекта Создание книги Краткой энциклопедии правил поведения на улице для детей и взрослых
Презентация проекта Создание книги Краткой энциклопедии правил поведения на улице для детей и взрослых Железнодорожный транспорт. Организация работ по ремонту аккумуляторной батареи НК-125 при ТР-1
Железнодорожный транспорт. Организация работ по ремонту аккумуляторной батареи НК-125 при ТР-1 Визуальная диагностика дерматитов (контактно-аллергический, атопический, токсикодермический)
Визуальная диагностика дерматитов (контактно-аллергический, атопический, токсикодермический) Захар Федорович Дорофеев
Захар Федорович Дорофеев Уполномоченные по охране труда профсоюза – представители работников
Уполномоченные по охране труда профсоюза – представители работников Алкены. 10 класс
Алкены. 10 класс Человек и мир камня
Человек и мир камня Технологическое производство и методы получение белково-витаминных концентратов
Технологическое производство и методы получение белково-витаминных концентратов Персональный компьютер
Персональный компьютер Презентация к занятию по колористике Своя игра
Презентация к занятию по колористике Своя игра Динамические структуры данных
Динамические структуры данных Передача видео
Передача видео Классификация запасов и ресурсов. Методы подсчета запасов нефти и газа. Содержание отчета по подсчету запасов
Классификация запасов и ресурсов. Методы подсчета запасов нефти и газа. Содержание отчета по подсчету запасов Канфесійныя адносіны ў канцы ХVІІІ – першай палове ХІХ ст
Канфесійныя адносіны ў канцы ХVІІІ – першай палове ХІХ ст Презентация к уроку Природные источники углеводородов
Презентация к уроку Природные источники углеводородов Особливості роботи машинних сільськогосподарських агрегатів (лекция № 1)
Особливості роботи машинних сільськогосподарських агрегатів (лекция № 1) Поколения эвм
Поколения эвм Emerge BPO Introduction
Emerge BPO Introduction ТЕСТЫ ПО ГЕОГРАФИИ ДЛЯ 8 КЛАССА ПО ТЕМЕ ВНУТРЕННИЕ ВОДЫ РОССИИ
ТЕСТЫ ПО ГЕОГРАФИИ ДЛЯ 8 КЛАССА ПО ТЕМЕ ВНУТРЕННИЕ ВОДЫ РОССИИ Компания Prouve
Компания Prouve Сальвадор Дали
Сальвадор Дали Результаты выращивания форели в условиях КФХ Горное
Результаты выращивания форели в условиях КФХ Горное Молекулярная динамика. Вчера, сегодня, завтра
Молекулярная динамика. Вчера, сегодня, завтра Инструменты нанотехнологий. Сканирующая зондовая микроскопия
Инструменты нанотехнологий. Сканирующая зондовая микроскопия Фотоотчет с утренника, посвященного Международному Женскому Дню
Фотоотчет с утренника, посвященного Международному Женскому Дню Презентация
Презентация