Содержание
- 2. Как наша прожила б планета? Как люди жили бы на ней Без теплоты, магнита, света И
- 3. Проблемный вопрос. Что произойдёт, если в раствор или расплав электролита опустить электроды, которые присоединены к источнику
- 4. Электролиз – дословно: «лизис» – разложение, «электро» – электрическим током. Цель урока: изучить сущность и применение
- 5. Электролиз – это окислительно- -восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав
- 6. Электролиз План Электролиз расплава. Электролиз раствора. Сущность электролиза. Применение. Выводы.
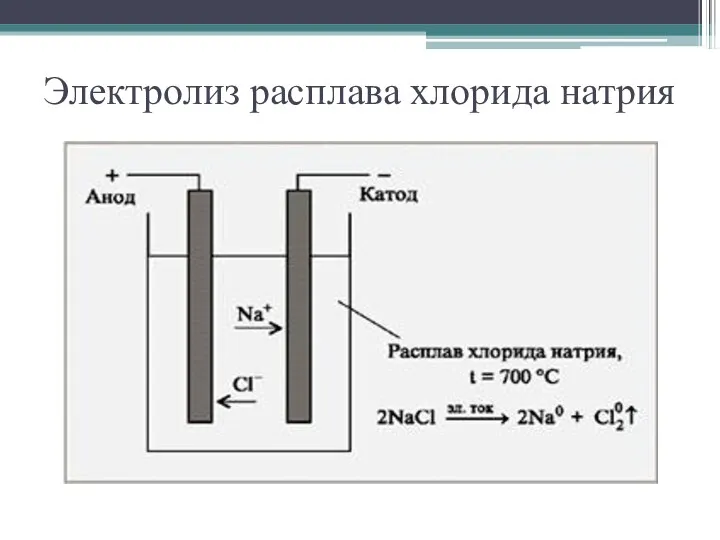
- 7. Электролиз расплава хлорида натрия
- 8. Электролиз является окислительно – - восстановительным процессом: на катоде всегда идёт процесс восстановления, на аноде всегда
- 9. Для определения результатов электролиза водных растворов существуют следующие правила: Процесс на катоде не зависит от материала
- 10. Процесс на аноде зависит от материала анода и от природы аниона. Если анод нерастворимый, т.е. инертный
- 11. Электрическая энергия Химическая энергия Электролиз Раствор NaCl Катод(-) Анод(+) H2О Расплав NaCl Катод(-) Анод(+) Na+ +
- 12. Работа с учебником (стр. 109-110) Проанализируйте процесс электролиза водного раствора сульфата натрия. Используя инструкции, запишите катодный
- 13. Сущность электролиза состоит в том, что за счёт электрической энергии осуществляется химическая реакция, которая не может
- 14. Внимательно наблюдайте за результатами электролиза сульфата меди. 1. Запишите катодный и анодный процессы, суммарное уравнение процесса.
- 15. Проверь себя! CuSO4 → Cu2+ + SO42- H2O Катод (-) Cu2+ SO42- Анод (+) Cu2+ +
- 16. Посмотрев видеофрагмент процесса электролиза иодида калия, ответьте на вопросы: 1. Какие продукты образовались на катоде и
- 17. Электролиз раствора иодида калия
- 18. Применение электролиза Катодные процессы Анодные процессы В гальваностегии ( никелирование, серебрение). В гальванопластике (изготовление копий). Получение
- 19. Гальванопластика политехнического государственного музея «Георгий Победоносец» Барельеф «Портрет Б.С.Якоби»
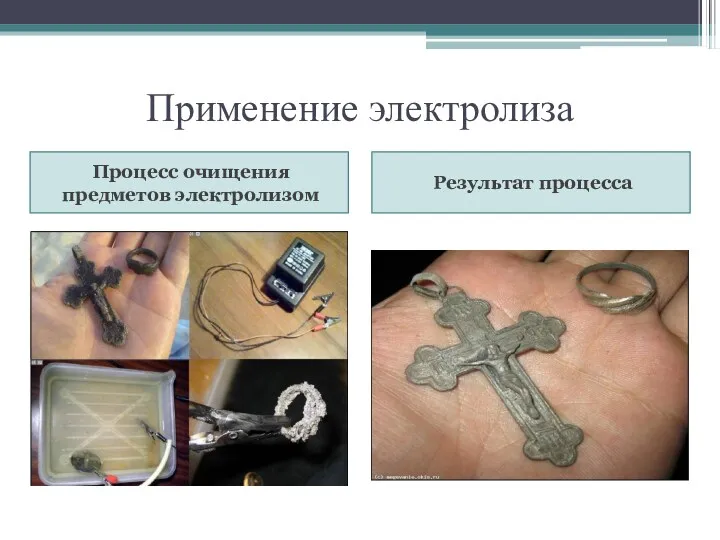
- 20. Применение электролиза Процесс очищения предметов электролизом Результат процесса
- 21. Установите правильную последовательность. окислительно-восстановительные реакции если через раствор или расплав Электролиз – это протекающие на электродах
- 22. Ответьте на вопросы. 1. При электролизе к аноду движутся: а) катионы б) анионы в) все ионы
- 23. Рефлексия. Если вы согласны с утверждениями, поставьте плюс, а если нет, то минус. 1. Я узнал
- 24. Домашнее задание Записи в тетради. Учебник «Химия – 10», стр. 107 - 111 (читать). Выполнить упр.
- 26. Скачать презентацию




















 Школа дошколят Звонкие ладошки занятие 1
Школа дошколят Звонкие ладошки занятие 1 Ұлттық экономика: мазмұны, құрылымы және нәтижесін
Ұлттық экономика: мазмұны, құрылымы және нәтижесін Клавиатура. Группы клавиш
Клавиатура. Группы клавиш Космизм как стиль
Космизм как стиль Презентация Кайбицкий район
Презентация Кайбицкий район Сцепленное наследование и рекомбинация
Сцепленное наследование и рекомбинация Консультация для педагогов Использование мнемотехники в развитии связной речи
Консультация для педагогов Использование мнемотехники в развитии связной речи Презентация для игры к 23 февраля - 1 класс
Презентация для игры к 23 февраля - 1 класс Селекторы. Урок 9
Селекторы. Урок 9 Призентация Целевые ориентиры ФГОС ДО
Призентация Целевые ориентиры ФГОС ДО Неметаллы - простые вещества
Неметаллы - простые вещества Шлифовальные станки
Шлифовальные станки ЧАСЫ
ЧАСЫ Трудности русского языка. Написание с заглавной и строчной буквы
Трудности русского языка. Написание с заглавной и строчной буквы Агрессия как социально-психологический феномен
Агрессия как социально-психологический феномен Решение задач по теме: Площадь круга. Площадь кругового сектора
Решение задач по теме: Площадь круга. Площадь кругового сектора 9 мая 1945 – День Победы
9 мая 1945 – День Победы Классный час на тему: Толерантность - путь к миру.
Классный час на тему: Толерантность - путь к миру. Что такое портфолио?
Что такое портфолио? Земля и космос
Земля и космос Тевтонский орден в Юго-Восточной Прибалтике
Тевтонский орден в Юго-Восточной Прибалтике Понятие телемедицины
Понятие телемедицины Из опыта работы руководителя объединений Судомодельный и Резьба по дереву в 2014-2015 учебном году.
Из опыта работы руководителя объединений Судомодельный и Резьба по дереву в 2014-2015 учебном году. Разработка концептуальной модели СМК
Разработка концептуальной модели СМК Базовые фильтры
Базовые фильтры Классный час, освященный 70- летию Кузбасса.
Классный час, освященный 70- летию Кузбасса. Внеклассное мероприятие(конспект+презентация). Игра Новогоднее поле чудес
Внеклассное мероприятие(конспект+презентация). Игра Новогоднее поле чудес Видеокарта
Видеокарта