Содержание
- 2. Первая гипотеза строения атома предложена английским учёным Томсоном(1904)-статическая или электронно-ионная теория
- 3. Для проверки гипотезы Томсона Резерфорд (1911) провёл серию опытов по рассеиванию альфа -частиц тонкими металлическими пластинами.
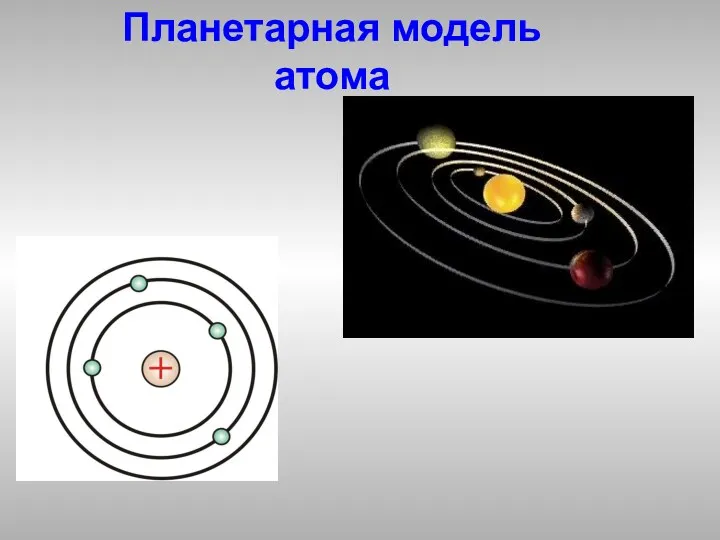
- 4. Планетарная модель атома
- 6. Zn0 имеет 30 протонов = № п-п Аr (Zn) – число протонов= число нейтронов 65 -30
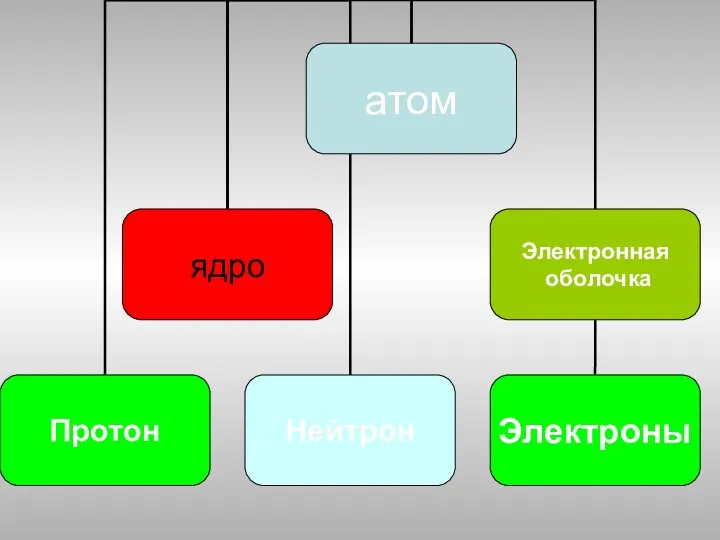
- 7. Э Z А А- атомное число – относительная атомная масса Z-зарядное число- заряд ядра атома
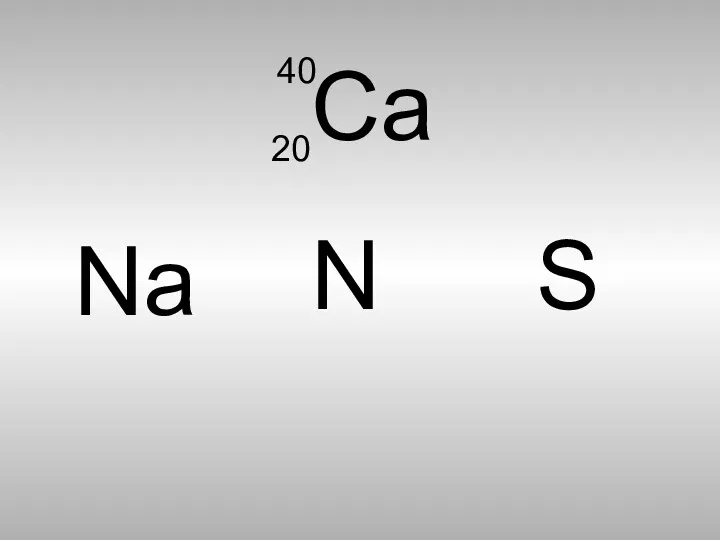
- 8. Са 40 20 Nа S N
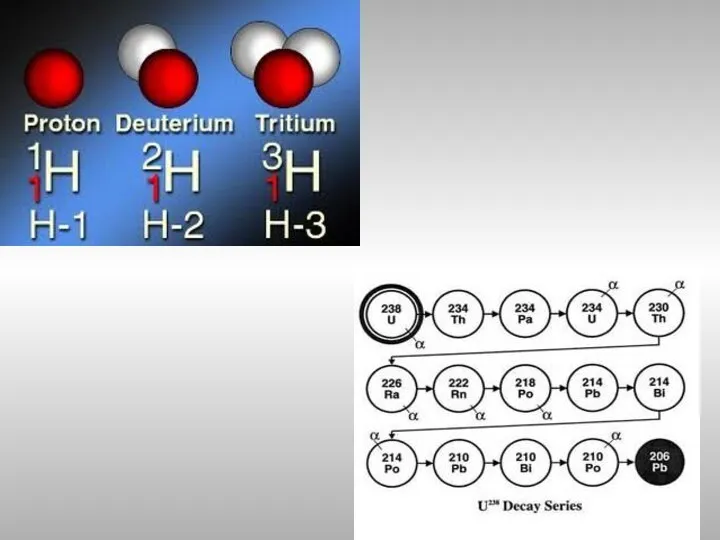
- 9. Изотопы Изотопы − атомы с одинаковыми значениями Z, но различными А то есть разное число нейтронов
- 11. Изоэлектрические частицы. Na 0 -11 электронов Na +1- 10 электронов S 0 -16 электронов S +4-
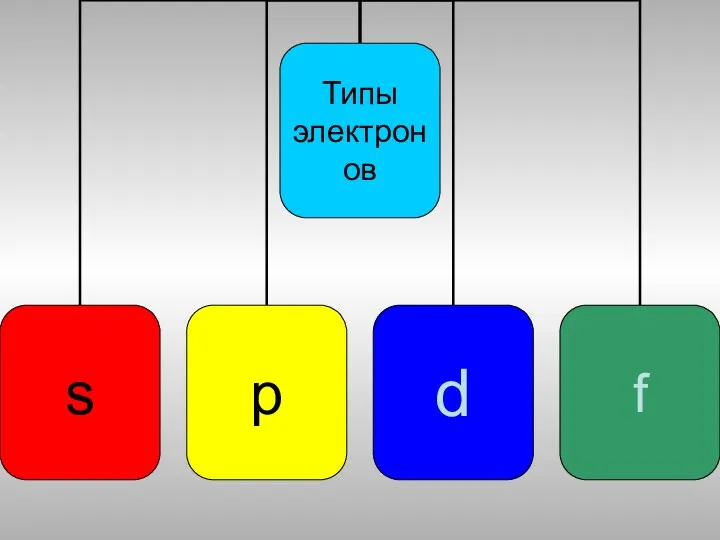
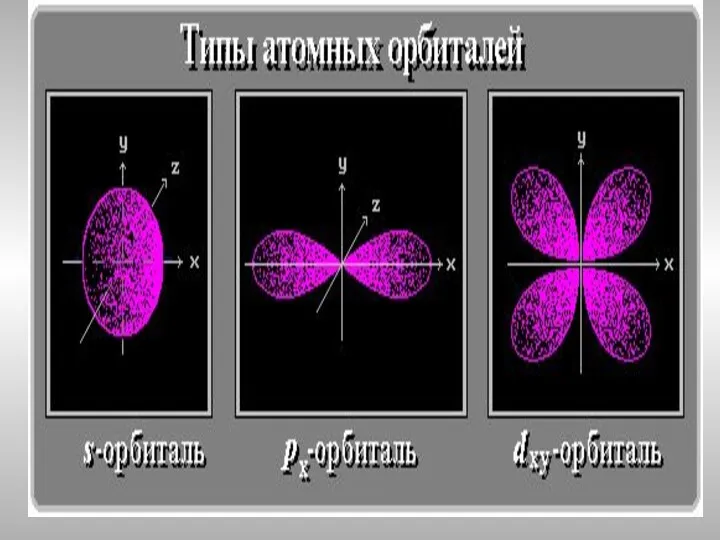
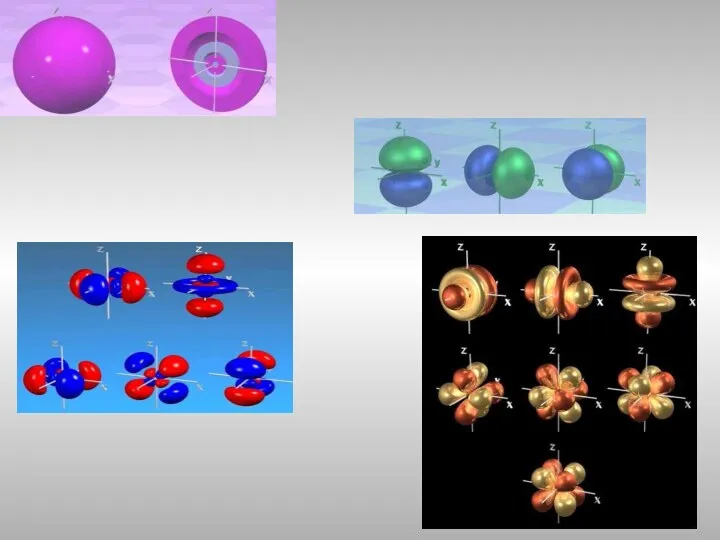
- 15. Распределение электронных подуровней
- 16. Электронная формула 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 4f 5d 5f……7f
- 17. Валентные электроны S - 1s2 2s2 2p 6 3s 3p 2 4 Se - 1s2 2s2
- 18. Точный "адрес" электрона в оболочке определяется с помощью квантовых чисел. n- главное квантового числа принимать только
- 19. ℓ-орбитальное квантовое число, номер для подуровня ℓ-изменяется от 0 до n-1 ℓ= 0 – это s-подуровень,
- 20. Магнитное квантовое число ml определяет ориентацию электронного облака в пространстве, связано с ℓ и может принимать
- 21. Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси. Может принимать значения +½ и
- 22. Принцип Паули или запрета : Никакие два электрона в одном атоме не могут характеризоваться одинаковым набором
- 23. Правило Хунда (Гунда) – суммарное значение спиновогоспинового квантового числаспинового квантового числа электронов -должно быть максимальным.
- 25. Скачать презентацию















 Презентация к уроки технологии в 3 классе Работа с тканью
Презентация к уроки технологии в 3 классе Работа с тканью Отражения. Принцип построения отражений
Отражения. Принцип построения отражений Классный час Мир моих увлечений 2-3 класс
Классный час Мир моих увлечений 2-3 класс Вавилонский царь Хаммурапи и его законы
Вавилонский царь Хаммурапи и его законы Социальное проектирование
Социальное проектирование هوش مصنوعی
هوش مصنوعی BL BOSCH 5.3 ABS. System Description of BL ABS
BL BOSCH 5.3 ABS. System Description of BL ABS Презентация подвиг во имя жизни
Презентация подвиг во имя жизни Презентация кружка Волшебные краски 2 часть
Презентация кружка Волшебные краски 2 часть Моделирование плечевого изделия с цельнокроеным рукавом. 6 класс
Моделирование плечевого изделия с цельнокроеным рукавом. 6 класс Сказочная страна (ИЗО)
Сказочная страна (ИЗО) Мы за здоровый образ жизни. Познавательный час
Мы за здоровый образ жизни. Познавательный час Создание функций из массива данных. Интерполяция. Регрессия. Прикладные методы расчета и программные комплексы (4)
Создание функций из массива данных. Интерполяция. Регрессия. Прикладные методы расчета и программные комплексы (4) Консультация для воспитателей Развитие фонематического слуха у детей дошкольного возраста
Консультация для воспитателей Развитие фонематического слуха у детей дошкольного возраста Архитектура персонального компьютера
Архитектура персонального компьютера Монтаж установки предварительной очистки ППФ. Монтаж установки очистки пропилена от каталитических ядов
Монтаж установки предварительной очистки ППФ. Монтаж установки очистки пропилена от каталитических ядов Западная Европа в ХI-ХIII веках. Инквизиция и крестовые походы
Западная Европа в ХI-ХIII веках. Инквизиция и крестовые походы Учимся рисовать ракету
Учимся рисовать ракету Многоатомные спирты
Многоатомные спирты Политико-правовые идеи Древней Греции
Политико-правовые идеи Древней Греции Фото
Фото Электротехнические комплексы
Электротехнические комплексы Общественное движение при Александре I
Общественное движение при Александре I Медиаторы нервной системы
Медиаторы нервной системы Нейрон. Его свойства и функции
Нейрон. Его свойства и функции Теоретические основы реструктуризации
Теоретические основы реструктуризации Кто говорит, что на войне не страшно, тот ничего не знает о войне. 9 мая - День Победы
Кто говорит, что на войне не страшно, тот ничего не знает о войне. 9 мая - День Победы Черная металлургия России. Изделия из чугуна и стали
Черная металлургия России. Изделия из чугуна и стали